高致病性猪繁殖与呼吸综合征病毒(J XA1-R株)微载体悬浮培养工艺研究
2016-06-27徐宏军岳丰雄舒经香翟新验胡来根杨汉春中国农业大学动物医学院北京海淀009成都天邦生物制品有限公司四川成都6000中国动物疫病预防控制中心北京朝阳005
徐宏军,韩 焘,岳丰雄,周 智,舒经香,翟新验,胡来根,杨汉春(.中国农业大学动物医学院,北京海淀009;.成都天邦生物制品有限公司,四川成都6000;.中国动物疫病预防控制中心,北京朝阳005)
高致病性猪繁殖与呼吸综合征病毒(J XA1-R株)微载体悬浮培养工艺研究
徐宏军1,2,韩焘3,岳丰雄2,周智3,舒经香2,翟新验3,胡来根2,杨汉春1
(1.中国农业大学动物医学院,北京海淀100193;2.成都天邦生物制品有限公司,四川成都610100;3.中国动物疫病预防控制中心,北京朝阳100125)
摘要:为了建立高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV)的Marc-145微载体细胞悬浮培养工艺以提高HPPRRSV抗原效价,以BC-7L生物反应器微载体悬浮培养Marc-145细胞,对HP-PRRSV接毒时间、接毒剂量、维持液血清浓度、溶氧量参数、病毒增殖温度等工艺参数进行了摸索和优化。通过细胞悬浮培养逐级放大工艺,在BC-100L生物反应器中培养Marc-145细胞,以优化后HP-PRRSV悬浮培养工艺进行3个批次的病毒悬浮培养。结果在Marc-145细胞微载体悬浮培养的第4天按照感染复数(multiplicity of infection,MOI)为0.1的剂量接毒,接毒后以2%新生牛血清的维持液进行维持培养,溶氧参数设置为40%,最佳培养温度为37℃,最佳收获病毒时间为70~74 h。BC-100L生物反应器中培养的3批病毒增殖曲线与BC-7L培养的病毒增殖曲线相近,在接毒后72 h左右达到病毒效价高峰,病毒含量均不低于108.0TCID50/mL。表明HP-PRRSV悬浮培养工艺稳定,可以实现逐级放大、规模化生产。
关键词:高致病性猪繁殖与呼吸综合征病毒;微载体;生物反应器;悬浮培养
猪繁殖与呼吸综合征(PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起猪的接触性传染病,主要引起母猪怀孕后期流产、早产、死胎和木乃伊胎等繁殖障碍。20世纪80年代美国首先报道PRRSV,后迅速传播至世界各个养猪发达国家。我国于1996年首次分离到该病毒。2006年,我国多个省份的养猪场出现高致病性猪繁殖与呼吸综合征疫情,其中商品猪的死亡率超过50%,母猪死亡率也高达5%以上,给我国养猪业造成巨大损失。目前HP-PRRSV毒株已经成为我国的主要流行(优势)株,并在我国周边国家也出现该病的流行。
目前该病的主要防控措施为疫苗免疫,然而我国猪繁殖与呼吸综合征疫苗种类多,产品质量参差不齐。本研究旨在通过微载体悬浮培养技术提高HP-PRRSV半成品培养效价,进而提高该病疫苗质量。诞生于20世纪60年代的细胞悬浮培养技术可以进行大规模细胞培养,能够获得大量的病毒产物和高质量的疫苗产品,在国外疫苗生产中普遍应用[1]。细胞微载体悬浮培养不仅可以提高单位体积内的细胞量、提高病毒产品效价,同时还具有劳动成本低、产品批间差异小等优点。动物细胞微载体悬浮培养技术已经过近50年的发展,目前已成功应用于流感等多种疫苗的生产过程中[2-3]。在国外,细胞微载体培养技术水平已经达到6t反应器自动控制的生产规模,生产效能呈几何级数放大,而我国微载体培养技术还处于起步阶段,未来必将成为我国动物疫苗生产的主流技术之一。
1 材料与方法
1.1细胞与毒种Marc-145细胞和HP-PRRSV (JXA1-R株)由中国动物疫病预防控制中心提供。HP-PRRSV(JXA1-R株)基础种子批(编号JXA1-R-JC-0002),由成都天邦生物制品有限公司提供。
1.2主要试剂DMEM培养基、新生牛血清,均购自GIBCO公司;硅化剂PlusOne Repel-Silane ES,购自GE公司;NaCl、KCl、Na2HPO4、KH2PO4等为国产分析纯试剂;CytodexⅠ型微载体,购自GE公司。
1.3主要器材BC-7L、BSISL-42L、BC-100L生物反应器。
1.4Marc-145细胞悬浮培养常规方法复苏Marc-145细胞,按照已确定的Marc-145细胞悬浮培养工艺在BC-7L生物反应器中进行Marc-145细胞悬浮培养。培养参数见表1。
1.5HP-PRRSV微载体悬浮培养最佳工艺参数优化按Marc-145细胞微载体悬浮培养工艺进行细胞培养,分别对(1)细胞接毒时间:在细胞生长3、4、5日(方案1、2、3)接毒;(2)接毒剂量:按MOI= 0.01、MOI=0.05、MOI=0.1和MOI=0.2(方案1、2、3、4)接毒;(3)维持液血清浓度:以含1%、2%、4%血清的DMEM培养液(方案1、2、3)作为接毒后细胞维持液;(4)溶氧量:以30%、40%、50%的溶氧参数(方案1、2、3)进行病毒增殖;(5)增殖温度:以35℃、36℃、37℃的培养温度(方案1、2、3)进行病毒增殖;在优化各参数时,其他对应参数固定不变。接毒24 h后,每隔6 h取样测定TCID50[4],持续取样到84 h,分别绘制病毒增殖曲线。
1.6HP-PRRSV悬浮培养工艺重复性验证利用1.5试验中(1)~(5)筛选确定的病毒增殖参数,对HP-PRRSV(JXA1-R株)的增殖进行验证,连续重复3批。
1.7HP-PRRSV悬浮培养逐级放大工艺研究与验证以优化好的Marc-145细胞悬浮培养工艺在BC-7L生物反应器中进行Marc-145细胞悬浮培养,按生物反应器常规转罐技术操作,转入BSISL-42L生物反应器进行二级培养,细胞培养密度达到要求后,再入BC-100L生物反应器进行三级培养。待BC-100L生物反应器细胞密度符合要求时,按优化确定的HP-PRRSV悬浮培养参数进行接毒与病毒培养,接毒48 h后每隔6 h进行取样测定病毒含量,监测病毒增殖情况。按照以上方法重复开展3批HP-PRRSV悬浮培养工艺验证。
2 结果
2.1病毒最佳接毒时间确定3批悬浮培养的Marc-145细胞分别在细胞生长的第3天、4天、5天接毒,绘制3批病毒增殖曲线见图1,细胞生长3日观察,长满单层,但不致密,细胞数为1.49×106个/mL,此时接毒进行HP-RRSV增殖,毒价整体较低。细胞生长4日后细胞数为2.43×106个/mL,培养第5天细胞数为2.78×106个/mL。从病毒增殖曲线可以看出,细胞生长3日后接毒和4、5日后接毒病毒增殖曲线差异显著,细胞生长4日后和5日后接毒病毒增殖曲线差异不显著。而细胞生长5天后代谢产物较第4天多,死细胞数量增加,生产周期延长。本试验确定最佳接毒时间为细胞生长第4天。
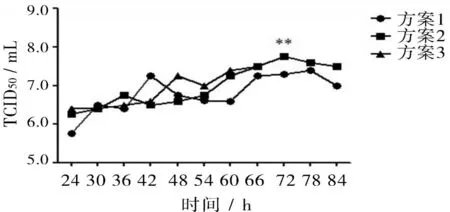
图1 不同时间接种HP-PRRSV病毒增殖曲线
2.2病毒增殖接毒剂量优化分别以不同MOI接种HP-PRRSV,接毒后不同时间取样绘制4批病毒增殖曲线见图2,从曲线图上可以看出接毒剂量MOI=0.1时,病毒增殖效果最佳,与其他接毒剂量方案的病毒增殖曲线相比差异显著。接毒后72 h病毒效价达到最高峰,随后病毒效价出现降低。
图2 不同接种HP-PRRSV剂量病毒增殖曲线
2.3病毒增殖维持液血清浓度优化以不同血清浓度的DMEM作为维持液,接毒后不同时间取样绘制病毒增殖曲线见图3。从病毒生长曲线看出,维持液血清浓度为2%和4%的病毒效价较1%高,差异显著。2%血清浓度与4%血清浓度病毒增殖曲线相近,差异不显著。但考虑生产实际的成本问题,本试验确定最佳维持液血清浓度为2%。

图3 不同血清浓度实验病毒增殖曲线
2.4病毒增殖最佳溶氧参数确定以不同DO值进行病毒增殖,接毒后不同时间取样绘制病毒增殖曲线见图4。从病毒增殖曲线看出,当DO值为40%以上时病毒增殖效价高于30%,差异显著。与50%时病毒增殖效价相近,无显著差异。考虑生产成本因素,确定40%的DO值为病毒增殖的最佳溶氧参数。
图4 DO值参数影响病毒增殖曲线
2.5病毒增殖温度优化以不同病毒培养温度进行病毒增殖,接毒后不同时间取样绘制病毒增殖曲线见图5。从病毒增殖曲线看出,35℃的病毒增殖效果最差,差异极显著。36℃和37℃病毒增殖曲线相近,无显著差异。考虑到环境温度变化对细胞有一定影响,选用37℃为最佳培养温度。
2.6病毒增殖最优参数重复验证验证结果见图6。图中可见3批病毒增殖曲线较为接近,毒价最高达到108.5TCID50/mL,最佳收毒时间为接毒后70~74 h,3批次病毒培养参数重复验证结果无显著差异。
2.7HP-PRRSV悬浮培养逐级放大工艺研究工艺放大和重复验证结果显示,病毒增殖情况良好,增殖趋势一致。在接毒70~74 h内病毒增殖达到高峰,且病毒含量均不低于108.0TCID50/mL。批间培养效果差异不显著。病毒增殖曲线见图7。
3 讨论
应用新型现代化的细胞悬浮培养工艺制造动物疫苗抗原是当前我国动物疫苗的主流发展趋势之一。猪繁殖与呼吸综合征作为我国核心的动物疫病之一,其疫苗生产工艺的悬浮化对于提高产品质量、降低生产成本具有重要的意义。HP-PRRS弱毒活疫苗因具有比灭活疫苗抗体产生快、持续时间长、保护力强等[5-6]诸多优点,已成为我国目前预防猪繁殖与呼吸综合征的主要疫苗产品。本研究通过对HP-PRRSV疫苗毒悬浮培养工艺研究,摸索出科学、稳定的PRRSV细胞悬浮培养工艺替代现有的转瓶培养工艺,克服其病毒培养效价低、批间差异大、污染因素多、难于控制等缺陷[7],显著提高HP-PRRSV半成品培养效价和生产效率,为最终全面提高HP-PRRSV活疫苗质量奠定基础。

图6 病毒增殖工艺验证病毒增殖曲线图

图7 BC-100L生物反应器培养HP-PRRSV病毒增殖曲线图
本试验基于Marc-145细胞悬浮培养的技术上开展高致病性猪繁殖与呼吸综合征悬浮培养工艺研究。系列试验结果显示,在Marc-145细胞微载体悬浮培养的第4天按照MOI=0.1的剂量接毒,接毒后以2%新生牛血清的维持液进行维持培养,以40%溶氧量在37℃进行病毒增殖,可以在接毒后70~74 h收获到高效价HP-PRRSV病毒液,病毒效价在108.0TCID50/mL以上,最高效价可达108.5TCID50/mL,比传统转瓶工艺制备的HPPRRSV抗原效价提高了10倍以上。为适应大规模生产,本试验还进行了悬浮工艺放大研究,在BC-100L生物反应器中连续培养的3批HPPRRSV,病毒增殖曲线与BC-7L培养的病毒增殖曲线相近,在接毒后72 h左右达到病毒效价高峰,病毒含量均不低于108.0TCID50/mL,证实了该悬浮培养工艺的稳定性和可放大性。本次工艺放大和重复性验证过程中3次培养的病毒增殖曲线虽然整体趋势一致,且培养效果均达到了预期水平,但在同一采样时间点上的病毒效价测定结果仍然存在一定差异(<0.5TCID50/mL),经分析造成这种差异的可能原因是:不同批次各采样时间点样品在测定TCID50时的系统误差及结果判定时人为误差导致的,后续仍需要通过生产及检验控制加以改进。
本试验利用微载体悬浮培养技术适用于多数贴壁细胞培养的特点,在细胞培养液中添加微载体,让细胞贴附在微载体表面进行生长,可以有效提高单位体积内的细胞量,提高接种病毒效价。高效价的半成品抗原,可以通过稀释进行配苗,对产品质量稳定性提供了有效保障,同时可以减少每头份疫苗中杂蛋白含量,减少疫苗免疫的副反应。无论是对产品质量的提升以及对成本的控制,细胞悬浮培养技术与传统转瓶培养工艺相比都具有较大的优势[8]。
参考文献:
[1]周欣,程海卫,王永生,等.动物细胞悬浮培养技术研究进展[J].中国畜牧兽医,2012,39(11):129-134.
[2] Rourou S,Vanderark A,Majoul S,et al.A novel animal-compo⁃nent-free medium for rabies virus production in Vero cells grown on Cytodex I microcarriers in a stirred bioreactor[J].Appl Microbi⁃ol Biotechnol,2009,85(1):53-63.
[3] Bock A,Schulze H J,Schwarzer J,et al.High-density microcarri⁃er cell cultures for influenza virus production[J].Biotechnol Prog,2011,27(1):241-250.
[4]《中华人民共和国兽药典》三部(2010年版)附录.
[5]冷雪,李真光,夏铭崎,等.高致病性猪繁殖与呼吸综合征活疫苗的研制[J].中国兽医科学,2012,41(11):1171-1175.
[6]沈武玲,齐自林,令世鑫,等.猪繁殖与呼吸综合征疫苗研究现状[J].动物医学进展,2012,33(1):117-120.
[7]梅建国.应用生物反应器生产高致病性猪繁殖与呼吸综合征病毒抗原的技术工艺研究[D].长春:吉林大学,2012.
[8]穆光慧,李嘉爱,齐冬梅.猪繁殖与呼吸综合征病毒在Marc-145细胞微载体上培养条件的研究[J].广东畜牧兽医科技,2010(4):37-40.
Study on the Process of Highly Pathogenic Porcine Reproductiveand Respiratory Syndrome Virus(HP-PRRSV J XA1-R strain)Microcarrier Suspension Culture
XU Hong-jun1,2,HAN Tao3,YUE Feng-xiong2,ZHOU Zhi3,SHU Jing-xiang2,ZHAI Xin-yan3,HU Lai-gen2,YANG Han-chun1
(1.China agricultural university college of Veterinary Medicine,Beijing 100193,China;2.Chengdu Teck-bank bio-products co.,LTD,Chengdu 610100,China;3.Chinese animal disease center,Beijing 100125,China)
Abstract:To increase the highly pathogenic porcine reproductive and respiratory syndrome virus(HP-PRRSV)titer by the es⁃tablishment of Marc-145 cell microcarrier suspension culture process.The optimal tests for HP-PRRSV inoculated timeand quanti⁃ty,serum concentration of maintaining medium dissolved oxygen(DO),and culture temperature were performed on microcarrier suspension cultured Marc-145 cells in BC-7L bioreactor.The optimized parameters were also verified in BC-100L bioreactor fol⁃lowing Marc-145 cell suspension culture amplifying process.The results showed that the best viral inoculation time was 4 h after Marc-145 cell suspension culture,and the best viral inoculation quantity was 0.1 of MOI.The suspending cells were cultured with DMEM medium containing 2% of newborn calf serum at 37℃and the DO parameter was set to 40%.The viral proliferation curves of HP-PRRSV in BC-100L bioreactor were similar to that in BC-7L biological reactor .The viral titer peak appeared around 72 h after inoculation and the viral titer was more than 108.0TCID50/mL.HP-PRRSV suspension culture process is stable and can be used to produce large-scale virus particles in BC-100L bioreactor.
Key words:HP-PRRSV;Microcarrier;Biological Reactor;Suspension Culture Corresponding author:YANG Han-chun
中图分类号:S852.65+1
文献标志码:A
文章编号:0529-6005(2016)05-0024-04
收稿日期:2016-01-20
作者简介:徐宏军(1975-),男,兽医师,博士,从事动物疫苗研发工作,E-mail:5401737@qq.com
通讯作者:杨汉春,E-mail:yanghanchun1@cau.edu.cn
