脂多糖诱导奶牛乳腺上皮细胞中炎性因子和核转录子-κB的表达
2016-06-27朱丽萍杨文浩任婷婷李华涛曹荣峰刘楚君田文儒青岛农业大学动物科技学院山东青岛266109
朱丽萍,杨文浩,任婷婷,丛 霞,李华涛,曹荣峰,刘楚君,田文儒(青岛农业大学动物科技学院,山东青岛266109)
脂多糖诱导奶牛乳腺上皮细胞中炎性因子和核转录子-κB的表达
朱丽萍,杨文浩,任婷婷,丛霞,李华涛,曹荣峰,刘楚君,田文儒
(青岛农业大学动物科技学院,山东青岛266109)
摘要:试验预探索脂多糖(LPS)刺激奶牛乳腺上皮细胞炎性因子产生时间、浓度以及其对NF-κB信号通路的激活情况。用酶消化法培养奶牛乳腺上皮细胞(bMEC);CCK-8法筛选LPS最佳刺激浓度(IR≤10%),并用其处理对数期生长的bMEC。ELISA试剂盒检测0~24 h不同处理时间细胞培养液上清中TNF-α和IL-1β表达变化,以确定炎症模型是否建立成功;用Western-Blot检测核转录因子NF-κB(p-p65和p65)及其抑制蛋白(p-IκBα和IκBα)的表达。结果显示,用酶消化法成功培养原代bMEC;CCK-8法筛选LPS的最佳致炎浓度为1 μg/mL;LPS处理后3~24 h可极显著增加奶牛乳腺上皮细胞中TNF-α和IL-1β表达,并在处理后15 min极显著提高bMEC中p-p65和p-IκBα的表达。上述结果说明,LPS能够在3~24 h内有效诱导bMEC炎症模型的建立,并能在15 min时活化奶牛乳腺上皮细胞中的NF-κB信号通路。
关键词:奶牛乳腺上皮细胞;脂多糖;TNF-α;IL-1β;NF-κB
奶牛乳腺炎是对奶牛养殖业危害最严重的疾病之一,不仅使奶牛产奶量下降,还影响乳品质量、危害食品卫生安全。大肠杆菌等革兰阴性菌是乳腺炎常见的致病菌,脂多糖(LPS)是革兰阴性菌细胞壁的特殊成分,能够使宿主机体组织器官受到损伤[1]。NF-κB能够调节与炎症、免疫密切相关的细胞介质,如细胞因子、趋化因子、细胞生长因子等[2]。因此,抑制NF-κB的活性被认为是控制炎症、免疫反应的有效方法[3]。奶牛乳腺上皮细胞是乳腺防御病原菌入侵的第一防线,起到了重要的免疫防御作用[4]。炎症发展有不同的阶段,在炎症反应强烈时用药具有最佳的治愈效果,而有关LPS刺激奶牛乳腺上皮细胞炎症因子产生和通路激活时间鲜有报道。因此,本试验通过LPS处理原代奶牛乳腺上皮细胞建立炎症模型,并观察LPS刺激后炎性因子和NF-κB通路的表达变化,以进一步确定炎症反应的时间和程度,为临床用药提供理论依据。
1 试验材料
LPS(Sigama,O111:B4);牛肿瘤坏死因子α (TNF-α)酶联免疫试剂盒和牛白细胞介素-1β(IL-1β)酶联免疫检测试剂盒,均购自南京建成生物工程研究所;Anti-Cytoκeratin 18抗体(ab668)、p-IκB-α抗体(ab12135)、IκB-α抗体(ab49978)和Anti-NF-κB p65抗体(ab90532),均购自Abcam;p-NF-κB-p65抗体(sc-33020),购自Santa cruz。
2 试验方法
2.1奶牛乳腺上皮细胞原代培养与鉴定将奶牛新鲜的乳腺组织剪成乳糜状,再分别用0.25%I型胶原酶和0.25%胰酶分步消化,以3 000 r/min离心15 min后,加入培养基终止消化,37℃恒温培养。参照多曙光等[5]方法,并加以改进,利用两种细胞对胰酶的敏感性不同进行纯化。
将原代细胞接种于盖玻片上,待细胞生长到80%~90%时,进行免疫组化鉴定。PBS冲洗、95%乙醇固定、10%山羊血清封闭、加入鼠抗牛一抗CK18(1∶200)、山羊抗鼠二抗(1∶3 000),DAB显色,苏木精复染,显微镜镜检。
2.2奶牛乳腺上皮细胞炎症模型的建立
2.2.1CCK-8法筛选LPS最佳作用浓度将处于对数生长期细胞进行96孔铺板,培养6 h,细胞贴壁后,设空白对照组和LPS(0.01、0.1、1 μg/mL和10 μg/mL)处理组,每组6个重复。将处理后细胞培养24 h后加入CCΚ-8,继续培养3 h,450 nm波长测OD值。用下列公式计算出其抑制率(IR),IR=(OD空白-OD模型)/OD空白×100%(OD=吸光值)。以细胞生长抑制率小于或最接近10%为筛选浓度的标准。
2.2.2ELISA试剂盒检测TNF-α、IL-1β将处于对数生长期的细胞进行96孔铺板,根据CCK-8确定的LPS浓度处理细胞,设空白对照组与LPS模型组(分别处理3、6、12 h和24 h),每组6个重复。按照ELISA试剂盒的操作要求进行TNF-α和IL-1β的检测。
2.3NF-κB的检测将处于对数生长期的细胞进行传代,根据CCK-8确定的LPS浓度处理细胞,设空白对照组、LPS模型组(分别处理15、30、60 min和180 min),每组3个重复。4℃下提取细胞蛋白,12 000 r/min离心5 min,取上清。加入5× SDS上样缓冲液,加热变性进行凝胶电泳,4℃条件下220 mA恒流湿转2 h,封闭2 h,兔抗牛一抗(1∶800)孵育12 h、山羊抗兔二抗(1∶3 000)孵育1 h,ECL试剂盒进行化学发光,UVP凝胶成像系统拍照检测,AlphaView软件对试验结果进行灰度值分析。
2.4数据分析采用GraphPadPrism5.01软件做统计学处理,组间差异用Dunnett单因素方差分析,均数间进行t检验,P<0.05有统计学意义。
3 结果与分析
3.1奶牛乳腺上皮细胞形态观察与鉴定细胞生长初期伴有少量成纤维细胞,成纤维细胞呈旋涡状生长,上皮细胞成团生长,二者之间生长界限明显;随着纯化次数的增多,成纤维细胞逐渐消失,上皮细胞成片生长,细胞呈典型的铺路石状,胞核呈圆形或椭圆形。免疫组化鉴定在加入CK-18抗体后,胞浆呈棕黄色(见中插彩版图1,B),细胞核采用苏木精复染,呈现紫红色。阴性对照组未加入角蛋白-18抗体(见中插彩版图1,A),胞浆呈现透明状。
3.2乳腺上皮细胞炎症模型建立
3.2.1LPS对奶牛乳腺上皮细胞的毒性作用根据判定标准,LPS致炎的最佳浓度为1 μg/mL,抑制率为8.9%(表1);随着LPS浓度的增加,细胞生长受到明显抑制。

表1 LPS对bMEC生长的抑制作用
3.2.2ELISA检测TNF-α和IL-1β的表达LPS能够极显著提高TNF-α、IL-1的表达量(P<0.01)并呈时间依赖性(图2)。TNF-α和IL-1β分别在LPS刺激后的6 h和12 h达到峰值。以上结果说明,经1 μg/mL的LPS刺激奶牛乳腺上皮细胞不同时间后,早期促炎因子TNF-α和IL-1β表达发生显著差异,奶牛乳腺上皮细胞炎症模型建立成功。
3.2.3LPS对NF-κB通路的表达的影响结果显示,LPS可以诱导奶牛乳腺上皮细胞胞浆中IκBα的磷酸化,使得细胞核中p-IκB-α表达量增多并进一步活化p65,促进其发生核移位,使得细胞核中p-p65表达量增多。并与时间呈依赖性p-IκB-α/IκB-α最高值出现在LPS刺激15 min后(图3, B);p-p65/p65最高值出现在LPS刺激30 min后(图4,B)。3 h后二者的表达量均逐渐降低,但仍然极显著高于0 min组。

图2 LPS刺激不同时间TNF-α、IL-1β的表达量
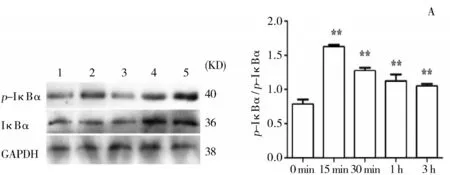
图3 LPS刺激不同时间p-IκB-α/IκB-α的比值
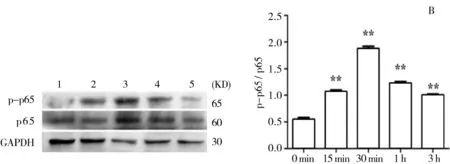
图4 LPS刺激不同时间p-p65/p65的比值
4 讨论
LPS是革兰阴性菌细胞壁外膜的主要组成成分,是引起炎症反应的关键细胞毒性因子。TNF-α和IL-1β是急性炎症早期的细胞因子,是衡量炎症模型建立与否的标志[6]。本试验发现,奶牛乳腺上皮细胞经1 μg/mL LPS处理3 h后早期促炎因子TNF-α与IL-1β均已极显著升高(P<0.01),表明奶牛乳腺上皮细胞炎症模型建立成功。而付灵梅[7]等用100 ng/mL LPS刺激人的子宫内膜上皮细胞,在48 h后成功建立炎症模型。由于不同细胞对不同血清型LPS的敏感度不同,以及刺激时间的不同,在诱导建立炎症模型时会出现LPS浓度差异。有研究报道,TNF-α的基因表达在LPS刺激后3 h达到峰值,峰值大约是平时水平的47倍[8]。IL-1β是继TNF-α之后分泌的另一种细胞因子,一般认为其表达的升高与TNF-α的表达相平行[9]。本次试验发现TNF-α的蛋白表达在LPS刺激后6 h达到峰值,IL-1β的蛋白表达在LPS刺激后12 h达到峰值,分析可能是由于基因和蛋白表达的差异性所致。
在细胞中NF-κB主要以p50/p65异源二聚体形式存在[10]。在静息状态时,p50/p65二聚体与其抑制性蛋白IκB结合形成三聚体,以非活性的复合物形式滞留于细胞质中。当细胞受到LPS等因素刺激后,IκB迅速磷酸化并与p50/p65二聚体分离,p50/p65二聚体由胞质入胞核,引起下游炎性因子和炎症介质的表达[11]。NF-κB信号通路的激活是以p65的核移位和IκB的磷酸化为标志[12]。由此我们通过选择p-p65/p65和p-IκBα/IκB-α作为研究的对象,在不同的时间段加入LPS刺激,观察IκBα与p65的磷酸化程度与时间的关系。结果显示,LPS刺激15 min时,p-IκBα/IκBα和pp65/p65含量均明显升高,这说明LPS在刺激15 min时就能够有效活化奶牛乳腺上皮细胞NF-κB信号通路,但炎性因子在LPS刺激的3 h后才有显著表达,与p-IκBα和p-p65的表达时间并不一致,说明可能炎症发生时需要先激活炎症信号通路,然后才表达炎性因子。但是NF-κB在激活后究竟如何调控下游细胞因子的表达还有待于进一步研究。此外,本试验结果是在体外培养的乳腺上皮细胞上获得的,至于在体内LPS是否会有同样的作用,还需进一步验证。
参考文献:
[1]王亨,孟霞,邱昌伟,等.脂多糖诱导奶牛乳腺上皮细胞先天性免疫反应[J].中国兽医学报,2010,30(3):398-401.
[2]张桂林,商好敏,崔晓妮,等.脂多糖诱导奶牛子宫内膜上皮细胞核因子κB的表达[J] .中国兽医科学,2010,40(10):1063-1066.
[3] Bai L,Zhai C,Han K,et al.Toll-like receptor 4-mediated nucle⁃ar factor-kappaB activation in spinal cord contributes to chronic morphine-induced analgesic tolerance and hyperalgesia in rats [J].Neurosci Bull,2014,30(6):936-948.
[4] Papamichael K,Vermeire S . Withdrawal of anti-tumour necrosis factor alpha therapy in inflammatory bowel disease[J] . World J Gastroenterol,2015,21(16):4773-4778.
[5]多曙光,吴应积,罗奋华,等.牛乳腺上皮细胞的分离培养及其生物学特性[J].动物学研究,2006,27(03):299 -305.
[6] Shen M,Duan X,Zhou P,et al.Lymphotoxin beta receptor activa⁃tion promotes bladder cancer in a nuclear factor-kappaB-depen⁃dent manner[J].Mol Med Rep,2015,11(2):783-790.
[7]付灵梅,游慧,尤昭玲,等.细菌脂多糖体外诱导子宫内膜细胞炎症模型的建立[J].中国实验方剂学杂志,2005(3):70-72.
[8] Piotrowska-Tomala K K,Bah M M,Jankowska K,et al.Lipopoly⁃saccharides,cytokines,and nitric oxide affect secretion of prosta⁃glandins and leukotrienes by bovine mammary gland during exper⁃imentally induced mastitis in vivo and in vitro[J] . Domest Anim Endocrinol,2015,52:90-99.
[9] Rashidi N,Mirahmadian M,Jeddi-Tehrani M,et al.Lipopolysac⁃charide and Lipoteichoic Acid-mediated Pro-inflammatory Cyto⁃kine Production and Modulation of TLR2,TLR4 and MyD88 Ex⁃pression in Human Endometrial Cells[J].J Reprod Infertil,2015,16(2):72-81.
[10] Piotrowska-Tomala K K,Bah M M,Jankowska K,et al.Lipopoly⁃saccharides,cytokines,and nitric oxide affect secretion of prosta⁃glandins and leukotrienes by bovine mammary gland during exper⁃imentally induced mastitis in vivo and in vitro[J] . Domest Anim Endocrinol,2015,52:90-99.
[11] Nabekura T,Hiroi T,Kawasaki T,et al.Effects of natural nuclear factor-kappa B inhibitors on anticancer drug efflux transporter hu⁃man P-glycoprotein[J].Biomed Pharmacother,2015,70:140-145.
[12] Stanisic M,Majewski W,Zurawski J,et al . IL-6,TNF-alpha,IL-1-beta arterial wall expression is independent of serum con⁃centration in patients sustaining primary or secondary open vascu⁃lar reconstructions[J].Int Angiol,2010,29(6):496-506.
The Expression of NF-κB and IκB-α Induced by LPS in Bovine Mammary Epithelial Cells
ZHU Li-ping,YANG Wen-hao,REN Ting-ting,CONG Xia,LI Hua-tao,CAO Rong-feng,LIU Chu-jun,TIAN Wen-ru
(College of Veterinary Medicine,Qingdao Agricultural University,Qingdao 266109,China)
Abstract:The aims of this study were to explore the expression of inflammatory cytokines and activation of NF-κB signal pathway in primary bovine mammary epithelial cells(bMEC)after lipopolysaccharide(LPS)stimulation.The bMECs were enzymati⁃cally digested and method of CCK-8 was used to ascertain the suitable dose of LPS(IR≤10% as the standard)for stimulating the bMECs in their exponential growth phase.The concentrations of TNF-α and IL-1β in cellular supernatants were detected by ELI⁃SA kits at 0~24 h after LPS treatment to determinate the establishment of the cellular inflammation model.The expressions of NF-κB(p-p65 and p65)and(p-IκBα and IκBα)were detected by using Western-Blot.Our results showed that bMECs were cultured successfully by using enzymatic digestion method .The optimal concentration of LPS for inducing inflammation screened by using CCK-8 was 1 μg/mL.LPS significantly increased the expressions of both TNF-α and IL-1β at 3~24 h and p-p65 and p-IκBα at 15 min after treatment in bMECs.Our data suggest that LPS induces inflammation in bMECs at 3~24 h while the NF-κB sig⁃naling pathway is activated at 15 min after treatment.
Key words:Bovine mammary epithelial cells;LPS;TNF-α;IL-1β;NF-κB
中图分类号:S823.8
文献标志码:A
文章编号:0529-6005(2016)05-0014-05
收稿日期:2015-05-20
基金项目:国家自然科学基金(31172378,31572590);山东省农业技术体系创新团队岗位(SDAIT-12-011-03)
作者简介:朱丽萍(1989-),女,硕士生,从事临床兽医学研究,E-mail:952394424@qq.com
通讯作者:田文儒,E-mail:wrtian@126.com
Corresponding author:TIAN Wen-ru
