氯胺酮对大鼠海马神经元ATP酶活性的影响
2016-06-27曹馨方魏成威于东旭刘子睿姜仁礼李欣然王冠颖肖建华东北农业大学动物医学学院黑龙江哈尔滨150030
周 彤,曹馨方,陈 希,陈 蕊,刘 沫,张 宇,魏成威,吴 越,于东旭,刘子睿,姜仁礼,李欣然,王冠颖,肖建华,高 利(东北农业大学动物医学学院,黑龙江哈尔滨150030)
氯胺酮对大鼠海马神经元ATP酶活性的影响
周彤,曹馨方,陈希,陈蕊,刘沫,张宇,魏成威,吴越,于东旭,刘子睿,姜仁礼,李欣然,王冠颖,肖建华,高利
(东北农业大学动物医学学院,黑龙江哈尔滨150030)
摘要:本试验研究不同浓度氯胺酮对大鼠海马神经元ATP酶活性的影响,并探讨氯胺酮的中枢麻醉机制。体外培养怀孕16~18 d的胎鼠神经细胞,至第8天直接给予3种不同浓度的氯胺酮,使用超微量ATP酶测定试剂盒,检测胎鼠海马中ATP酶的活力。结果显示,海马中Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的活性均受到不同程度的抑制,并且这种抑制作用的程度具有剂量依赖的趋势。据此推测氯胺酮的麻醉机制可能与抑制海马中Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的活性有关。
关键词:氯胺酮;麻醉;Na+-K+-ATP酶;Ca2+-Mg2+-ATP酶
在中枢神经系统中,参与跨膜信号转导的ATP酶(Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶)的活性与中枢神经系统功能活动关系密切,它们对维持细胞的正常生理功能起着极其重要的作用[2,4,7,9-10]。海马作为边缘系统中一个重要组成部分,在维持神经系统功能中起着重要的作用。氯胺酮是苯环己哌啶的衍生物,属于静脉全身麻醉药,临床上用作手术麻醉剂或麻醉诱导剂,具有一定的精神依赖性。本试验体外培养大鼠海马神经细胞,通过研究不同浓度氯胺酮对其ATP酶活性的影响,探讨氯胺酮对神经细胞的抑制作用。
1 试验材料与方法
1.1实验动物Wistar大鼠39只,体重200±20 g,雌雄兼备,孕16~18 d Wistar大鼠3只。购自哈尔滨医科大学。
1.2试验器材与试剂Waters600高效液相色谱系统、色谱柱Symmetry C18(4.6×150 mm,5 μm)、细胞培养箱(Thermo公司)、75 μm细胞滤网。氯胺酮(沈阳市兽药厂,20110908)、Mouse anti-MAP2antibody(Cat.no.13-1500)、细胞裂解液(北京赛驰生物科技有限公司)、蛋白定量测定试剂盒(南京建成生物工程研究所)、考马斯亮兰蛋白质含量测定试剂盒(南京建成生物工程研究所)等。
1.3实验方法
1.3.1神经细胞培养、鉴定将Wistar孕鼠手术常规断颈处死,从子宫中取出胎鼠,取出大脑浸入Hank's平衡盐溶液(含10 mmol/L HEPES、1 mmol/L丙酮酸钠)中。分离海马,用Hank's平衡盐溶液漂洗3次,将海马组织剪碎至1 mm3大小左右。0.25%胰酶37℃消化5~10 min,室温孵育5 min;分别用Hank's平衡盐溶液、BEM培养基(含10% FBS、4 500 mg/L葡萄糖、1 mmol/L丙酮酸钠、100 IU/mL青霉素、0.1 μg/mL链霉素)漂洗2次后于BEM培养基中重悬,细胞计数后接种于聚左旋赖氨酸包被的6孔板中,5% CO2、37℃培养,24~48 h后加入阿糖胞苷。每周两次用Neurobasal medium培养基(含B-27、4.0 μmol/L L-谷氨酰胺、10 IU/mL青霉素、0.1 μg/mL链霉素)进行半换液,维持神经细胞生长。
神经元的鉴定方法:MAP-2免疫荧光方法:4%多聚甲醛/蔗糖混合物室温固定10 min;0.1% TritonX-100室温孵育10 min,0.01 mol/L PBS漂洗3次;5%牛血清白蛋白室温封闭1 h,甩去多余液体,滴加一抗,4℃过夜,0.01 mol/L PBS漂洗3次;生物素化二抗室温孵育1 h,0.01 mol/L PBS漂洗3次;抗褪色封片剂封片,荧光显微镜观察结果。
1.3.2细胞给药浓度检测大鼠39只,随机分为低剂量组(D组),麻醉组(M组),高剂量组(G组)。D组腹腔注射氯胺酮10、20、30、40 mg/kg,M组腹腔注射氯胺酮50、60、70、80、90、100 mg/kg,G组腹腔注射氯胺酮150、200、300 mg/kg,每个浓度3个平行,心脏采血,高效液相色谱法(HPLC)检测血药浓度,确定氯胺酮细胞给药浓度范围。
1.3.3ATP酶活性测定根据氯胺酮在大鼠麻醉过程中的血药浓度检出值,确定氯胺酮作用于神经细胞的浓度为0.7 μg/mL、1 μg/mL、3 μg/mL、5 μg/mL。在神经细胞培养第八天进行细胞加药,每个浓度设置3个平行试验,分别在加药的0、5、10、15、20、25、30、45、60、90、120 min对细胞进行裂解,取裂解后的细胞液,用ATP酶活力的检测试剂盒进行检测。
2 结果
2.1神经元的培养及鉴定结果
2.1.1形态学观察细胞悬液接种在培养板3 h镜下观察,培养板上细胞碎片较少,贴壁的神经细胞大小均一,胞体为圆形,分散均匀,且折光度好,包体周围有光晕包围(图1-a);在培养至第4天,从形态学上观察未见其他杂质细胞,神经元胞体变长,形态随突起的方向延伸,折光度好,细胞间隐约出现突起交织状(图1-b);在培养至第8天,胞体成熟,折光度强,突起充分延展且清晰,并且相互交织成网络且密集,特征形态明显(图1-c)。

图1 大脑海马神经元体外培养3 h(a),4 d(b),8 d(c)镜下观察(倒置显微镜20×10)
2.1.2神经细胞鉴定结果EVOS倒置荧光显微镜下观察:神经元细胞培养第8天,MAP-2免疫荧光鉴定下,神经元呈荧光绿色,遍布于神经元胞体、轴突、树突明显清晰,延展充分,神经元之间交织呈网络状,呈典型的神经原细胞形态(图2)。
2.2血浆氯胺酮浓度39只大鼠给药,翻正反射消失后,心脏采血,血药浓度检测结果如表1。
2.3不同浓度氯胺酮对Na+-K+-ATP酶活性的影响如表2所示,在不同浓度氯胺酮的作用下,Na+-K+-ATP酶活性大体呈现先降低后升高的趋势。0.7 μg/mL的氯胺酮作用于神经细胞后,从10 min开始Na+-K+-ATP酶的活性降低明显,差异显著(P<0.05),而1 μg/mL、3 μg/mL和5 μg/mL的氯胺酮作用于神经细胞后,从5 min开始Na+-K+-ATP酶的活性降低明显,差异显著(P<0.05)。0.7 μg/mL和1 μg/mL的氯胺酮作用于神经细胞120 min时,Na+-K+-ATP酶的活性恢复到对照组水平,3 μg/mL和5 μg/mL的氯胺酮作用于神经细胞120min时,Na+-K+-ATP酶的活性仍没有恢复。
2.4不同浓度氯胺酮对Ca2+-Mg2+-ATP酶活性的影响如表3所示,在不同浓度氯胺酮的作用下,Ca2+-Mg2+-ATP酶活性大体呈现先降低后升高的趋势。0.7 μg/mL的氯胺酮作用于神经细胞后,从15 min开始Ca2+-Mg2+-ATP酶的活性降低明显,差异显著(P<0.05),而1 μg/mL、3 μg/mL和5 μg/mL的氯胺酮作用于神经细胞后,从10 min开始Ca2+-Mg2+-ATP酶的活性降低明显,差异显著(P<0.05)。1 μg/mL的氯胺酮作用于神经细胞90 min时,Ca2+-Mg2+-ATP酶的活性恢复到对照组水平,0.7 μg/mL、3 μg/mL和5 μg/mL的氯胺酮作用于神经细胞120 min时,Ca2+-Mg2+-ATP酶的活性恢复到对照组水平。
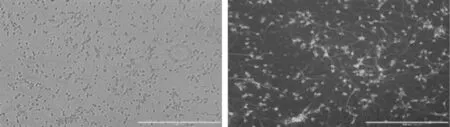
图2 大脑海马神经细胞体外培养8 d免疫荧光染色镜下对比观察
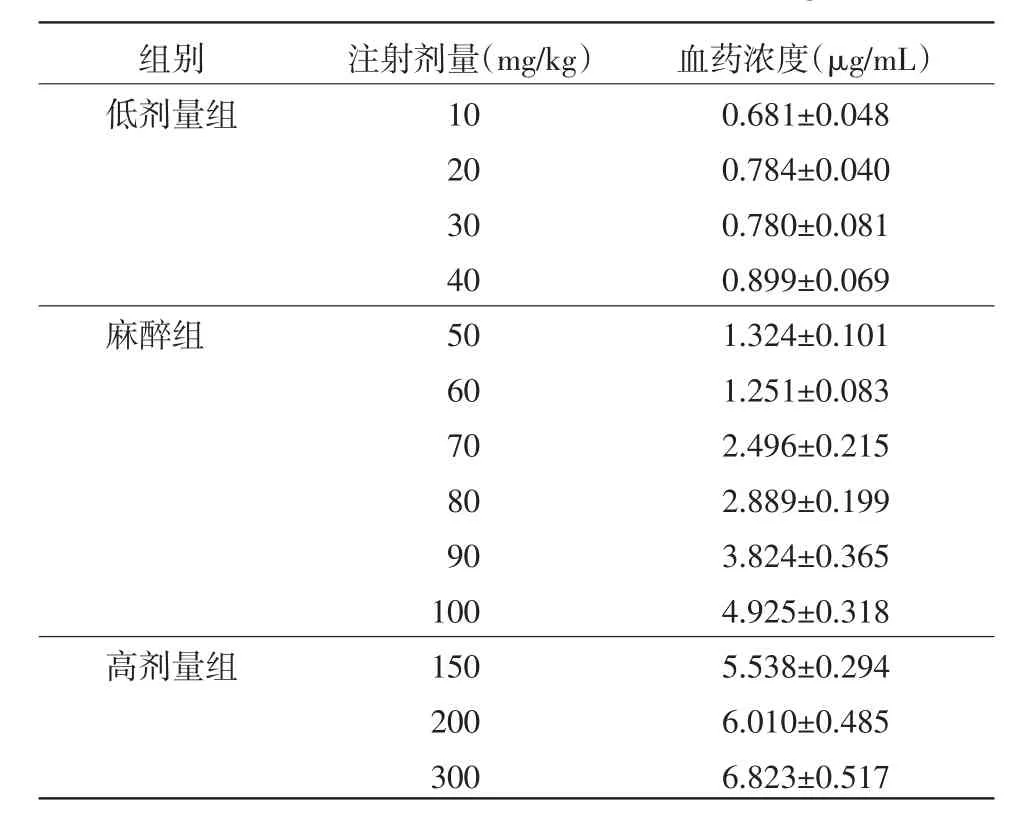
表1 不同注射剂量下大鼠血药浓度(μg/mL,n=3)
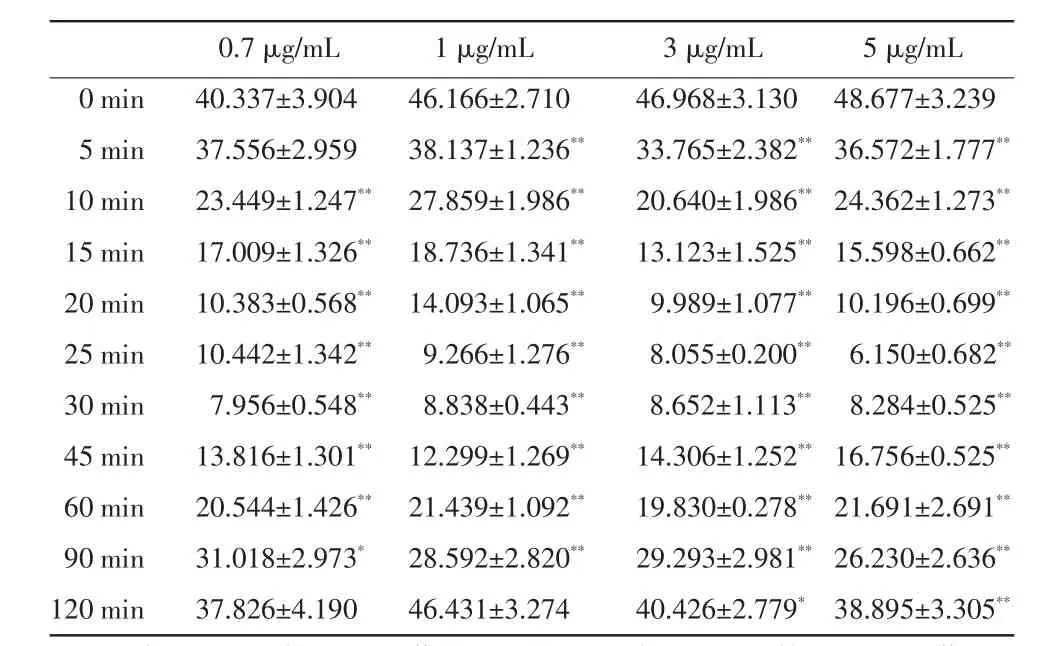
表2 不同浓度氯胺酮对Na+-K+-ATP酶活性的影响(U/mLprot,n=3)

表3 不同浓度氯胺酮对Ca2+-Mg2+-ATP酶活性的影响(U/mLprot,n=3)
3 讨论
Na+-K+-ATP酶在维持细胞膜通透性、膜内外离子成分及维持细胞正常代谢等方面起重要作用。它能够逆浓度梯度转运Na+、K+,运出3个Na+的同时运入2个K+,从而维持细胞的正常生理功能,并对突触之间的化学传递以及神经传导功能的兴奋性具有重要作用。徐恩等[1]通过研究推测Na+-K+-ATP酶可能参与了海马神经元的保护。费剑春等[2]报道,麻醉状态下大脑皮质内Na+-K+-ATP酶活性的降低与异氟醚、氯胺酮、氯丙嗪等药物的中枢抑制作用存在密切联系。细胞膜的Na+-K+-ATP酶的作用是降低细胞内Na+的水平,进而减少了细胞膜上Na+和Ca2+的交换,使神经细胞内Ca2+降低,从而维持钙稳态[3]。Na+-K+-ATP酶活性受到抑制,可导致动作电位峰电流期间产生的膜内高Na+和膜外高K+的状态不能及时消除,致使动作电位的后时相电位时程延长,细胞的相对不应期延长,兴奋性产生的阈值大幅度增高,引起受抑制区域所支配的各项生理功能暂时性地减退乃至丧失,从而产生镇静、镇痛、肌松和无记忆等麻醉效应[4-5]。
Ca2+-Mg2+-ATP酶是细胞膜上的Ca2+泵,可水解ATP,将胞内2个Ca2+运出的同时运进1个Mg2+,以维持细胞内较低浓度的Ca2+`,对维持细胞稳态具有重要作用。该酶的活力降低,可导致细胞内Ca2+浓度因泵受限而增高[6],造成细胞内Ca2+超载,这是细胞损伤的机制之一。近年来,许多实验表明静脉麻醉药、吸入麻醉药、镇静药和镇痛药均可以抑制Ca2+-Mg2+-ATP酶的活性[7-11]。Ca2+-Mg2+-ATP酶活性受到明显抑制后,神经细胞内多余的Ca2+不能及时转运至膜外,导致细胞内游离型Ca2+浓度升高,钙稳态失衡,从而影响神经细胞动作电位的产生与兴奋性传导,对中枢神经产生一定的抑制效应。另有研究证明,吸入麻醉药可能是通过与酶蛋白结合[12]、直接抑制酶的活性部位[13]或作用于脂质和蛋白质相互作用的表面[14]来影响酶的活性。
本实验结果中,不同浓度氯胺酮作用于神经细胞后均可对ATP酶跨膜信号转导系统产生明显的影响,与对照组相比差异显著,在25 min或30 min ATP酶活性会降到最低,随着时间的推移,酶活性会逐渐恢复,且氯胺酮的浓度越高对ATP酶的活性产生的影响越明显,恢复的速度也越慢。
4 结论
麻醉浓度的氯胺酮直接作用于神经细胞后对Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶产生明显的影响,且随氯胺酮浓度的升高,ATP酶活性降低明显,表明氯胺酮发挥麻醉作用可能与影响ATP酶的活性有关。
参考文献:
[1]徐恩,彭文宏,詹丽璇.低氧预处理通过钠钾ATP酶对成年大鼠短暂全脑缺血保护[C].中华医学会第十三次全国神经病学学术会议论文汇编,成都:2010.
[2]费剑春.Na+,K+-ATP酶及麻醉药对其影响[J].国外医学:麻醉学与复苏分册,2002,23(5):291-293.
[3] Barber D,Hunt J,Ehrich M . Inhibition of calcium-stimulated ATPase in the brain P2 synaptosomal fraction by organophosphos⁃phorus esters:relevance to delayed neuropathy[J].J Toxicol Envi⁃ton Health A,2001,63(2):101-113.
[4]陈君,王国林.离子通道理论与麻醉[J].天津医药,2003,31 (4):261-264.
[5] Shantii N D,Desai P V.The Study of Na+-K+-ATPase Activity of Rat Brain during Crush Syndrome[J] . NeurochemicalResearch,2007,32(11):1843-1848.
[6]赵亚丽,宋锦萍,杨玉华,等.不同强度微波辐射对小鼠脑组织钙、镁ATP酶活性的影响[J] .中华航空航天医学杂志,2000,11(2):101-104.
[7]刘悦张,瑾刘雅,任建军,等.七氟醚后处理对大鼠心肌缺血再灌注时Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性的影响[J].中国麻醉学杂志,2010,30(10):1179-1181.
[8]贾淑伟,李玉荣,杨玉玲,等.孤啡肽和吗啡对大鼠皮层体感区Ca2+-ATP酶活性的影响[J].哈尔滨医科大学学报,2004,38(2):154-156.
[9] M Volpi,R I . Sha'Afi,P . M . Epstein,et al . Local anesthetic s,mepacrine,and propranolol are antagonists of calmodulin[J] .Pro⁃ceedings of the National Academy of Sciences,1981,78(2):795-799.
[10]范宏刚,卢德章,胡魁,等.噻环乙胺对大鼠不同脑区突触体Ca2+-Mg2+-ATP酶活性的动态影响[J].中国兽医杂志,2010,46(10):89-91.
[11 Elena Garcia-Martin,Carlos Gutierrez-Merino. Local anesthetic s Inhibit the Ca2 +-Mg2 +-ATPase Activity of Rat Brain Synapto⁃somes[J].Journal of Neurochemistry,1986,47(3):668-671.
[12] Janicki P K,Horn J L,Singh G,et al . Increased anesthetic re⁃quirement for isoflurane halothane enflurane and desflurane in obese rats are associated with insulin-induced stimulation of plas⁃ma membrane Ca2+-ATPase[J].Life Sci,1996,59(17):269-275.
[13] Lopez M M,Kosk K D.Spectroscopic analysis of halothane bind⁃ing to plasma membrane Ca2+-ATPase[J].Biophys J,1998,74(2 Pt 1):974-980.
[14] Pflugmacher D,Sandermann H J.The lipid/protein interface as a target site for general anesthetics:a multiple-site kinetic analysis of synaptosomal Ca2 +-ATPase[J] . Biochem Biophys Acta,1998,1415(1):174-180.
Effect of Ketamineon theactivity of Atpasein Rats hippocampal Neurons
ZHOU Tong,CAO Xin-fang,CHEN Xi,CHEN Rui,LIU Mo,ZHANG Yu,WEI Cheng-wei,WU Yue,YU Dong-xu,LIU Zi-rui,JIANG Ren-li,LI Xin-ran,WANG Guan-ying,XIAO Jian-hua,GAO Li (College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
Abstract:In this study,we investigated the mechanisms of ketamine anesthesia on the central nervous system by examing the effect of different concentrations of ketamine on the activity of Atpase in Rats hippocampal Neurons.Fetal rat neurons from 16~18 days of pregnancy fetal rats were incubated at day 15 in culture with three different concentrations of ketamine,and adenosinetri⁃phosphatase assay kit was used to detect the activity of ATPase in the Fetal rat hippocampal.Our results showed that ketamine con⁃centration-dependently suppressed the activity of Na+-K+-ATPase and Ca2+-Mg2+-ATPase.These data indicate that central anes⁃thetic effect of ketamine may be related to the reduction in the activity of Na+-K+-ATPase and Ca2+-Mg2+-ATPase.
Key words:Ketamine;Anesthesia;Na+-K+-ATPase;Ca2+-Mg2+-ATPase
中图分类号:S857.144
文献标志码:A
文章编号:0529-6005(2016)05-0010-04
收稿日期:2015-04-16
基金项目:国家自然科学基金(31372491);黑龙江省自然科学基金(C201113);黑龙江省教育厅基金(12531016)
作者简介:周彤(1990-),女,硕士生,从事临床兽医学研究,E-mail:zhoutong1254@163.com
通讯作者:高利,E-mail:gaoli43450@163.com
Corresponding author:GAO Li
