甲状腺乳头状癌中BRAF基因突变与中央区淋巴结转移的关系及临床意义
2016-06-25张玉洁刘宝国赵治艳盛今东冯冬冬
张玉洁,刘宝国,赵治艳,盛今东,冯冬冬
(北京大学临床肿瘤学院,北京肿瘤医院暨北京市肿瘤防治研究所头颈外科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
·论著·
甲状腺乳头状癌中BRAF基因突变与中央区淋巴结转移的关系及临床意义
张玉洁,刘宝国△,赵治艳,盛今东,冯冬冬
(北京大学临床肿瘤学院,北京肿瘤医院暨北京市肿瘤防治研究所头颈外科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京100142)
[摘要]目的:阐明BRAF基因突变在甲状腺乳头状癌中央区淋巴结转移中的作用。方法:采集整理2012年至2014年间于北京大学肿瘤医院头颈外科行手术治疗的275例甲状腺乳头状癌患者,对其肿瘤组织进行BRAF基因检测并通过单因素、多因素Logistic回归模型探索中央区(Ⅵ区)淋巴结转移的危险因素。结果:275例患者中,女性224例(81.5%),男性51例(18.5%)。有57.8%(159/275)的患者发生中央区淋巴结转移,BRAF的突变率为53.8%(148/275),其中,超声下有无钙化(ORadjusted=1.47,95%CI:1.10~1.98,P=0.01)、肿瘤的长径(ORadjusted=1.48,95%CI:1.04~2.30,P=0.048)及患者的年龄(ORadjusted=1.48,95%CI:1.04~2.30,P=0.048)与淋巴结转移显著相关。分层分析后,BRAF突变在超声下边界尚清组(ORadjusted=3.19,95%CI:1.18~9.43,P=0.023)和超声下无钙化组(ORadjusted=4.84,95%CI:1.68~13.84,P=0.003)均与淋巴结转移正相关。结论:甲状腺乳头状癌患者具有一定比例的中央区淋巴结转移率,BRAF突变是甲状腺乳头状癌的特征性分子事件,钙化、低年龄组及肿瘤长径较长的患者更易发生中央区淋巴结转移。尽管超声下边界尚清或无钙化,但一旦合并BRAF突变则更易发生淋巴结转移,中央区淋巴结清扫术是有效的治疗方法。
[关键词]甲状腺癌,乳头状;淋巴转移;BRAF;突变;淋巴结切除术
甲状腺乳头状癌(papillarythyroidcarcinoma,PTC)是甲状腺癌中最多见的类型,占所有甲状腺癌的80%~90%,文献报道其中央区淋巴结转移率为20%~60%,目前尚无指导中央区淋巴结清扫的合理指标及预测模型[1-4]。已有文献报道,BRAF突变可能是PTC的驱动事件[5]。本文通过对275例PTC患者进行BRAF突变检测,对其临床资料进行单因素、多因素分析,探讨影响淋巴结转移的危险因素,为PTC中央区淋巴结清扫术的实施提供分子诊断依据。
1资料与方法
1.1研究对象
收集2012年至2014年间在北京大学肿瘤医院头颈外科诊断为PTC并行标准中央区(Ⅵ区)淋巴结清扫术的患者,排除因组织过小无法冰冻、合并其他重大传染病以及临床资料不全的患者,最终共有275例患者纳入本研究,记录患者年龄、性别、单/双侧发病、肿瘤长径长度、超声判读下的结节回声性质(强回声、等回声或低回声)、肿瘤边界、是否有钙化、癌灶是否多发,以及是否有Ⅵ区淋巴结转移、腺外侵犯、颈部广泛转移,同时记录手术方式共12项临床和病理参数(表1)。
1.2主要试剂
应用DNA提取试剂盒(QIAampBlood&TissueKit,QIAGEN,Germany)提取DNA。BRAF突变检测的正向引物序列为CCTAAACTCTTCATAATGCTTGC,反向引物序列为AACTCAGCAGCATCTCAGGG。采用qPCR探针引物混合体系(KapaBiosystemsWilmington,DE,USA)。探针、去离子水(ddH2O)、尿嘧啶-N-糖基化酶(uracil-N-glycosylase,UNG)、脱氧尿苷三磷酸(deoxyuridinetriphosphate,dUTP)均来自于北京泛生子生物科技有限公司。
1.3标本收集和处理
入组患者接受手术治疗。手术方式为甲状腺单侧叶及峡部切除并Ⅵ区淋巴结清扫,如有广泛颈部淋巴结转移,则进行颈部淋巴结清扫术,具体情况依据穿刺等诊断判断。术后切除的组织均进行病理检查,根据《美国癌症委员会(AmericanJointCommitteeonCancer,AJCC)肿瘤分期手册(第7版)》进行TNM分期,标本经10%(体积分数)甲醛溶液固定及石蜡包埋,苏木素-伊红染色后切片,由2位高级职称的病理专家确诊[6]。将切除的癌组织和癌旁组织立即置于液氮中,1~2h后在-80 ℃低温保存。
1.4BRAF突变的检测
提取癌组织和癌旁组织的DNA后,对BRAF基因第15号外显子进行实时荧光定量PCR测序,判断有无BRAF 突变,具体操作如下:避光混匀配置BRAF反应体系, 取待测样本DNA和标准品依次加入已分装好的反应体系PCR板中,扩增24个循环,每孔同时搜集FAM荧光和ROX参比荧光信号。样本突变信号(FAM通道)有典型的S型扩增曲线升起,则判定该样本BRAF突变阳性;样本突变信号(FAM通道)无典型的S型曲线升起或者Ct≥23时,则判定该样本BRAF突变阴性。在PCR反应体系中加入荧光基团,利用荧光信号积累实时检测整个PCR过程。
1.5统计方法
采用SPSS20.0进行统计分析,从12项甲状腺癌患者的临床病理参数中筛选出和中央区淋巴结转移相关的因素,首先使用单因素的二元Logistic回归分析,然后将单因素分析中有统计学意义的变量进一步行多因素分析,并通过分层分析去除混杂因素,最后得出与中央区淋巴结转移独立相关的危险因素。所有检验均为双侧检验,P<0.05为差异有统计学意义。
2结果
2.1PTC的临床病理学特征及BRAF突变率
275例PTC患者中,男 51例(18.5%)、女224 例(81.5%),平均患病年龄(43±11)岁,均接受淋巴结清扫术,其中接受患侧甲状腺和峡部切除并中央区淋巴结清扫术的患者有264例(96%)(表1)。
2.2PTC患者淋巴结转移相关因素的单因素和多因素分析
单因素Logistic回归分析显示,钙化、肿瘤长径及年龄是淋巴结转移的危险因素(表2)。进一步多因素Logistics回归分析表明,钙化(ORadjusted=1.47,95%CI:1.10~1.98,P=0.01)、肿瘤长径(ORadjusted=1.48, 95%CI: 1.04~2.30,P=0.048)与淋巴结转移正相关,年龄(ORadjusted=0.32,95%CI:0.20~0.52,P=0.001)和淋巴结转移负相关。
2.3PTC患者淋巴结转移相关因素的分层分析
回归分析并未发现BRAF突变与淋巴结转移的统计学关联,我们推论BRAF突变可能与其他变量存在交互作用。通过对BRAF突变与其他自变量进行双变量交互作用分析发现,钙化和肿瘤边界均与BRAF突变存在交互作用,因此,本研究分别在超声下是否钙化和肿瘤边界不同患者组内进行进一步的Logistic回归分析,以探讨BRAF与淋巴结转移是否存在统计学关联。

表1 275例甲状腺乳头状癌患者的术前临床病理参数

表2 275例甲状腺乳头状癌患者淋巴结转移的单因素
以超声下是否有钙化为分层标准进行单因素分析,结果见表3。进一步多因素分析显示,钙化组年龄(ORadjusted=0.40,95%CI:0.23~0.71,P=0.002)、肿瘤长径(ORadjusted=1.73,95%CI:1.01~2.98,P=0.048)及单/双侧发病(ORadjusted=3.55,95%CI:1.26~9.99,P=0.016)与淋巴结转移具有统计学关联,而BRAF突变与淋巴结转移的统计学关联并不显著。无钙化组中高年龄(ORadjusted=0.20,95%CI:0.08~0.54,P=0.001)是淋巴结转移的保护性因素,BRAF突变(ORadjusted=4.84,95%CI:1.68~13.84,P=0.003)显著增加淋巴结转移。
以边界尚清与否为分层标准进行单因素分析,结果见表4。进一步多因素分析显示,边界尚清组BRAF突变(ORadjusted=3.19,95%CI:1.18~9.43,P=0.023)、年龄(ORadjusted=0.33,95%CI:0.13~0.79,P=0.012)及钙化与否(ORadjusted=1.74,95%CI:1.02~2.98,P=0.044)与淋巴结转移具有统计学关联。在边界不清组中,多因素分析发现低年龄(ORadjusted=0.27,95%CI:0.15~0.49,P<0.001)、双侧发病(ORadjusted=12.22,95%CI:1.25~119.44,P=0.031)及肿瘤长径过长(ORadjusted=2.09,95%CI:1.20~3.66,P=0.01)显著增加淋巴结转移,而BRAF突变与淋巴结转移统计学关联不显著。
3讨论
BRAF突变最早于2003年在甲状腺癌中检测到,约36%~69%的PTC中可以测得BRAF突变,且99%以上为第5号外显子突变导致第600位氨基酸由缬氨酸变成谷氨酸[7-8]。BRAF通过MAPK通路调控细胞的生长信号[9-10],MAPK激酶通路的突变约占肿瘤全部突变的30%[11]。通常,BRAF突变在老年人中更常见,且与腺外侵犯、病理学高分期以及不良的预后(包括复发及治疗失败)相关[1-4]。有研究表明,BRAF突变通过抑制了钠-碘转运体(sodium-iodidesymporter,NIS)从而导致消融治疗的失败[12]。

表3 甲状腺乳头状癌患者淋巴结转移以是否钙化分层的单因素分析
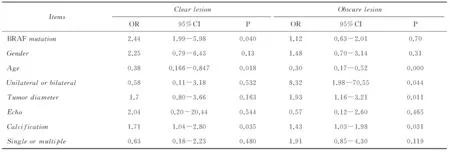
表4 甲状腺乳头状癌患者淋巴结转移以边界尚清与否分层的单因素分析
BRAF突变与淋巴结转移的相关性存在争议,Namba等[13]报道BRAF突变可能和PTC的远处转移相关,Nikiforova等[14]报道BRAF突变可能会导致PTC分化更差,Kim等[15]则发现在BRAF突变的前提下,PTC更易发生淋巴结的转移,但还有一些研究认为BRAF突变与淋巴结的转移没有关系[16-17],目前尚缺乏明确的机制研究以证实这些假说。Xing等[3]的研究表明PTC合并BRAF突变会导致淋巴结更易转移以及复发等不良事件。不同样本大小以及研究中各种混杂因素可能是导致上述结果不一致的原因。我们通过对72例结节性甲状腺肿、24例甲状腺滤泡性腺瘤和10例桥本甲状腺炎进行突变检测,均未发现BRAF突变(结果待发表),因此认为BRAF突变不存在于甲状腺良性病变中,其在PTC中的突变率为53.8%,说明BRAF突变可以作为预测PTC的分子指标,即如果有BRAF突变,就可以考虑其为恶性并进行甲状腺患侧的切除。在传统的超声诊断基础上,通过筛选出边界、钙化、肿瘤长径、回声强度等临床变量并结合BRAF突变的检测结果,我们应用单因素、多因素分析以及分层分析,找到了可能与PTC中央区淋巴结转移密切相关的因素。
尽管《美国国立综合癌症网络(TheNationalComprehensiveCancerNetwork,NCCN)肿瘤学临床实践指南》建议,无明确淋巴结转移指征的PTC可以不行常规淋巴结清扫[18],但一部分PTC患者仍可能会进展到Ⅱ、Ⅲ区淋巴结转移等不良事件,目前尚缺乏对这些事件的预测模型[5]。淋巴结转移常最早发生在中央区,因此,若能及时清扫中央区,往往不会发生淋巴结的进展转移[19]。目前关于是否对PTC患者进行中央区淋巴结清扫仍存在争议:如果进行常规清扫,有伤及喉返神经、甲状旁腺乃至颈总动脉的风险,但如果不进行常规清扫,一些肿瘤会易于复发、转移甚至进展到低分化型甲状腺癌[20-22],尤其是对于低危型PTC,淋巴结清扫术的标准选择更为重要[23]。本研究纳入的病例53.8%存在BRAF突变,57.8%存在颈部淋巴结转移,提示两者间可能有潜在的交互作用。进一步分析发现,在无钙化组,BRAF突变增加淋巴结转移风险,而在钙化组则没有发现这一关联,说明在无钙化组进行BRAF突变检测时,如果存在BRAF突变,则淋巴结转移的可能性较高;在边界尚清组里,BRAF突变与淋巴结转移存在正相关,而在边界不清组并没有发现BRAF突变对淋巴结转移的影响。
本研究除了发现BRAF突变对PTC的淋巴结转移有一定影响外,还发现年龄较小(≤30岁)、有钙化灶、长径较长(>3cm)的患者更易发生淋巴结转移,提示对于高危患者可以进行预防性中央区淋巴结清扫术,而对于低危患者(年龄>50岁、无钙化、<1cm的微小癌)则可以考虑相对保守的治疗。对于高度怀疑PTC者可以进行细针穿刺活检,并对活检组织进行BRAF突变的检测,以判断肿瘤的良恶性,同时结合超声的诊断标准,决定是否进行患侧预防性的中央区淋巴结清扫术。一般认为超声下无钙化或者边界尚清者往往不易发生相关淋巴结转移,但当其合并BRAF突变时,可能较易发生淋巴结转移,其分子机制尚不清楚。
本研究尚有一些不足:首先,回顾性研究本身的局限性使偏倚无法避免;其次,本研究所选择的患者在时间跨度上未超过3年,缺乏预后的数据;最后,本研究借鉴国内外相关文献并结合现有资料仅选取了12项与PTC可能相关的临床参数进行分析,可能有与中央区淋巴结转移相关的其他因素未被列出,将在后续的研究中做进一步的分析。
参考文献
[1]Cantwell-DorrisER,O’learyJJ,SheilsOM.BRAFV600E:implicationsforcarcinogenesisandmoleculartherapy[J].MolCancerTher, 2011, 10(3): 385-394.
[2]PalonaI,NambaH,MitsutakeN,etal.BRAFV600EpromotesinvasivenessofthyroidcancercellsthroughnuclearfactorkappaBactivation[J].Endocrinology, 2006, 147(12): 5699-5707.
[3]XingM,WestraWH,TufanoRP,etal.BRAFmutationpredictsapoorerclinicalprognosisforpapillarythyroidcancer[J].JClinEndocrinolMetab, 2005, 90(12): 6373-6379.
[4]CaroniaLM,PhayJE,ShahMH.RoleofBRAFinthyroidoncogenesis[J].ClinCancerRes, 2011, 17(24): 7511-7517.
[5]McleodDS,SawkaAM,CooperDS.Controversiesinprimarytreatmentoflow-riskpapillarythyroidcancer[J].Lancet, 2013, 381(9871): 1046-1057.
[6]TuttleRM,BallDW,ByrdD,etal.Thyroidcarcinoma[J].JNatlComprCancNetw, 2010, 8(11): 1228-1274.
[7]XingM.BRAFmutationinthyroidcancer[J].EndocrRelatCancer, 2005, 12(2): 245-262.
[8]CohenY,XingM,MamboE,etal.BRAFmutationinpapillarythyroidcarcinoma[J].JNatlCancerInst, 2003, 95(8): 625-627.
[9]HilgerRA,ScheulenME,StrumbergD.TheRas-Raf-MEK-ERKpathwayinthetreatmentofcancer[J].Onkologie, 2002, 25(6): 511-518.
[10]HagemannC,RappUR.Isotype-specificfunctionsofRafkinases[J].ExpCellRes, 1999, 253(1): 34-46.
[11]DaviesH,BignellGR,CoxC,etal.MutationsoftheBRAFgeneinhumancancer[J].Nature, 2002, 417(6892): 949-954.
[12]DuranteC,PuxedduE,FerrettiE,etal.BRAFmutationsinpapillarythyroidcarcinomasinhibitgenesinvolvediniodinemetabolism[J].JClinEndocrinolMetab, 2007, 92(7): 2840-2843.
[13]NambaH,NakashimaM,HayashiT,etal.ClinicalimplicationofhotspotBRAFmutation,V599E,inpapillarythyroidcancers[J].JClinEndocrinolMetab, 2003, 88(9): 4393-4397.
[14]NikiforovaMN,StringerJR,BloughR,etal.Proximityofchromosomallocithatparticipateinradiation-inducedrearrangementsinhumancells[J].Science, 2000, 290(5489): 138-141.
[15]KimKH,KangDW,KimSH,etal.MutationsoftheBRAFgeneinpapillarythyroidcarcinomainaKoreanpopulation[J].YonseiMedJ, 2004, 45(5): 818-821.
[16]PuxedduE,MorettiS,EliseiR,etal.BRAF(V599E)mutationistheleadinggeneticeventinadultsporadicpapillarythyroidcarcinomas[J].JClinEndocrinolMetab, 2004, 89(5): 2414-2420.
[17]FugazzolaL,MannavolaD,CirelloV,etal.BRAFmutationsinanItaliancohortofthyroidcancers[J].ClinEndocrinol, 2004, 61(2): 239-243.
[18]NationalComprehensiveCancerNetwork.NCCNclinicalpracticeguidelinesinoncology.Thyroidcarcinoma.Version2.2013 [S].
[19]SunW,LanX,ZhangH,etal.RiskfactorsforcentrallymphnodemetastasisinCN0papillarythyroidcarcinoma:asystematicreviewandmeta-analysis[J].PLoSOne, 2015, 10(10):e0139021.
[20]ChisholmEJ,KulinskayaE,TolleyNS.Systematicreviewandmeta-analysisoftheadverseeffectsofthyroidectomycombinedwithcentralneckdissectionascomparedwiththyroidectomyalone[J].Laryngoscope, 2009, 119(6): 1135-1139.
[21]濮亚斌, 李刚强. 甲状腺乳头状癌中BRAFV600E基因异常的临床意义 [J]. 实用癌症杂志, 2013, 28(3): 246-247.
[22]朱精强. 分化型甲状腺癌颈淋巴结清扫的相关问题 [J]. 中国普外基础与临床杂志, 2012, 19(8): 809-812.
[23]YooEY,ShinJH,KoEY,etal.ContributionoftheBRAFmutationanalysisincalcifiedthyroidnodules[J].AJRAmJRoentgenol, 2012, 198(4): 891-895.
(2015-12-09 收稿)
(本文编辑:赵波)
Relationship and clinical significance between mutated BRAF with prophylactic central-neck nodal dissection in papillary thyroid carcinoma
ZHANG Yu-jie, LIU Bao-guo△, ZHAO Zhi-yan, SHENG Jin-dong, FENG Dong-dong
[DepartmentofHead&Neck,KeyLaboratoryofCarcinogenesisandTranslationalResearch(MinistryofEducation),PekingUniversityCancerHospital&Institute,Beijing100142,China]
ABSTRACTObjective: To evaluate the molecular diagnosis marker of papillary thyroid carcinoma (PTC), the relationship between lymphatic metastasis of central neck compartment PTC, and the operation indication of prophylactic central neck dissection. Methods: We conducted a retrospective study, including 275 PTC patients and detected their BRAF mutation rates during 2012 and 2014 and explored the risk factors of the central node lymphatic metastasis by Logistic regression model. Results: Of the 275 PTC patients, 224 (81.5%) were female and 51 (18.5%) were male. BRAF mutational rates were 53.8% (148/275) and lymphatic metastasis 57.8% (159/275). Multivariate analysis showed calcification (ORadjusted=1.47, 95%CI: 1.10-1.98, P=0.01), tumor diameter (ORadjusted=1.48, 95%CI: 1.04-2.30, P=0.048) and age (ORadjusted=1.48, 95%CI: 1.04-2.30, P=0.048) were associa-ted with lymphatic metastasis. In stratified analysis, BRAF mutation (ORadjusted=3.19, 95%CI: 1.18-9.43, P=0.023) in clear boarder group and BRAF mutation (ORadjusted=4.84, 95%CI: 1.68-13.84, P=0.003) in calcification group were more likely to have lymphatic metastases. Conclusion: Central neck metastasis takes up a high ratio in papillary thyroid cancer patients, BRAF mutation in papillary thyroid carcinoma is a characteristic molecular event. Furthermore, patients with calcification under ultrasound detection, lower age group and longer tumor diameter are more susceptible to suffer central neck metastasis. Especially for stratified analysis, non-calcified BRAF mutation or BRAF mutation with clear border under ultrasound detection are more susceptible to suffer central neck metastasis, and radical prophylactic central neck dissection should be carried on for these patients.
KEY WORDSThyroid cancer, papillary; Lymphatic metastasis; BRAF; Mutation; Lymph node excision
基金项目:国家高技术研究发展计划(863计划,2012AA02A210)资助Supported by the National High Technology Research and Development Program of China (863 Program, 2012AA02A202)
Corresponding author△’s e-mail, lbg29@163.com
[中图分类号]R736.1
[文献标志码]A
[文章编号]1671-167X(2016)03-0502-05
doi:10.3969/j.issn.1671-167X.2016.03.022
网络出版时间:2016-5-278:25:35网络出版地址:http://www.cnki.net/kcms/detail/11.4691.R.20160527.0825.006.html
