利用色谱法快速检测分析啤酒腐败菌的新方法
2016-06-24韩晓雪黄雨濛
杨 超, 韩晓雪, 黄雨濛, 孙 珍
大连工业大学 生物工程学院,辽宁大连 116034
利用色谱法快速检测分析啤酒腐败菌的新方法
杨超,韩晓雪,黄雨濛,孙珍*
大连工业大学 生物工程学院,辽宁大连 116034
摘要:啤酒在生产过程中很容易染菌,而传统的用于啤酒腐败菌检测的方法耗时长,不能满足实际需求。由于腐败菌污染的啤酒通过色谱检测,相应组分(生物胺、有机酸和风味物质)都会有特征峰的产生,所以本研究通过建立无腐败菌污染的啤酒中各组分的标准色谱图,再使啤酒强制染菌,对其组分进行色谱分析,并与标准色谱图进行比较,从而找出各组分对应的特征峰。未来,此方法可用于实际生产线上快速检测啤酒是否发生微生物污染。
关键词:啤酒腐败菌; 生物胺; 有机酸; 风味物质; 色谱分析
啤酒是世界上最古老的酒精饮料,距今已有数千年的历史[1]。啤酒是以麦芽、水为主要原料,通过添加一定量啤酒花苦味质,经啤酒酵母纯种发酵酿造而成的一种低酒精度、味道独特的酒精饮料[2]。我国啤酒的质量近年来有了大幅度的提高,特别是在啤酒的外观、色泽、泡沫等指标上,均在世界啤酒中名列前茅[3]。
对啤酒口感影响较大的一般包括生物胺,有机酸和风味物质等。有些物质在一定含量范围内赋予啤酒特殊口味,若含量过高便会给啤酒带来不良的口感[4~7]。由于啤酒是我们日常生活中的常用饮品,它的口感显得尤为重要。但是,啤酒的生产工艺较复杂,在生产过程中很容易染菌,若啤酒在生产过程中被污染,且没被检测出来进而投放到市场中,就会造成无法估量的经济损失,因此,啤酒生产过程中腐败菌的检测显得尤为重要,快速准确地检测既能避免腐败菌污染造成的经济损失,又能很好的控制啤酒品质。传统的腐败菌检测方法是通过从啤酒中分离出腐败菌在平板上厌氧培养,然后通过观察和一些生理生化试验来判定这些腐败菌。它的主要缺点是实验周期长,操作繁琐,检测结果不够准确[8]。目前快速检测腐败菌方法的研究主要有三种:(1)免疫学的检测方法,适用于啤酒酿造过程的各个阶段的样品,其简便、专一、易于自动化的特点预示其有较好的发展前景,但需要降低单克隆抗体的制备成本[9]。(2)ATP生物发光检测方法,它适用于成品啤酒的微生物在线检测,最大优点是简单、快速和高灵敏度[10]。(3)分子生物学检测方法PCR及其衍生技术,它们的优点是灵敏度高,专一性强,适于应急生产中出现的突发事件,但缺点是检测费用高[11]。现有的快速检测腐败菌方法都存在一定的不足,限制其工业化应用,需要进一步改进。
在啤酒酿造过程中,产生适量的色胺、尸胺、组胺能够改善啤酒的风味,使其口味更清爽,但是高含量的色胺、尸胺、组胺意味着酿造过程中可能受到过微生物的污染[12]。有机酸是啤酒主要的呈味物质,采用紫外检测器,可测定啤酒中的苹果酸、乳酸、柠檬酸等有机酸[13]。生物胺和有机酸都能用液相色谱进行分析。挥发性的风味物质主要包括醇类、酯类、醛类、酮类等,影响啤酒的感官品尝,气相色谱静态顶空技术是分析啤酒中挥发性组分最简便的方法,只需将啤酒样品密封在顶空瓶内,在一定的温度下平衡后便可进样,主要的醇、醛、酯都能够被分析出来[14]。由于腐败菌污染的啤酒通过色谱检测,相应组分都会有特征峰的产生,所以本研究通过建立无腐败菌污染啤酒中各组分(生物胺、有机酸和风味物质)的标准色谱图,再使啤酒强制染菌,对其组分进行色谱分析,并与标准色谱图进行比较,找出各组分对应的特征峰。此方法可进一步用于实际生产线上快速检测啤酒是否发生微生物污染。
1材料与方法
1.1实验仪器与试剂
气相色谱仪为Agilent-6850(顶空进样器为Agilent-7697A),液相色谱仪为Agilent-1260,高速冷冻离心机为HITACHI CR21 G Ⅲ,分光光度计为722s,氮吹仪为MD-200。所用啤酒为黑狮新动购自超市,乙醚、丙酮、三氯甲烷、正丁醇和谷氨酸钠,均购自科密欧,丹磺酰氯购自上海源叶公司。
1.2实验方法
1.2.1培养基配制
MRS:麦芽糖 5 g/L,蛋白胨 10 g/L,酵母浸膏 4 g/L,牛肉膏 8 g/L,葡萄糖 20 g/L,磷酸氢二钾 2 g/L,吐温-80 1%(v/v),乙酸钠 5 g/L,柠檬酸三铵 2 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·4H2O 0.05 g/L,pH自然。
1.2.2腐败菌的培养
实验室新分离出了五株腐败菌:短乳杆菌(49#),芽孢杆菌(3012#),植物乳杆菌(JSB),类布氏乳杆菌(白),葡萄球菌(球)。分别将其接入MRS培养基中培养,并在其菌浓为1.0的时候接入啤酒中,置于30℃恒温培养箱,将一组没接菌的MRS同时接入啤酒作为空白对照。培养7天后取出,进行色谱分析,检测其生物胺,有机酸和风味物质的含量。
1.2.3样品前处理
1.2.3.1生物胺
1.2.3.1.1样品中生物胺的提取
将啤酒超声除气,离心(10 000 r/min,10 min,4 ℃),取10 mL啤酒于烧杯中用适量的NaCl使样品饱和,用0.1 mol/L NaOH调pH到12。取上述啤酒5 mL于15 mL离心管中,加5 mL正丁醇/三氯甲烷(体积比1∶1),涡旋振荡5 min,离心(3 600 r/min,10 min,4 ℃),取上层有机相于新的试管中。重复两次,合并萃取液。加入0.1 mL 1mol/L HCl,震荡均匀。氮吹仪水浴吹干(40 ℃),加1 mL 0.1 mol/L HCl,将残留物溶解,待衍生。
1.2.3.1.2生物胺的衍生
取待衍生样品0.5 mL于10 mL具塞试管中,加入1.5 mL饱和NaHCO3及1 mL丹磺酰氯(10 mg丹磺酰氯溶于1 mL丙酮,终浓度为10 mg/mL),于60 ℃培养箱放置30 min(中间取出震荡混匀2次),后加入0.1 mL谷氨酸钠(50 mg谷氨酸钠溶于1mL饱和NaHCO3,终浓度为50 mg/mL),60 ℃保温15 min(中间取出震荡混匀1次)。取出后加入1 mL超纯水,混匀。氮吹仪水浴吹至3 mL(40 ℃),加入同体积乙醚,震荡2 min,取上层萃取液于新的15 mL离心管中。重复一次,合并萃取液,氮吹仪水浴吹干(40 ℃)。用1 mL甲醇将残留物溶解,过0.22 μm有机滤膜后,置于4 ℃冰箱保存,以便进行液相色谱分析。
1.2.3.2有机酸
将啤酒超声除气,离心(10 000 r/min,10 min,4 ℃),取1mL啤酒样品,过0.22 μm水系滤膜,置于4 ℃冰箱保存,以便进行液相色谱分析。
1.2.3.3风味物质
用10 mL移液管准确移取10 mL啤酒样品,加入3.0g NaCl,充分溶解于气相顶空瓶内,置于4 ℃冰箱保存,以便进行气相色谱分析。
1.2.3.4标准样品的配制
1.2.3.4.1生物胺
准确称取7种生物胺标准品(色胺,腐胺,尸胺,组胺,酪胺,亚精胺,精胺),分别用 0.1 mol/L HCl溶液各定容至 10 mL,浓度为 100 mg/L,混匀后置于棕色试剂瓶中,4 ℃避光保存。准确量取生物胺溶液 0.05 mL、0.1 mL、0.25 mL、0.5 mL、1 mL、1.5 mL、2.5 mL和5.0 mL,用 0.1 mol/L HCl定容至 10 mL 棕色容量瓶中,混匀,使浓度分别为0.5 mg/L、1.0 mg/L、2.5 mg/L、5.0 mg/L、10.0 mg/L、15.0 mg/L、25.0 mg/L、50.0 mg/L,按照上述生物胺衍生的方法去处理,进行液相色谱分析。
1.2.3.4.2有机酸
准确称取6种有机酸(乙醛酸,酒石酸,乳酸,α-酮戊二酸,柠檬酸,苹果酸),分别用超纯水定容10 mL,浓度为1 g/L。逐级稀释8个梯度,按照上述有机酸样品前处理的方法,进行液相色谱分析。
1.2.3.4.3风味物质
准确称取10种风味物质(乙醛,甲酸乙酯,乙酸乙酯,正丙醇,异丁醇,乙酸异戊酯,正丁醇,异戊醇,2,3-丁二醇,2-苯乙醇),分别用30%的乙醇溶液定容至100 mL,浓度为50 mg/L。逐级稀释8个梯度,按照上述风味物质样品前处理的方法,进行气相色谱分析。
1.2.4色谱分析条件
1.2.4.1生物胺
色谱柱为Agilent C18(150 mm×4.6 mm×5 μm),紫外检测波长为254 nm,进样量50 μL,柱温为35 ℃,流速1.0 mL/min,流动相A为超纯水,B为甲醇,梯度洗脱程序如表1,实验重复三次。
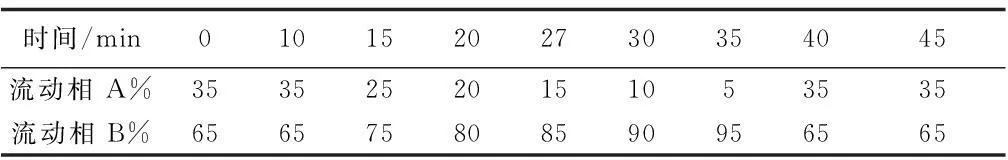
表1 生物胺HPLC梯度洗脱程序
1.2.4.2有机酸
色谱柱为依利特C18(250 mm×4.6 mm×5 μm),紫外检测波长为215 nm,进样量10 μL,柱温为30 ℃,流速0.8 mL/min,流动相A为乙腈,B为0.01 mol/L (NH4)2HPO4-H3PO4缓冲溶液(pH 2.5),梯度洗脱程序如表2,实验重复三次。
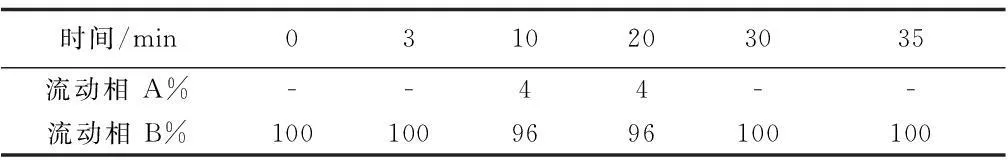
表2 有机酸HPLC梯度洗脱程序
1.2.4.3风味物质
色谱柱为Agilent DB-FFAP(30 m×0.250 mm×0.25 μm),进样口温度为250 ℃,检测器温度为250 ℃,分流比为2∶1,升温程序:初始温度50 ℃保持2 min,以5 ℃/min升至190 ℃,在190 ℃保持1 min,以10 ℃/min升至230 ℃,在230 ℃保持10 min。采取静态顶空进样的方式,实验重复三次。
2结果与讨论
2.1标准曲线的绘制
把各种标准品(生物胺,有机酸,风味物质)按照上述浓度配制,进行色谱分析,得到一系列标准品色谱图。提取出各种物质各个浓度的峰面积,与各自对应浓度进行线性拟合,得出各自线性方程,R2均大于0.99。具体线性方程如表3,表4,表5所示。
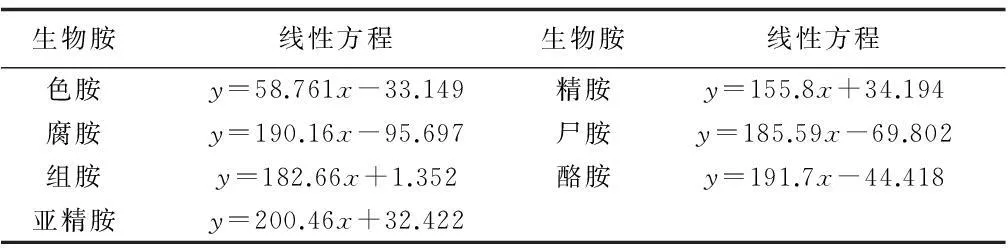
表3 生物胺标准品对应的标准曲线(浓度为mg/L)
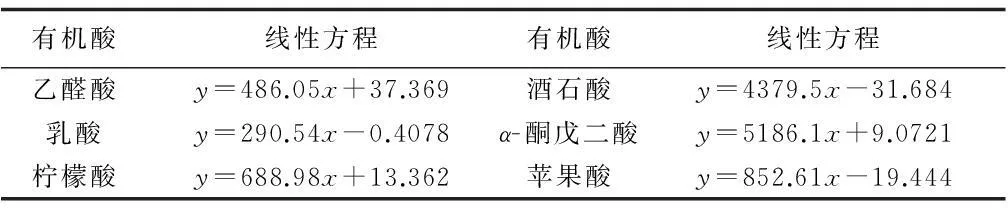
表4 有机酸标准品对应的标准曲线(浓度为g/L)
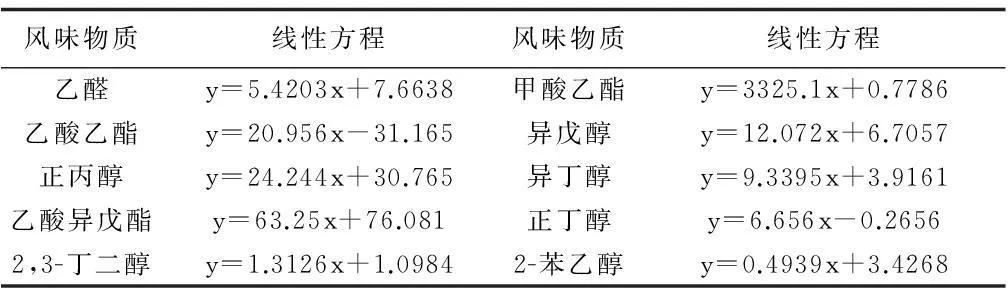
表5 风味物质标准品对应的标准曲线
2.2显著性差异分析
本实验通过使用SPSS17.0对强制染菌啤酒的色谱图与标准色谱图进行显著性差异分析(P<0.05)。所有色谱图中得到的峰面积都根据各自的标准曲线折算成对应的浓度。在这里,标准色谱图就是对空白对照的各组分进行色谱分析得到的相应色谱图。为了避免仪器波动产生的系统误差的影响,三次重复实验间各组分浓度的相对标准偏差必须小于10%。而在实际生产中,考虑到不同人员操作可能存在的系统误差,以及酿造工艺的不稳定性可能会造成假阳性,标准色谱图需进行三次平行酿造,且彼此间相对标准偏差小于10%才可以确定。
接入不同腐败菌的啤酒各组分浓度与标准色谱图各组分浓度间的显著性差异结果如表6,表7,表8所示。
如表6所示,接入五株不同腐败菌的啤酒生物胺组成与标准色谱图均有不同程度的显著性差异,在能检测出的七种生物胺中,49#除了精胺没有检测出,其它六种均与标准色谱图有显著性差异;3012#的腐胺,组胺和亚精胺与标准色谱图有显著性差异;白与标准色谱图的显著性差异较少,仅有腐胺和组胺;球的色胺,尸胺,组胺和精胺与标准色谱图有显著性差异;JSB除了酪胺与标准色谱图没有显著性差异,其它六种均有。
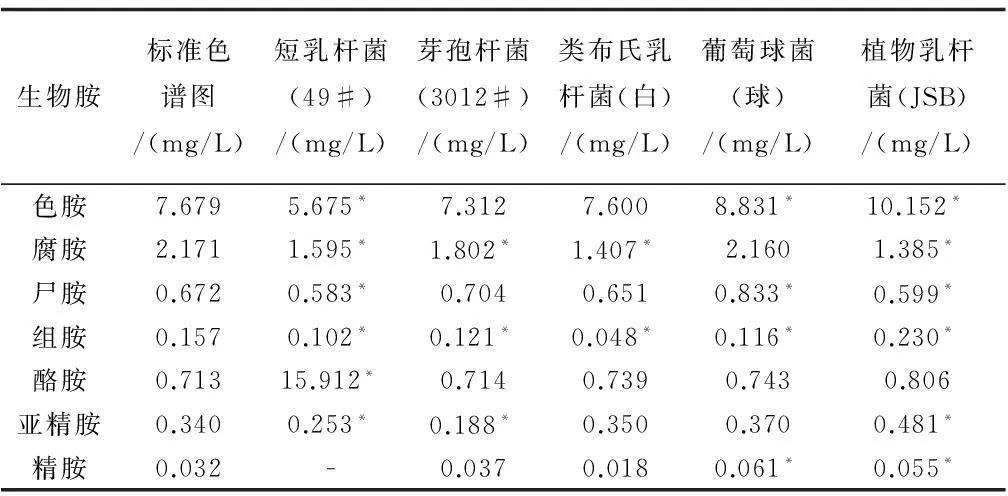
表6 生物胺的显著性分析
注:*表示P<0.05
如表7所示,五株菌的有机酸组成均有不同程度的显著性差异,在能检测出的六种有机酸中,49#的乳酸,α-酮戊二酸,柠檬酸和苹果酸与标准色谱图有显著性差异;3012#与标准色谱图均没有显著性差异;白的乳酸,柠檬酸和苹果酸与标准色谱图有显著性差异;球和JSB与标准色谱图的显著性差异较少,球的乳酸和苹果酸,JSB的柠檬酸和苹果酸有显著性差异。
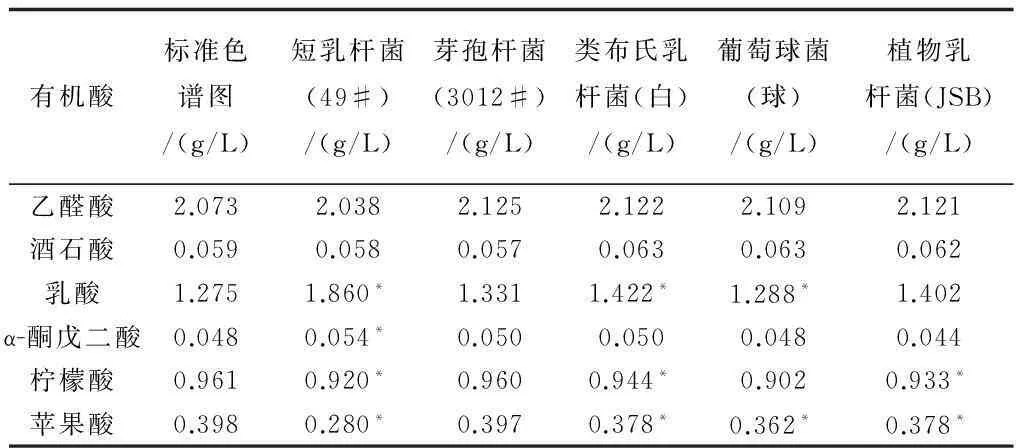
表7 有机酸的显著性分析
注:*表示P<0.05
如表8所示,五株菌的风味物质组成均有不同程度的显著性差异,在能检测出的十种风味物质中,49#的乙醛没有检测出,甲酸乙酯和乙酸异戊酯与标准色谱图有显著性差异;3012#的乙醛和乙酸乙酯与标准色谱图有显著性差异;白与标准色谱图均没有显著性差异;球仅有乙醛与标准色谱图有显著性差异;JSB与标准色谱图的显著性差异较多,它的乙醛,甲酸乙酯,异丁醇和正丁醇均与标准色谱图的有显著性差异。
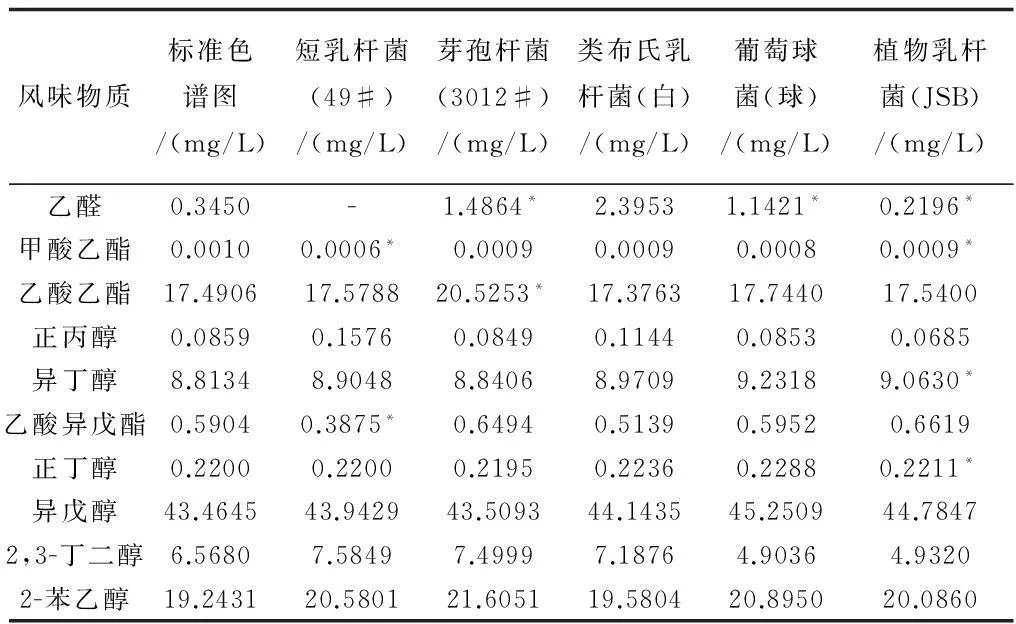
表8 样品中风味物质的显著性分析
注:*表示P<0.05
2.3各种腐败菌种间显著性差异分析
本实验还对五株菌两两比较进行种间显著性差异的分析,从而分析比较不同类别腐败菌对啤酒各组分影响的差异。分析表明49#,白和JSB的显著性差异较少,3012#和球分别与其他四株菌的显著性差异较为明显。实验结果与各株菌所属类别基本相符,因为49#,白和JSB同属于乳杆菌,而3012#和球分别属于芽孢杆菌和葡萄球菌。总的来说,分类比较接近的腐败菌对啤酒各组分的影响比较接近,分类相距较远则影响差异大。
3结论
本研究发展了一种利用色谱法快速检测分析啤酒腐败菌的新方法,通过建立无腐败菌污染啤酒中生物胺,有机酸和风味物质的标准色谱图,再对不同腐败菌污染的啤酒组分进行色谱分析,并与相应标准色谱图进行显著性差异比较,从而找出各组分对应的特征峰。此方法可用于实际生产线上快速检测啤酒是否发生微生物污染,如需进一步确认,也可结合PCR及其它分子生物检测技术进行确认分析。
参考文献
[1]林先军. 啤酒腐败菌[J]. 啤酒科技, 2005, (7): 64-67.
[2]Benitez JL, Forster A, Keukeleire D,etal. Hops and hop products, manual of good practice[M]. Nurnberg, Germany: EBC and Verlag Hans Carl, 1997.
[3]顾国贤, 李崎. 中国啤酒工业的进展[J]. 工业微生物, 1999, 29(3): 44-49.
[4]Bushnell SE,Guinard JX,Bamforth CW. Bamforth. Effects of Sulfur Dioxide and Polyvinylpolypyrrolidone on the Flavor Stability of Beer as Measured by Sensory and Chemical Analysis[J]. J Am Soc Brew Chem, 2003, 61(3):133-141.
[5]Siebert KJ. Evaluation of a model of organic acid flavor thresholds in beer[J]. J Am Soc Brew Chem, 2000, 58(3):94-96.
[6]王志坚. 影响酒花α-酸异构化的因素[J]. 酿酒科技, 2003, 118(4): 75-76.
[7]Uchida M, Ono M. Technological approach to improve beer flavor stability: Adjustments of wort aeration in modern fermentation systems using the electron spinresonance method[J]. J Am Soc Brew Chem, 2000, 58(1): 8-13.
[8]张小军等. PCR技术检测啤酒中腐败菌的研究进展[J]. 酿酒科技, 2006, 11(0): 94-96.
[9]Gracias KS, Mckillip JL. A review of conventional detection and enumeration methods for pathogenic bacteria in food[J]. Can J Microbiol., 2004, 50(11): 883-890.
[10]Nakaita Y, Takahashi T, Tsuchiya Y,etal. A strategy for decetion of sll beer-spoilage bacteria[J]. J Am Soc Brew Chem, 2002, 60(2): 63-67.
[11]Ing D, Brandl A. Demonstration of PCR based methods in brewery quality control [R]. EBC Brewing Science Group-Microbial Contaminants Subgroup, Hartwall Brewery, Lahti, Finland, 2004.
[12]吴延东. 生物胺对啤酒质量的影响[J]. 酿酒科技, 2004, 1(0): 59-60.
[13]杨毅等. 反相高效液相色谱法(RP-HPLC)测定啤酒中有机酸[J]. 食品与发酵工业, 2003, 29(18): 6-12.
[14]胡国栋, 张晓磊. 顶空固相微萃取-气相色谱/质谱分析啤酒微量香味组分的研究[J]. 食品与发酵工业, 2004, 30(2): 1-5.
A new method for rapid detection of beer spoilage bacteria by using chromatography
YANG Chao, HAN Xiao-xue, HUANG Yu-meng, SUN Zhen
School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China
AbstractBeer can be easily contaminated in the production process. The traditional method for detecting beer spoilage bacteria is time-consuming, which cannot meet the actual demand. The contaminated beer with spoilage bacteria can be identified with characteristic peaks by chromatographic analysis of each component (biogenic amine, organic acid and flavor compound). In this research, the standard chromatogram of each component of no spoiled beer was established and the components of the forced spoiled beer by chromatographic method were analyzed. Then the characteristic peaks of both the non-spoiled beer and the spoiled beer could be rapidly identified by comparing the chromatograms. This method could be further applied in the beer production line for rapidly detection whether the spoil bacteria happened.
Key wordsbeer spoilage bacteria; biogenic amine; organic acid; flavor compound; chromatography
doi:10.3969/j.issn.1001-6678.2016.02.007
基金项目:国家自然科学基金(31401681),辽宁省教育厅科学研究一般项目(L2015049)。
作者简介:杨超(1991~),男,研究生。 *通讯作者: 孙珍(1986~),女,博士,讲师。电话:0411-86318692,E-mail: sunzhen@dlpu.edu.cn。
