角蛋白单体获得及诱导S.maltophilia DHHJ产角蛋白酶研究
2016-06-24曹张军
朱 茜, 王 娟, 曹张军
东华大学化学化工与生物工程学院,上海 201620
角蛋白单体获得及诱导S.maltophiliaDHHJ产角蛋白酶研究
朱茜,王娟,曹张军*
东华大学化学化工与生物工程学院,上海 201620
摘要:可降解羽毛微生物能以羽毛粉为唯一营养源生长,而羽毛粉是一种大颗粒的不溶性底物,不能直接进入细胞内作为营养源同时作为一级信使来诱导酶基因表达。本文通过化学还原法水解羽毛得到可溶性羽毛角蛋白溶液,利用电泳和质谱验证其分子量约10 kD,为角蛋白单体。分别以该可溶性羽毛角蛋白及角蛋白单体酶解片段为诱导源,在无诱导源、羽毛粉为对照的情况下,测定72 h内嗜麦芽窄食单胞菌(S. maltophilia)DHHJ产生的角蛋白酶的酶活。在无诱导源时,角蛋白酶基因表现本底表达(0.5 U/mL);培养基中添加羽毛粉及角蛋白单体时,角蛋白酶表达量高,分别可达15 U/mL和20 U/mL。并且角蛋白单体酶解片段诱导酶表达较低(2.3 U/mL)。该结果初步表明,水溶性角蛋白单体作为信号源与细菌细胞接触或进入细胞内,控制角蛋白酶基因表达。该结果为细菌降解角蛋白分子机制研究奠定基础。
关键词:角蛋白酶; 嗜麦芽窄食单胞菌; 可溶性角蛋白; 生化机制
禽类所产羽毛除了少部分作为纺织原料等外,大部分作为废弃物直接丢弃处理(全球每年废弃量在几百万吨以上[1]),其实羽毛可降解为可溶性蛋白及氨基酸,广泛应用于动物饲料[2]、医药、食品、日化等行业,对于资源、能源匮乏的当今世界具有十分重要的科学意义和应用价值[3]。产角蛋白酶的微生物构成的生物炼制较之传统水解法具有诸如反应条件温和、产物回收率高、环境友好、可节省能源等众多优点。不仅使固体废弃物得到有效利用,保护了人类赖以生存的生态环境,还可将其生物降解为多肽及氨基酸等高附加值产品,更加符合循环经济的理念和建立节约型社会的战略要求。
生物炼制效率及投入产出比是制约该工艺应用的重要瓶颈,而掌握降解机理并利用该机理提高降解效率是解决这一问题的关键。表达角蛋白酶的微生物可在不溶于水的羽毛为唯一生长源生长,但是羽毛成分是以什么方式怎么样进入微生物细胞并诱导酶基因表达,这一步骤机制还不清楚。
本实验室前期从长期堆积腐烂羽毛的土壤中分离到一株高效降解羽毛细菌L1,经鉴定该菌株为嗜麦芽窄食单胞菌(Stenotrophomonasmaltophilia)[4],并且对其产生的角蛋白酶的理化性质进行了一定的研究[5]。该菌降解羽毛是胞外及胞内酶协同作用结果,另一方面,角蛋白酶同时具有蛋白酶与二硫键还原酶活性[6]。角蛋白是一种大颗粒的不溶性底物,而不溶性底物不可能直接将表达信号传递到胞内,因此角蛋白应该以一种成份进入细胞并起动降解机制,因此我们通过还原法将羽毛角蛋白降解成单一分子量的可溶性角蛋白溶液,进行有关其机制的进一步研究/尝试寻找其诱导产酶的片段。
1实验材料与方法
1.1实验材料
1.1.1供试细菌
S.maltophiliaDHHJ由本课题组提供。
1.1.2羽毛粉(鸡毛粉)
市场收集白色生鸡毛,洗净后于80 ℃烘干48 h,剪刀剪碎后,用粉碎机粉碎,备用。
1.1.3溶解液
溶解液一:尿素2 mol/L 焦亚硫酸钠0.125 mol/L SDS 0.05 mol/L
溶解液二:尿素4 mol/L 焦亚硫酸钠0.25 mol/L SDS 0.1 mol/L
溶解液三:尿素8 mol/L 焦亚硫酸钠0.5 mol/L SDS 0.2 mol/L
1.1.4培养基
增殖培养基:牛肉膏0.5 g,蛋白胨1 g,NaCl 0.5 g,pH 7.5,蒸馏水100 mL。
无氮5×M9盐溶液:Na2HPO4·7H2O 6.4 g,KH2PO41.5 g,NaCl 0.25 g,pH 7.5,蒸馏水100 mL。
无氮M9培养基:将20 mL 5×M9盐溶液稀释至98 mL灭菌后,加入已灭菌的1 mol/L MgSO40.2 mL,1 mol/L CaCl20.01 mL,20%葡萄糖 2 mL。
羽毛粉发酵培养基:无氮M9溶液100 mL,羽毛粉2 g。
角蛋白单体发酵培养基:用角蛋白单体溶液(473.57 μg/mL)将5×M9盐溶液稀释至100 mL,0.22 μm滤器过滤除菌。
角蛋白酶解片段发酵培养基:用角蛋白单体酶解片段溶液将5×M9盐溶液稀释至100 mL,0.22 μm滤器过滤除菌。
1.2实验方法
1.2.1还原法制备水溶性角蛋白溶液
水溶性角蛋白的制备参考Vasconcelos[7](2008)的方法:分别称取洗净烘干的羽毛粉1 g,加入10 mL 1.1.3所述三种溶解液,混合均匀后,分别置于60 ℃,70 ℃和80 ℃的恒温水浴锅中反应30 min,用8层纱布过滤,除去羽毛粉残渣后,离心(10 000 r/min)15 min,取上清液在蒸馏水中透析3天,每天换4次水,离心后上清为浅黄色透明羽毛角蛋白溶液。
1.2.2水溶性角蛋白分子量测定
SDS-聚丙烯酰胺凝胶电泳:采用15%(质量分数)的自制分离胶、5%(质量分数)的自制浓缩胶和不连续的缓冲液系统,加样品15 μL,电压由100 V换至150 V,采用考马斯亮蓝染色法进行测定。样品中羽毛角蛋白带的分子量由它的相对迁移率与标准分子量相比较确定。
质谱:4 800plusMALDI TOF/TOFTM质谱仪,检测可溶性角蛋白分子量。
1.2.3蛋白质含量的测定
采用考马斯亮蓝法测蛋白质含量。
1.2.4角蛋白单体酶解片段的制备
用1 mol/L的NaOH将自制水溶性角蛋白溶液的pH调至7.5,用0.22 μm滤器将100 mL自制水溶性角蛋白过滤除菌,在其中加入过滤除菌的20 mg/mL的蛋白酶K 10 mL,于58 ℃反应16 h。再将其置于95 ℃水浴10 min,使蛋白酶K失活。通过电泳检验是酶切完全,再用酶切后的水溶性角蛋白制备角蛋白酶解片段发酵培养基。
1.2.5角蛋白酶活力的测定
从羽毛粉蛋白胨平板上挑取单菌落接种于含5 mL增殖培养基的试管中,于160 r/min、35 ℃培养12 h~16 h后,再以1%接种量,加入50 mL增殖培养基中,于160 r/min、35℃培养至OD600=0.8,为种子液。将种子液以10%的接种量,分别接种于50 mL增殖培养基、50 mL羽毛粉发酵培养基、50 mL水溶性角蛋白发酵培养基及50 mL角蛋白酶解片段发酵培养基中,于160 r/min、35 ℃培养,分别在一定时间取3 mL发酵液,于 10 000 r/min 4 ℃离心10 min,取上清即为粗酶液。将粗酶液密封置于4 ℃冰箱待测酶活。
角蛋白酶活力的测定方法参考Gradisar[8],并在此基础上稍作修改。取1 mL粗酶液加入2 mL 0.05 mol/L Tris-HCl缓冲液,然后加入10 mg羽毛粉,在40 ℃恒温水浴锅中反应,定时取出用力震荡,1 h后加入2 mL 10% TCA终止反应。4 ℃离心15 min,取上清液于280 nm波长处测定其吸光度(A280)。反应前即加TCA的处理用作对照。
酶活定义:A280值每增加0.1为1 unit(U)。重复3次取平均值。
2结果与讨论
2.1角蛋白单体的制备
2.1.1SDS-PAGE
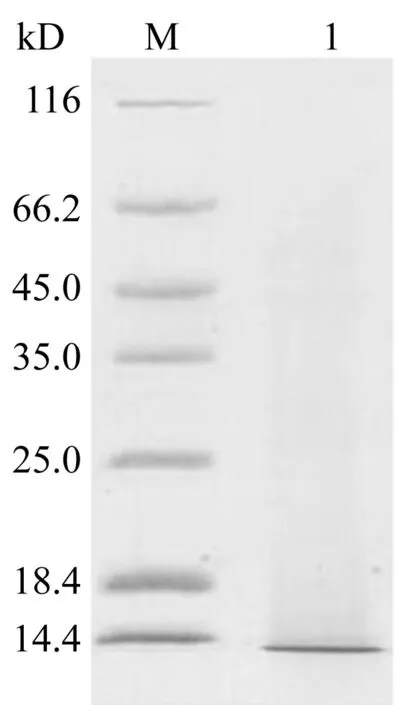
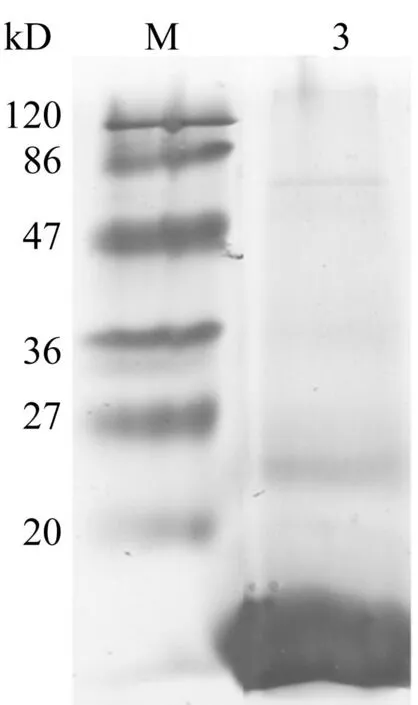
通过不同浓度的溶解液以及反应时的不同温度降解羽毛,均在10 kD左右有一条带存在,该条带与角蛋白单体分子量一致[9]。溶解液一在60 ℃降解30 min时,仅有10 kD左右的条带的存在(图1a),即得到单一分子量的角蛋白。而在其它条件下均会得到其他杂带(图1b,1c)。这可能是由于角蛋白中存在大量的二硫键,容易发生交联,而交联的条件可能和角蛋白的浓度及温度等有关。为了得到分子量单一的角蛋白,选用60 ℃,溶解液一的条件制备角蛋白单体(WP)。
Ayutthaya等[10]同样通过还原法降解羽毛得到的蛋白电泳条带显示,存在大量的10 kD左右的角蛋白以及少量18 kD及30 kD左右分子量的角蛋白。其反应条件为65 ℃,5 h,且溶解液配比与本文不同。溶解液的配比、反应时间及反应温度的差别,会影响羽毛降解中得到的角蛋白的分子量的分布。笔者在实验中还发现不同来源羽毛在用还原法生产水溶性角蛋白时,分子量分布也会有少量差异。Vasconcelos等[7]利用溶解液三在100 ℃降解羊毛角蛋白30 min,得到更多分子量更大的蛋白,只有少量小于14.4 kD。Lusiana等[11]降解人类头发及指甲得到的蛋白条带集中于42 kD及52 kD附近。羊毛、头发、指甲主要为α-角蛋白,羽毛为β-角蛋白,这可能是由于α-角蛋白及β-角蛋白形成高级结构时聚合程度或形成键不同引起的差异。
(a)

(b)
(c)
2.1.2质谱(MALDI TOF-MS)
参考不同溶解条件SDS-PAGE结果,对羽毛于溶解液一中,60 ℃反应30 min,溶解所得水溶性产物透析进一步质谱分析确定其纯度及准确分子量,结果显示其有一个峰(图2),分子量为10 104 Da,其他分子量区段都没有峰值。这与之前SDS-PAGE(图1a)结果一致。与Molly等[12],Presland等[13],Greenwold等[14]之前报道得到的角蛋白单体分子量基本相同,可以确定,通过该工艺能够稳定得到分子量均一的角蛋白单体。
利用考马斯亮蓝法测定WP的浓度,测得水解透析后WP的浓度为473.57 μg/mL(标准曲线参数y=0.0367x+0.0822,其R2=0.9996)。
2.2不同底物诱导S.maltophiliaDHHJ产酶的影响
分别以含羽毛粉、角蛋白单体、酶解角蛋白单体的M9及牛肉膏蛋白胨培养基培养S.maltophiliaDHHJ菌株产角蛋白酶(图3a, 3b)。从图3a可以看出,在12 h内,含角蛋白单体、羽毛粉诱导源及不含诱导源培养基均检测到低水平酶活表达,基因表达水平差异不明显。从图3b可以看出,羽毛粉及角蛋白单体为诱导源诱导S.maltophiliaDHHJ菌株产酶, 36 h后编码角蛋白基因开始大量表达,酶活上升,48 h后酶活最高(分别为15 U/mL和20 U/mL)。而酶解角蛋白单体、牛肉膏蛋白胨中只检测到微量的酶活,为角蛋白酶的本底表达。Malviya等[15]研究表明直到半数以上的角蛋白被分解,才能检测到显著的角蛋白酶活力,与本文结果一致,这一现象产生的原因有待于进一步研究。
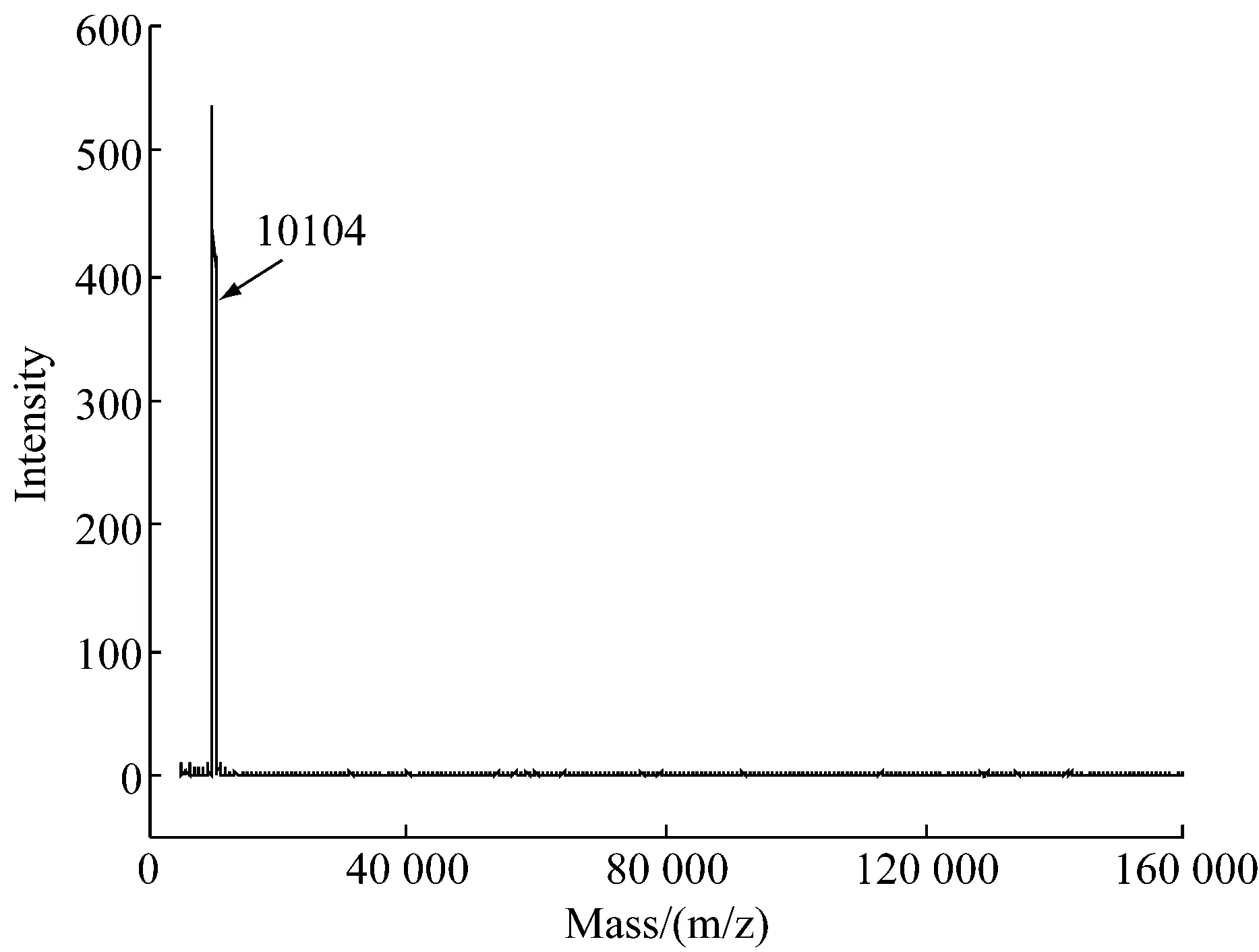
图2 水解角蛋白质谱图
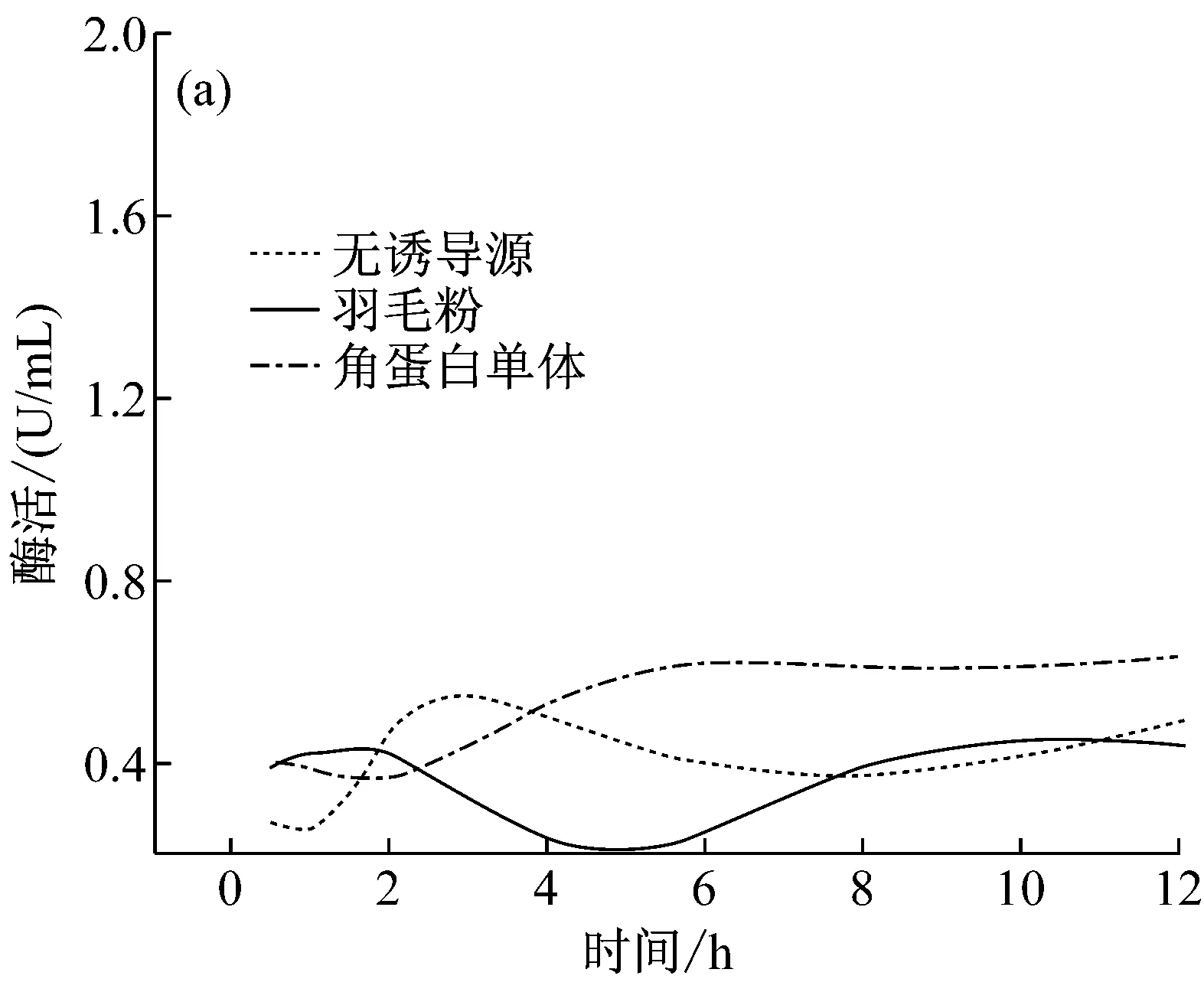
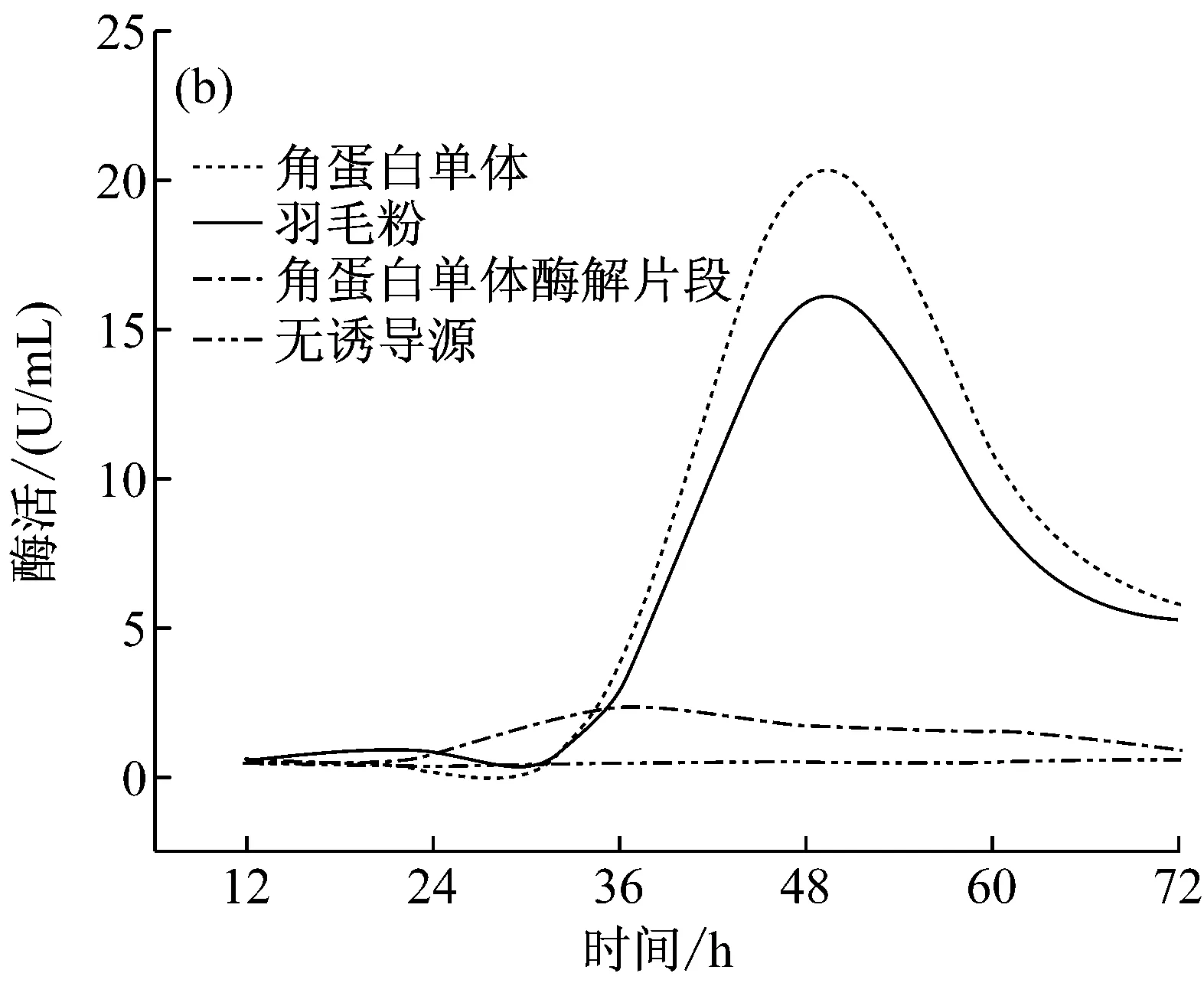
图3 不同底物诱导S. maltophilia DHHJ
从图3b中可看出,角蛋白酶切片段虽然也能诱导S.maltophiliaDHHJ产酶,但是其酶活值大大降低,低于2.5 U/mL,是角蛋白单体诱导该菌产酶的1/8左右。且酶活峰值出现在36 h。这很可能是由于蛋白酶K的酶切位点具有广泛性,酶切后的角蛋白成为了易于利用的肽段,大部分的肽段失去了其对S.maltophiliaDHHJ结合位点结合并将信号转导入细胞,启动细菌细胞角蛋白降解相关基因的作用。但是仍然有少部分肽段能与S.maltophiliaDHHJ结合位点结合,诱导角蛋白酶基因的表达。另一方面,也有可能虽然酶切后在SDS-PAGE中虽没有看到角蛋白单体存在,但仍可能会有痕量角蛋白单体存在,诱导酶基因表达。
3结论
本文利用化学还原法制备了水溶性羽毛角蛋白溶液,并且通过SDS-PAGE和质谱验证其为角蛋白单体,分子量为10 kD左右;分别测定且比较了无诱导源、羽毛粉为诱导源、自制的水溶性羽毛角蛋白为诱导源和水溶性角蛋白酶切片段为诱导源这四种情况下的S.maltophiliaDHHJ产生的角蛋白酶的酶活。发现水溶性羽毛角蛋白与羽毛粉一样可以诱导S.maltophiliaDHHJ产生角蛋白酶,而更小分子的角蛋白单体酶解片段虽能诱导产酶,但酶活很低。由此我们可以水溶性羽毛角蛋白这种单一可控性高的诱导源来替代羽毛粉,进行之后的S.maltophiliaDHHJ降解角蛋白机制的相关研究。
参考文献
[1]Brandelli A. Bacterial keratinases: Useful enzymes for bioprocessing agroindustrial wastes and beyond. Food Bioprocess Technol, 2008, 1(2): 105-116.
[2]Latshaw JD, Musharaf N, Retrum R. Processing of feather meal to maximize its nutritional value for poultry. Anim Feed Sci Technol, 1994, 47(3-4): 179-188.
[3]李江, 姚斌, 范云六. 微生物角蛋白酶的分子生物学研究进展. 工业微生物, 2006, 36(3): 37-42.
[4]Cao ZJ, Zhang Q, Wei DK,etal. Characterization of a novel Stenotrophomonas isolate with high keratinase activity and purification of the enzyme. J Ind Microbiol Biotechnol, 2009, 36(2): 181-188.
[5]龚润, 蒋晶君, 曹张军等.StenotrophomonasmaltophiliaDHHJ角蛋白酶特性及酶促动力学研究. 工业微生物, 2013, 43(3): 67-71.
[6]张启, 王晶, 曹张军等. 嗜麦芽窄食单胞菌 (Stenotrophomonasmaltophilia) DHHJ 分解角蛋白的生化机制初探. 河北农业大学学报, 2008, 31(2): 70-73.
[7]Vasconcelos A, Freddi G, Cavaco-Paulo A. Biodegradable materials based on silk fibroin and keratin. Biomacromolecules, 2008, 9(4): 1299-1305.
[8]Gradisar H, Kern S, Friedrich J. Keratinase of doratomyces microsporus. Appl Microbiol Biotechnol, 2000, 53(2): 196-200.
[9]Presland RB, Gregg K, Molloy PL,etal. Avian keratin genes .1. A molecular analysis of the structure and expression of a group of feather keratin genes. J Mol Biol, 1989, 209(4): 549-559.
[10]Ayutthaya SI, Tanpichai S, Wootthikanokkhan J. Keratin extracted from chicken feather waste: Extraction, preparation, and structural characterization of the keratin and keratin/biopolymer films and electrospuns. J Polym Environ, 2015, 23(4): 506-516.
[11]Lusiana, Reichl S, Mueller-Goymann CC. Keratin film made of human hair as a nail plate model for studying drug permeation. Eur J Pharm Biopharm, 2011, 78(3): 432-440.
[12]Molloy PL, Powell BC, Gregg K,etal. Organisation of feather keratin genes in the chick genome. Nucleic Acids Res, 1982, 10(19): 6007-6021.
[13]Presland RB, Whitbread LA, Rogers GE. Avian keratin genes. II. chromosomal arrangement and close linkage of three gene families. J Mol Biol, 1989, 209(4): 561-576.
[14]Greenwold MJ, Sawyer RH. Genomic organization and molecular phylogenies of the beta (β) keratin multigene family in the chicken (Gallusgallus) and zebra finch(Taeniopygiaguttata): Implications for feather evolution. BMC Evol Biol, 2010, 10(1): 1-15.
[15]Malviya HK, Rajak RC, Hasija SK. Synthesis and regulation of extracellular keratinase in three fungi isolated from the grounds of a gelatin factory, Jabalpur, India. Mycopathologia, 1992, 120(1): 1-4.
A preliminary study on biochemical mechanism of degrading keratins byStenotrophomonasmaltophiliaDHHJ
ZHU Qian, WANG Juan, CAO Zhang-jun
College of Chemistry, Chemical Engineering and Biotechnology,Donghua University,Shanghai 201620
AbstractFeather powder is large and insoluble. It cannot express signals directly to intracellular. The soluble feather keratin was obtained by chemical reduction method to hydrolyze feather, which was monomer with a molecular weight of 10 kD verified by SDS-PAGE and mass spectrometry. The enzyme activities of keratinase produced by Stenotrophomonas maltophilia DHHJ within 72 h were measured under the following 4 conditions: no induced source, soluble feather keratin as induced source, keratin digested fragment as induced source and feather powder as induced source. The enzyme activities of keratinase was quite low without induced source. When the induced source existed, Stenotrophomonas maltophilia DHHJ was induced to produce keratinase. Both the feather powder and soluble feather keratin could induce higher enzyme activities of keratinase(15 U/mL and 20 U/mL, respectively). While the keratin enzymatic fragment could only induce lower enzyme activities of keratinase (2.3 U/mL).
Key wordskeratinase; Stenotrophomonas maltophilia; soluble feather keratin; biochemical mechanism
doi:10.3969/j.issn.1001-6678.2016.02.003
基金项目:国家自然科学基金资助课题(31570106)。
作者简介:朱茜(1989~),女,硕士研究生。Tel.:13524117651;E-mail: zhuqian_1125@163.com。
*通讯作者:曹张军,男,副教授,zhjcao@dhu.edu.cn。
