氨基酸前体对棘白霉素B发酵合成的影响
2016-06-24王耀耀付美红朱研研郝惠云王亚莉张雪霞
王耀耀, 付美红, 朱研研, 郝惠云, 王亚莉, 张雪霞
微生物药物国家工程研究中心,河北省工业微生物代谢工程技术研究中心,华北制药集团新药研究开发有限责任公司,石家庄 050015
氨基酸前体对棘白霉素B发酵合成的影响
王耀耀,付美红,朱研研,郝惠云,王亚莉,张雪霞*
微生物药物国家工程研究中心,河北省工业微生物代谢工程技术研究中心,华北制药集团新药研究开发有限责任公司,石家庄 050015
摘要:以构巢曲霉(Aspergillus nidulans)发酵生产酯肽类化合物棘白霉素B,研究棘白霉素B己肽环结构的前体性氨基酸对产物的代谢影响,显示出脯氨酸、鸟氨酸、苏氨酸在发酵48 h补入,对发酵代谢有促进作用。利用响应面统计学方法进行前体及有机氮源配方优化,得出优化配方:脯氨酸4.55 mg/mL,鸟氨酸1.85 mg/mL,苏氨酸0.97 mg/mL,棉籽粉2.62%,摇瓶发酵水平达到3 270 μg/mL,较原水平提高30.2%。新工艺在50 L罐上放大,发酵水平进一步提高至3 520 μg/mL,显示出良好的工业应用前景。
关键词:棘白霉素B; 酯肽; 响应面统计学方法; 氨基酸前体
阿尼芬净是继卡波芬净、米卡芬净之后开发出的又一个重要的芬净类抗生素药物。其合成途径包括利用曲霉发酵获取先导性化合物——棘白霉素B(ECB),再经脱酰基化去除脂肪酸侧链,最后进行侧链化学结构改造而成药[1]。芬净类对近年来日益严重的侵袭性念珠菌感染有显著疗效[2,3]。药物作用机理为通过非特异性抑制真菌细胞壁的β-(1, 3)-D-葡聚糖合成酶,导致葡聚糖合成受阻,破坏真菌细胞壁完整性,最终导致真菌细胞溶解死亡[4]。阿尼芬净抗菌谱广,对多数念珠类如白色念珠菌、热带念珠菌以及烟曲菌和新型隐球菌等菌属均有抑菌或杀菌作用,特别对于唑类和两性霉素B耐药菌有显著抗菌活性,没有药物交叉反应。其药物安全性高,显著优于传统抗真菌药物两性霉素B[5,6]。
棘白霉素B是最早被发现的棘白霉素家族中第一个天然化合物[7],由曲霉菌发酵产生。棘白霉素B具有典型的棘白类家族的特殊己肽环结构,肽环的主要氨基酸组成为脯氨酸、酪氨酸、苏氨酸、亮氨酸和鸟氨酸,生物合成遵循非核糖体多肽合成途径(NRPS)[8]。作为新一代抗真菌药物,芬净类抗生素得到研究工作者们的广泛关注。研究范畴涉及化合物的化学多样性结构改造[9]、菌种选育[10]、生物合成[11]等众多领域。有关使用构巢曲霉进行ECB的发酵研究,邹树平等人[12]对菌种进行传统遗传育种改造,并针对发酵配方中的碳、氮、磷源进行配方优化;Hodges等人[13,14]对构巢曲霉发酵代谢副产物柄曲霉素进行基因敲除,从分子水平上对合成途径进行了揭示和讨论;Cockshott等人[15,16]报道了ECB发酵培养基优化后的最适工艺条件。针对ECB合成己肽环相关氨基酸对发酵代谢的研究尚无报道。
本文根据ECB生物合成途径, 研究了不同氨基酸前体结合有机氮源对构巢曲霉生长、代谢以及产物合成的影响。利用响应面方法的统计学研究特点[17],围绕中心点进行合理的分组设计,采用多元二次方程来拟合因素与响应值之间的函数关系,通过方差分析确定拟合曲线的显著性,在三维空间层面上分析氨基酸与天然有机氮源以及前体因素之间的交互影响,寻求响应值最高点。前体工艺优化使ECB发酵水平得到有效提升,为ECB的工业化放大生产提供了理论和数据基础。
1材料和方法
1.1材料
1.1.1菌种
棘白霉素B产生菌(Aspergillusnidulans)NCPC1246由本研究室保藏。
1.1.2主要试剂和培养基
棘白霉素B的对照品(按文献方法制备并标定[18],纯度98%);糊精(北京双旋双旋微生物培养基制品厂);马铃薯葡萄糖琼脂(北京双旋微生物培养基制品厂);硫酸铵、磷酸二氢钾、氯化钠等无机盐为化学纯试剂(天津瑞金特化学品有限公司);棉籽饼粉(中棉紫光生物科技有限公司);氨基酸(北京欣经科生物技术公司),甲醇(分析纯)。
斜面培养基(g/L):马铃薯葡萄糖琼脂62.5,琼脂5。母瓶培养基(g/L):葡萄糖20,硫酸铵10,棉籽饼粉15,磷酸二氢钾5,氯化钠5,七水硫酸镁2,七水硫酸亚铁1,消前pH 6.5。发酵培养基(g/L):糊精35.0,葡萄糖12.0,硫酸铵20.0,棉籽饼粉30.0,磷酸二氢钾8.0,氯化钠5.0,七水硫酸镁2.0,七水硫酸亚铁1.0,碳酸钙2.0,消前pH 6.2。培养基均在121 ℃下灭菌30 min。
1.1.3仪器
调速摇瓶机INNOVO5000;岛津液相色谱仪LC-2010AHT;珠江牌生化培养箱(广东医疗器械厂)LRH-150II;超低温冰箱Thermo ULT1786;离心机(上海安亭科学仪器厂)LXJ-IIB;光学显微镜Olympus CX41。
1.2方法
1.2.1培养条件
斜面培养条件:25 ℃, 相对湿度30%~60%, 培养7 d~8 d。
摇瓶培养条件:培养成熟的斜面挖块接种于装40 mL种子培养基的母瓶中,25 ℃、220 r/min培养48 h,然后以3%接种量接入装40 mL发酵液的发酵瓶中,25 ℃、220 r/min发酵6 d。
50 L罐培养条件:采用二级发酵方式,斜面接种于装有200 mL种子培养基的1 L三角瓶中,25 ℃、220 r/min培养48 h后,以0.5%接种量接入种子罐,25 ℃培养,周期40 h~48 h,发酵接种量3%,发酵罐接种后发酵液体积为30 L,培养周期120 h~144 h,转速300 r/min~400 r/min。
1.2.2发酵液效价检测
取发酵液1 mL,用10倍95%乙醇浸提,超声0.5 h,3 000 r/min离心15 min,上清液经膜过滤进行HPLC分析。HPLC色谱分析条件参考文献[18]。
1.2.3前体考察试验
(1) 前体氨基酸单因素考察试验
以原发酵培养基为对照,分别在发酵培养基中添加终浓度为1 mg/mL的脯氨酸、酪氨酸、苏氨酸、亮氨酸和鸟氨酸,进行发酵培养,于144 h放瓶,检测菌体量及ECB发酵水平。
(2) 前体添加时间及剂量范围的考察
选取对发酵代谢有促进作用的氨基酸前体,分别在消前、24 h、48 h、72 h、96 h、120 h添加氨基酸前体,检测放瓶时ECB产物发酵水平。按照主要有机氮源棉籽饼粉高低两个剂量分组,高剂量组棉籽粉3.0%,低剂量组棉籽饼粉2.0%,氨基酸剂量考察范围为0.1 mg/mL~10 mg/mL,分组取值0.1 mg/mL、0.2 mg/mL、0.5 mg/mL、0.8 mg/mL、1 mg/mL、2 mg/mL、5 mg/mL、8 mg/mL和10 mg/mL,进行摇瓶发酵培养,检测放瓶时菌体量及ECB发酵水平。
(3) 前体氨基酸与有机氮源响应面统计方法分析
使用Design-expert7.0软件进行Box-Behnken响应面设计,以预试验确定的氨基酸及有机氮源取值范围为基础,设定因素值,每因素取三个水平,通过对试验数据进行分析以获取最优方案。
2结果与讨论
2.1前体氨基酸单因素影响
棘白霉素B为棘白霉素家族中具有环己肽环和脂肪酸侧链的天然酯肽类化合物,己肽环的主要氨基酸组成为4R,5R-二羟基-L-鸟氨酸、4R-羟基-L-脯氨酸、3S,4S-二羟基-L高酪氨酸、3S-羟基-4S-甲基-L-脯氨酸、两个L-苏氨酸。与棘白霉素类pneumocandinA0结构相比较,其典型差异为R7位的谷氨酰胺为苏氨酸所取代。针对pneumocandinA0进行的氨基酸研究显示3S-羟基-4S-甲基-L-脯氨酸的前体为亮氨酸,而非脯氨酸[19]。所以,在试验设计中,也选取了亮氨酸进行前体作用考察。
如图1所示,在发酵培养基中添加终浓度为1 mg/mL的脯氨酸、苏氨酸、鸟氨酸,能够提高ECB的发酵水平。与对照相比,ECB产量分别提高5.5%、4.7%和3.2%。添加酪氨酸使菌丝量较对照增加4.3%,但对产物合成促进作用不显著。添加亮氨酸,菌体量减少,ECB发酵水平也有所降低。
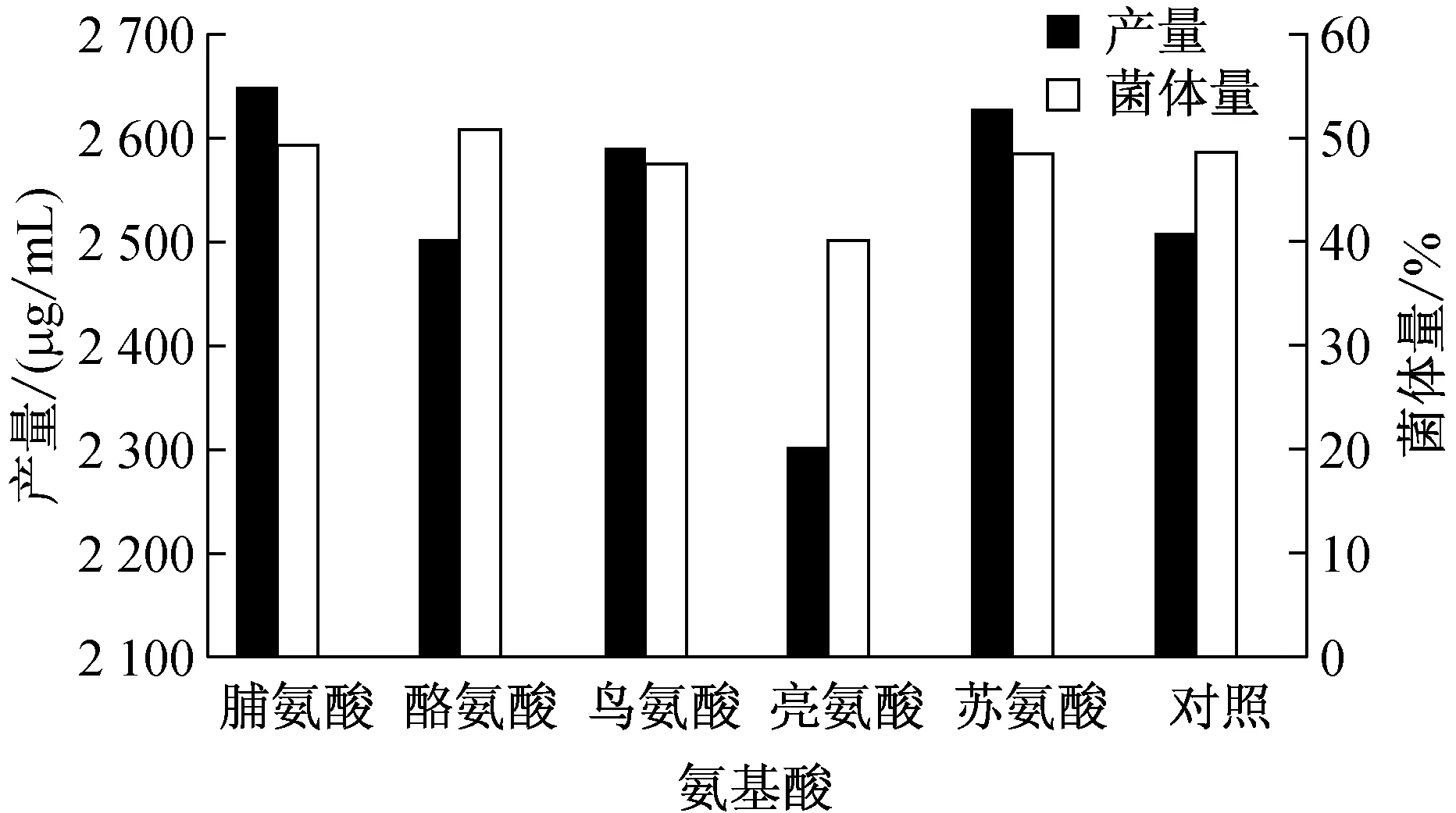
图1 添加不同前体对ECB发酵水平的影响
2.2前体补料时间的影响及剂量范围考察
对优选出的脯氨酸、苏氨酸和鸟氨酸在发酵前期、中期和后期进行补料考察。如图2所示,0 h~24 h补加三种氨基酸对发酵产量的影响不显著,48 h~96 h相较对照组提高程度最为显著。观察构巢曲霉菌丝形态,前期菌丝分散,呈米白色,菌体量快速增长,初级代谢特征显著;48 h后,菌丝结球呈颗粒状,颜色逐渐加深,营养利用加速,培养基逐渐澄清,产物合成速度加快。在此期间,氨基酸发挥前体促进作用。最适补加时间为48 h,三种氨基酸提高比例达5.1%~8.8%。

图2 前体氨基酸补料时间对发酵的影响
设定原发酵配方中主要有机氮源—棉籽饼粉分别为3.0%、2.2%,进行氨基酸补料浓度范围考察。在考察剂量范围内呈现出作用不显著、促进、毒性三种影响趋势(表1)。棉籽粉3.0%时,脯氨酸优势表现集中在1.0 mg/mL~5.0 mg/mL,发酵相对效价提高8.5%~12.1%;鸟氨酸0.5 mg/mL~2.0 mg/mL时,发酵相对效价提高4.2%~7.3%;苏氨酸0.5 mg/mL~1.0 mg/mL时,发酵相对效价提高4.9%~6.8%。在低氮条件下,虽然整体发酵水平有所下降,但是前体作用对发酵代谢的影响更加突出,脯氨酸在适宜浓度范围发酵相对效价提高至10.6%~15.4%;鸟氨酸单因素影响发酵相对效价提高至5.7%~10.1%;苏氨酸单因素影响发酵相对效价提高5.5%~12.4%。
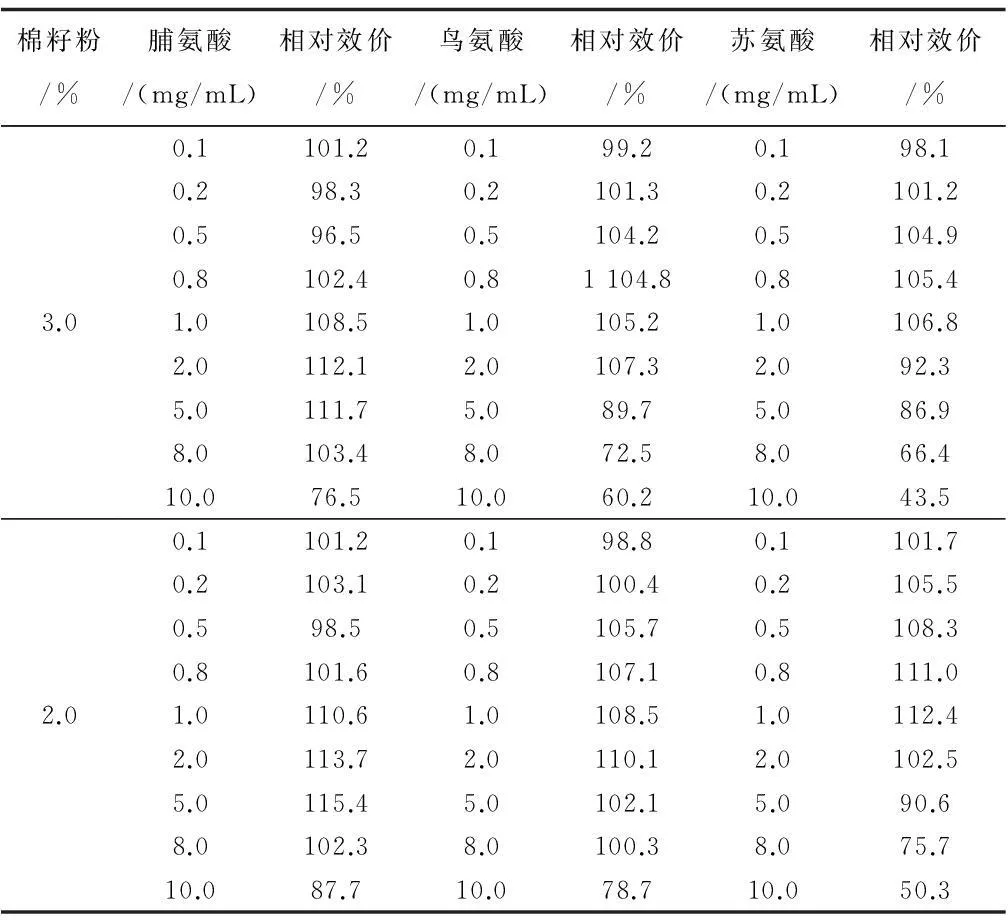
表1 棉籽饼粉及氨基酸浓度对发酵产量的影响
2.3响应面统计方法优化发酵培养前体氨基酸与有机氮源配方组合
2.3.1最陡爬坡实验
根据优选出的前体氨基酸脯氨酸、鸟氨酸、苏氨酸以及原配方中有机氮源棉籽粉相互影响考察结果,设定其变化方向及步长,进行最陡爬坡实验,进一步缩小响应面目标区域。如表2所示,选取第4组为中心浓度。
2.3.2二次回归曲线拟合及方差分析显著性检验
在上述实验基础之上,利用软件design-expert 7.0进行Box-behnken响应面分析,设计4因素3水平试验,试验设计组24组,中心浓度组重复5次(表3、表4)。

表2 最陡爬坡实验设计及结果

表3 Box-behnken试验设计因素水平表
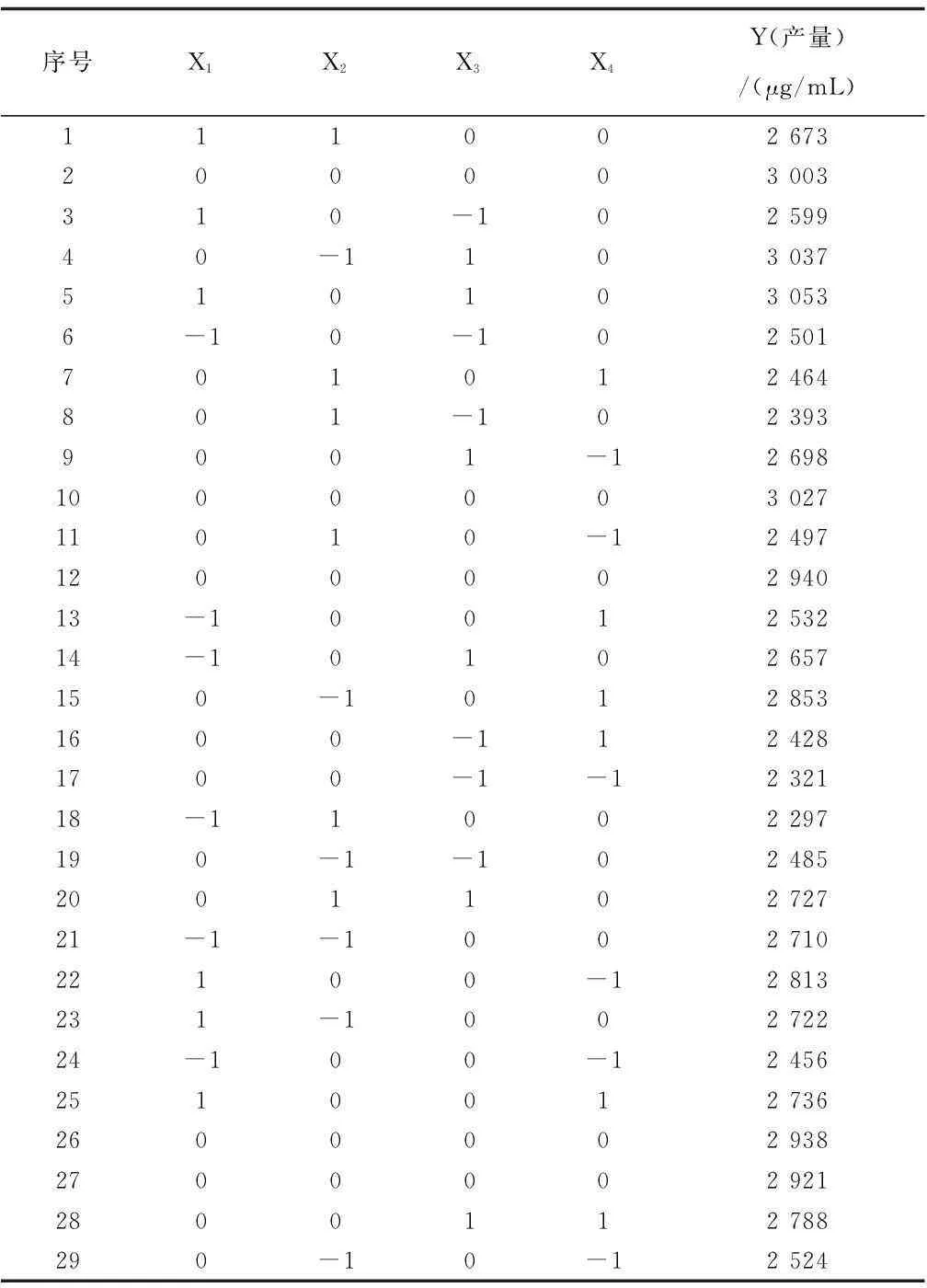
表4 Box-Behnken试验设计及结果
以ECB发酵单位为响应值,对试验结果作二次回归拟合,得到二次方程:
Y=-47 759.92+1 057.70X1+4 786.07X2+6 627.67X3+31 159.50X4+182.00X1X2+372.50X1X3-191.25X1X4-545.00X2X3-905.00X2X4-106.25X3X4-137.78X12-734.60X22-3 638.12X32-5 441.25X42
方差分析结果如表5所示。拟合曲线方程概率P<0.0001,为高度显著性影响;失拟项P为0.224 5,表示拟合曲线与实验数据不符情况为不显著;方程中各项X2、X3、X4、X1X2、X1X3、X2X4、X12、X22、X32、X42影响显著;R2为0.96(表6),调整R2为0.920 1,拟合曲线相关性好;精确度16.056,变异率2.38%,显示试验精确度高,拟合二次曲线适用于本试验设计的进一步引导和优化。
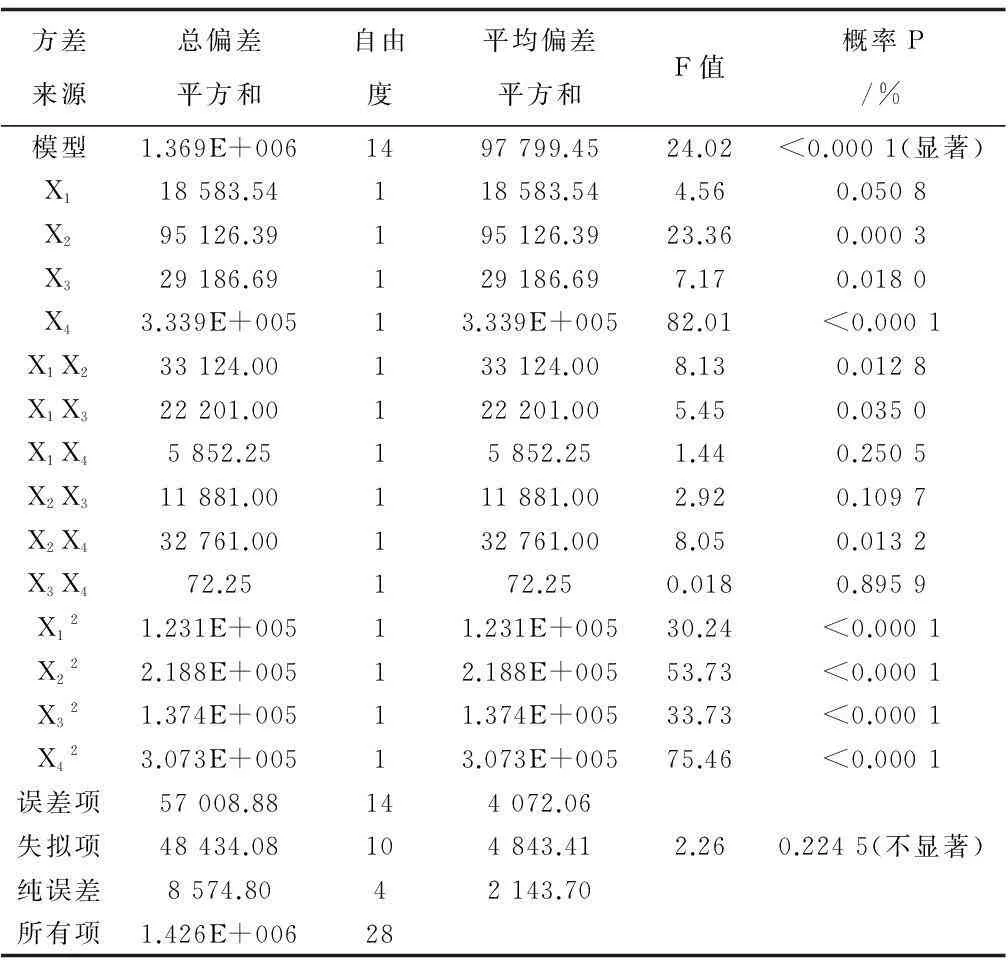
表5 回归方程方差分析

表6 模型可信度分析
2.3.3响应面分析及最佳培养基成分确定
响应面分析结果如图2所示,得最优解为:脯氨酸4.55 mg/mL,鸟氨酸1.85 mg/mL,苏氨酸0.97 mg/mL,棉籽粉2.62%,预报最大响应值为3 094.68 μg/mL。


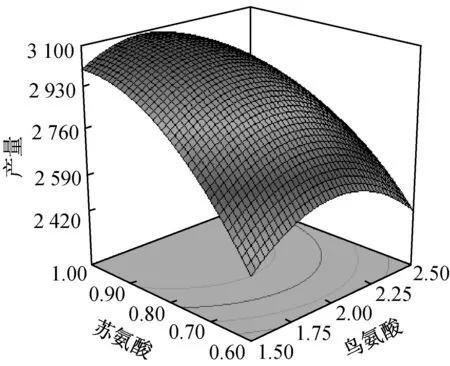


图3 响应面三维空间分析图
工艺通气量/(r/min)产量/(μg/mL)菌体量/%新工艺原工艺220315047250327052220250860250251162
2.3.4摇瓶验证
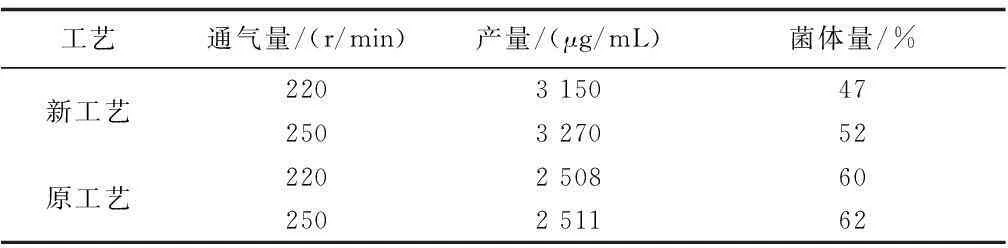
以优化的氮源及前体补料工艺在250 mL摇瓶中进行工艺验证,前体氨基酸组方于发酵48 h一次补入,144 h放瓶时菌体量降低至对照组的78.3%,ECB发酵水平提升至3 150 μg/mL。进一步提高摇床转速,增加溶氧,优化工艺的摇瓶水平可继续提升至3 270 μg/mL,较原工艺提升幅度达30.2%。
2.3.5罐放大试验
新工艺在50 L罐上进行二级发酵放大,前期0 h~24 h通气量1.8 m3/h,搅拌转速300 r/min,48 h以后提高通气量为2.2 m3/h,搅拌转速400 r/min,于48 h进行前体组方一次性补料,发酵周期144 h。发酵前期菌体量增至32%。44 h~48 h菌丝渐成球状颗粒,次级代谢启动,效价单位快速增长,期间碳氮代谢平衡,pH维持在6.2~6.5,溶氧水平达到50%以上,显著优于原工艺。至放罐时,菌丝量达到40.3%,放罐单位达到3 520 μg/mL,较原工艺水平提高39.5%。

原工艺

前体补料工艺
3结论
根据棘白霉素B生物合成途径,考察参与己肽环合成的5种氨基酸对构巢曲霉的发酵代谢影响,确定了三种在发酵中表现为促进作用的前体性氨基酸:脯氨酸、鸟氨酸、苏氨酸。结合有机氮源基础发酵配方,表现出氨基酸前体与原配方中天然有机氮源有明显交互影响。在高氮源环境下,容易产生前体代谢反馈抑制。采用deaign-expert7.0软件中响应面统计学方法,针对三种氨基酸和棉籽粉进行实验设计及统计学分析和组方优化,得到高度显著性的拟合二次曲线,推算出最大响应值配方为:脯氨酸4.55 mg/mL,鸟氨酸1.85 mg/mL,苏氨酸0.97 mg/mL,棉籽粉2.62%。摇瓶验证发酵水平可达3 270 μg/mL,提高幅度30.2%。50 L罐放大进一步显示新工艺的优势,表现为菌丝量降至对照值的78.8%,次级代谢过程中溶氧水平显著改善,碳氮源利用平衡,放罐发酵水平达到3 520 μg/mL,较原工艺水平提高39.5%。
参考文献
[1]Debono M, Turner WW, LaGrandeur L,etal. Semisynthetic chemical modification of the antifungal lipopeptide echinocandin B (ECB): structure-activity studies of the lipophilic and geometric parameters of polyarylated acyl analogs of ECB. J Med Chem, 1995, 38(17): 3271-3281.
[2]Arendrup MC. Epidemiology of invasive candidiasis. Current opinion crtical care, 2010, 16(5): 445-452.
[3]Mayr A, Aigner M, Lass-Flörl C. Caspofungin: when and how? The microbiologist's view. Mycoses, 2012, 55(1): 27-35.
[4]Debono M, Gordee RS. Antibiotics that inhibit fungal cell wall development. Annu Rev Microbiol, 1994, 48: 471-497.
[5]Uzun O, Kocagz S, Cetinkaya Y,etal. In vitro activity of a new echinocandin, LY303366, compared with those of amphotericin B and fluconazole against clinical yeast isolates. Antimicrob Agents Chemother, 1997, 41(5): 1156-1157.
[6]Joseph JM, Kim R, Reboli AC. Anidulafungin: a drug evaluation of a new echinocandin. Expert Opin Pharmacother, 2008, 9(13): 2339-2348.
[7]Benz F, Knüsel F, Nüesch J,etal. Metabolic products of microorganism 143. Echinocandin B, a new polypeptide antibiotic fromAspergillusnidulansvar echinulatusisolation and building units. Helv Chim Acta, 1974, 57(8): 2459-2477.
[8]Cacho RA, Jiang W, Chooi YH,etal. Identification and characterization of the echinocandin B biosynthetic gene cluster fromEmericellarugulosaNRRL 11440. J Am Chem Soc, 2012, 134(40):16781-16790.
[9]Tomishima M, Ohki H, Yamada A,etal. FK463, a novel water-soluble echinocandin lipopeptide: synthesis and antifungal activity. J Antibiot (Tokyo),1999, 52(7):674-676.
[10]Masurekar PS, Fountoulakis JM, Hallada TC,etal. Pneumocandins fromZalerionarboricola. II. Modification of product spectrum by mutation and medium manipulation. J Antibiot(Tokyo), 1992, 45(12): 1867-1874.
[11]Petersen L, Olewinski R, Salmon P,etal. Novel proline hydroxylase activities in the pneumocandin-producing fungusGlarealozoyensisresponsible for the formation of trans-3-and trans-4-hydroxyproline. Appl Microbiol Biotechnol, 2003, 62(2-3): 263-267.
[12]Zou SP, Zhong W, Xia CJ,etal. Mutagenesis breeding of high echinocandin B producing strain and further titer improvement with culture medium optimization. Bioprocess Biosyst Eng, 2015,38(10): 1845-1854.
[13]Hodges RL, Hodges DW, Goggans K,etal. Genetic modification of an echinocandin B-producing strain ofAspergillusnidulansto produce mutants blocked in sterigmatocystin biosynthesis, J Ind Microbiol, 1994, 13(6): 372-381.
[14]Hodges RL, Kelkar HS, Xuei X,etal. Characterization of an echinocandin B-producing strain blocked for sterigmatocystin biosynthesis reveals a translocation in the stcW gene of the aflatoxin biosynthetic pathway, J Ind Microbiol Biotechnol, 2000, 25(6): 333-341.
[15]Cockshott AR, Sullivan GR. Improving the fermentation medium for Echinocandin B production. Part I: sequential statistical experimental design. Precess biochem, 2001, 36(7): 647-660.
[16]Cockshott AR, Sullivan GR. Improving the fermentation medium for Echinocandin B production. PartII: Partical swarm optimization. Precess biochem, 2001, 36(7): 661-669.
[17]张佳鑫, 刘龙, 李江华等. 利用响应面法优化Aspergillussp.BCRC 31742产氨基葡萄糖发酵培养基[J]. 工业微生物, 2013, 3(2): 51-57.
[18]冷凤, 孔鹏, 谢新宇等. 聚合物纳米微球分离纯化棘白霉素B母核方法研究[J]. 化学与生物工程, 2015, 31(11): 31-33.
[19]Adefarati AA, Giacobbe RA, Hensens OD,etal.Biosynthesis of L-671,329, an echinocandin type antibiotic produced byZalerionarboricolaorigins of some of the unusual amino acid and the dimethylmyristic and side chain C. J Am Chem Soc, 1991, 113(9): 3542-3545.
Effects of amino acid precursors on echinocandin B biosynthesis
WANG Yao-yao, FU Mei-hong, ZHU Yan-yan, HAO Hui-yun, WANG Ya-li, ZHANG Xue-xia
National Engineering Research Center of Microbial Medicine;Hebei Industry Microbial Metabolic Engineering & Technology Research Center;New Drug Research & Development Company of NCPC, Shijiazhuang 050015
AbstractEchinocandin B (ECB), a lipopeptide natural product, was produced by Aspergillus nidulans strain. Biosynthesis of ECB was influenced by amino acid precursors of hexapeptide. It was showed that L-proline, L-ornithine and L-threonine could improve the synthesis of secondary metabolites, and the proper precursor feeding time was 48 h. By response surface methodology, the optimized concentrations of precursors and organic nitrogen source were obtained. The proper composition contained L-proline 4.55 mg/mL, L-ornithine 1.85 mg/mL, L-threonine 0.97 mg/mL, cottonseed meal 2.62%. Under the optimal fermentation conditions, yield of ECB reached to 3 270 μg/mL in shake flask, which increased by 30.2% compared with original level. Furthermore, a fed-batch culture in a 50 L fermentor was conducted. The yield of ECB further reached to 3 520 μg/mL, which indicated great potential in industrial applications.
Key wordsechinocandin B; lipopeptide; response surface methodology; amino acid precursors
doi:10.3969/j.issn.1001-6678.2016.02.001
基金项目:国家“重大新药创制”科技专项(2014ZX09201001-002)。
作者简介:王耀耀(1971~),女,江苏省泰州,高级工程师,从事生物制药研究。E-mail:wyy711024@126.com。 *通讯作者:张雪霞,女,研究员级正高级工程师,从事天然药物研究。Tel.:0311-86685347,E-mail:zhangxuexiazxx@163.com。
