电解质溶液中离子浓度大小比较的方法
2016-06-24王芬陕西省白河县白河高级中学陕西白河725800
王芬(陕西省白河县白河高级中学,陕西 白河 725800)
电解质溶液中离子浓度大小比较的方法
王芬
(陕西省白河县白河高级中学,陕西 白河 725800)
摘 要:随着高考改革的进一步推进,化学在高考选考科目中的地位仅次于物理,居第二位,很多高校的很多专业都要求考化学。而化学学科的整体难度不是很大,但是溶液的相关知识是学生必须要掌握的。在这部分知识中,学生往往感觉溶液中离子浓度大小比较很复杂,不知如何入手。为解决学生学习此类问题的困难,我总结了以下方法。
关键词:溶液;离子浓度;大小比较;方法
对于溶液中离子浓度大小比较,是中学阶段化学知识的一个难点,尤其是涉及弱电解质的电离、弱离子的水解相关问题时,很多学生不知从何下手,不知道此类试题的基本分析方法。笔者通过大量的练习,多年积累,结合学生的思维特点,总结出解决此类问题的基本方法和思路。
归纳为“三看”:
一看反应——看溶液中溶质之间是否发生反应;
二看成分——分析溶液中的溶质成分;
三看酸碱性——分析溶液的酸碱性。
下面就通过几个具体的实例分析此方法的应用。
【例1】将0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
A.c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
B.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
D.c(Na+)+C(H+)=c(CH3COO-)+c(Cl-)+c(OH-)
【解析】

二看成分:由以上反应比例可知,CH3COONa过量0.001mol,生CH3COOH 0.001mol,NaCl 0.001mol。溶液中溶质为CH3COOH、CH3COONa和NaCl形成的等物质的量混合物。
三看酸碱性:由题意可知溶液显酸性。
再结合溶液中的电荷守恒:c(H+)+c(Na+)=c(CH3COO-)+ c(OH-)+c(Cl-),D对;由溶液显酸性,所以CH3COOH的电离程度小于CH3COO-的水解程度,c(CH3COO-)>0.001mol,c(CH3COOH)<0.001mol,Na+、Cl-不水解知c(Na+)=0.002mol,c(Cl-)=0.001mol,B对,A、C错。
【答案】BD。
【例2】0.02mol·L-1的HCN溶液与0.02mol·L-1NaCN溶液等体积混合,已知该混合溶液中c(Na+)>c(CN-)。用“>”“<”或“=”符号填写下列空格:
(1)液中c(H+)____c(OH-)(2)c(HCN)____c(CN-)
(3)c(HCN)+c(CN-)____0.02mol·L-1。
【解析】
一看反应:HCN与NaCN不反应。
二看成分:溶液中溶质为HCN和NaCN形成的等物质的量混合物。
三看酸碱性:已知该混合溶液中c(Na+)>c(CN-),结合电荷守恒c(H+)+c(Na+)=c(CN-)+c(OH-)知c(OH-)>c(H+),溶液显碱性。
由物料守恒知:c(CN-)+c(HCN)=2c(Na+);由于溶液显碱性,所以HCN的电离程度小于CN-的水解程度,c(HCN)>c(CN-)。
【答案】(1)<;(2)>;(3)=
【例3】(1)取0.2mol·L-1的HX溶液与0.2mol·L-1NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(X-)。
①混合溶液中c(HX)____c(X-);
②混合溶液中c(HX)+c(X-)____0.1mol·L-1(忽略体积变化);
③混合溶液中由水电离出的c(OH-)____0.2mol·L-1HX溶液中由水电离出的c(H+)。
(2)如果取0.2mol·L-1HX溶液与0.1mol·L-1NaOH溶液等体积混合,测得混合溶液中pH>7,则说明HX的电离程度
____NaX的水解程度。
【解析】设溶液体积均为V升
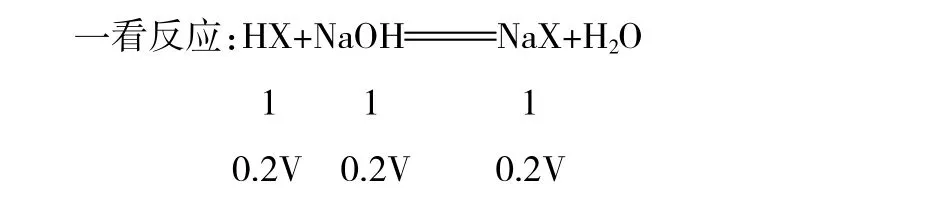
二看成分:由以上反应比例可知,HX与NaOH恰好完全反应。溶液中溶质为NaX。
三看酸碱性:由题干“c(Na+)>c(X-)”及电荷守恒可知溶液显碱性。
在NaX溶液中,c(X-)>c(HX);由物料守恒知:c(X-)+c(X2)=c (Na+)=0.1;0.1mol·L-1;NaX促进水的电离而HX抑制水的电离,所以NaX溶液中由水电离出的c(OH-)大于0.2mol·L-1HX溶液中由水电离出的c(H+);0.2 mol·L-1HX溶液与0.1 mol· L-1NaOH溶液等体积混合时,所得溶液为HX与NaX的等物质的量混合溶液,pH>7,则说明HX的电离程度小于NaX的水解程度。
【答案】(1)①<②=③>(2)<
学无定法,贵在得法。对于一类问题,只要有合适的方法,反复练习,就能达到融会贯通的效果,以不变应万变。高考试题也就变得得心应手了!
参考文献:
[1]瞿洋.曲线变化中实现课堂的高效性——高三复习课“电解质溶液中离子浓度大小的比较”教学设计[J].中学化学教学参考,2015(10).
[2]李琼芬.“电解质溶液中离子浓度大小比较”试题的归类解析[J].云南教育:中学教师,2015(2).
[责任编辑 赵建荣]
Comparison Methods of the Ionic Concentration in Electrolyte Solution
WANG Fen
(Baihe Senior Middle School,Baihe Shaanxi,725800,China)
Abstract:With the further reform of college entrance examination,chemistry ranks second only to the physical chemistry in the college entrance examination in the selected test subjects. A lot of professional colleges and universities require chemical test. The relevant knowledge of solution is something students must master. In this part of knowledge,students often feel the comparison of ionic concentration is very complicated. To solve the problem,the author summarizes the following methods.
key words:solution;ionic concentration;size comparison;methods
中图分类号:G63
文献标识码:A
文章编号:1673-9132(2016)19-0093-02
DOI:10.16657/j.cnki.issn1673-9132.2016.19.059
