五倍子和石榴皮对溶藻弧菌及其生物膜的体外抑制作用
2016-06-23冯锐基庞欢瑛黄郁葱简纪常
冯锐基,庞欢瑛,2*,黄郁葱,2,简纪常,2
(1.广东海洋大学水产学院,广东湛江 524088;2.广东省水产经济动物病原生物学及流行病学重点实验室,广东湛江 524088)
五倍子和石榴皮对溶藻弧菌及其生物膜的体外抑制作用
冯锐基1,庞欢瑛1,2*,黄郁葱1,2,简纪常1,2
(1.广东海洋大学水产学院,广东湛江 524088;2.广东省水产经济动物病原生物学及流行病学重点实验室,广东湛江 524088)
摘要[目的]明确五倍子(Rhus chinenis)、石榴皮(Folium sennae)对溶藻弧菌(Vibrio alginolyticus)及其生物膜的体外抑制作用。[方法]采用琼脂扩散法,分别测定五倍子、石榴皮对溶藻弧菌的体外抑菌作用;选用倍比稀释法确定五倍子、石榴皮对溶藻弧菌的最小抑菌浓度(MIC)和最小杀菌浓度(MBC);采用改良微孔板法评价2种中草药液对溶藻弧菌生物膜形成的影响。[结果] 2种中草药都有不同程度的抑制溶藻弧菌的作用,五倍子对溶藻弧菌的抑菌圈直径为(16.37±0.14)mm,MIC和MBC均为6.25 mg/mL;石榴皮对溶藻弧菌的抑菌圈直径为(12.37±0.06)mm,MIC和MBC分别为12.50、25.00 mg/mL。当药物浓度在1.56 mg/mL及以上时,五倍子对溶藻弧菌生物膜的形成有极显著抑制作用;药物浓度在6.25 mg/mL及以上时,石榴皮对溶藻弧菌生物膜的形成有极显著抑制作用。[结论]五倍子和石榴皮对溶藻弧菌及其生物膜均有抑制作用。
关键词五倍子;石榴皮;溶藻弧菌;体外抑制作用;生物膜
溶藻弧菌属于弧菌科弧菌属,革兰氏阴性短杆菌,能在有氧或无氧的环境中生长、繁殖,单个存在或尾端相连接形成“S”或“C”形[1]。溶藻弧菌广泛存在于海水区及河口处[2],在海水型弧菌中居于首位[3],能引发鱼、虾、贝、蟹等多种水产养殖动物的疾病,严重危害我国水产养殖行业[4]。
细菌生物膜是指由附着于惰性或活性实体表面的细菌细胞和包裹着细菌的水合性基质所构成的结构性细菌群落[5]。研究表明,大部分细菌在适宜条件下都可形成生物膜[6],处于生物膜状态下的细菌能轻易逃避抗生素和宿主的免疫机制,对细菌病的预防和治疗造成困难。目前,关于细菌生物膜防治成为研究热点。五倍子和石榴皮是常用的中草药,在防治水产动物疾病中有着广泛应用。张明等[7]研究发现五倍子对鳗弧菌的抑菌效果显著,金珊等[8]研究发现石榴皮对哈氏弧菌的抑菌效果较好,但关于这2种中药对溶藻弧菌及其生物膜抑制作用的研究还鲜见报道。鉴于此,笔者研究了五倍子和石榴皮对溶藻弧菌及其生物膜的体外抑制作用,以期为应用中药防治由溶藻弧菌引起的弧菌病提供理论依据。
1材料与方法
1.1材料
1.1.1供试菌株。溶藻弧菌HY9901由广东省水产经济动物病原生物学及流行病学重点实验室自广东省湛江海域患病红笛鲷(Lutjanuserythopterus)鱼体中分离并保存[9]。五倍子、石榴皮购自广东省湛江春天药房。
1.1.2主要仪器。-80 ℃超低温冰箱购自山东省青岛海尔公司;SZ-93自动双重双蒸水蒸馏器购自上海市亚荣生化仪器厂;自动高压灭菌锅(HVE-50)购自日本Hirayama公司;恒温培养箱购自上海市博迅实业有限公司医疗设备厂;酶标仪购自美国Bio-Rad公司。
1.1.3药剂与试剂。胰蛋白胨大豆肉汤培养基(TSB):大豆蛋白胨5.00 g,胰蛋白胨15.00 g,NaCl 20.00 g,蒸馏水定容至1 000 mL(调pH至7.2),高压灭菌,4 ℃保存。胰蛋白胨大豆琼脂培养基(TSA):大豆蛋白胨5.00 g,胰蛋白胨15.00 g,琼脂粉15.00 g,NaCl 20.00 g,蒸馏水定容至1 000 mL(调节pH至7.2)。四甲基偶氮唑盐(MTT)的配制:将0.50 g MTT溶于 100 mL磷酸缓冲液(PBS)中,用 0.22 μm滤膜过滤以去除溶液中的细菌,4 ℃避光保存。PBS:Na2HPO41.44 g,NaCl 8.00 g,KCl 0.20 g,KH2PO40.24 g,调pH至7.4,定容至1 000 mL,高压蒸汽灭菌,室温保存。0.85%生理盐水:将0.85 g NaCl用蒸馏水定容至1 000 mL,高压灭菌后保存。
1.2方法
1.2.1溶藻弧菌的培养。菌株接种在含2%NaCl的TSB中,28 ℃、120 r/min摇床培养18 h。用无菌TSB将菌悬液的密度调至OD600=0.8(约1×108cfu/mL)备用[10]。
1.2.2中草药水煎液的制备。包括浸泡、煎煮、过滤和浓缩4道工序:称取中草药20.00 g,剪碎后放入装有400 mL蒸馏水的陶瓷锅中,浸泡约4 h,加热至沸腾后,改文火煎煮40 min;煎好的中草药冷却后立即用8层纱布过滤,药渣用蒸馏水重复煎煮1次,合并2次滤液;加热滤液浓缩至20 mL,冷却后装于小药瓶中,制得终浓度为1 g/mL的中草药水煎液,于4 ℃冰箱保存。
1.2.3药物体外抑菌试验。采用琼脂扩散法。向灭菌的平板内倒入TSA培养基10 mL,冷凝后备用。每种药液设3个试验组,分别向平板加100 μL菌液,涂抹均匀,然后用打孔器在每个平板上打3个孔(每孔直径为6.00 mm,且两孔距离不小于2 cm),每孔加入30 μL药液,另设1个涂有菌液的平板作对照。将平板置于28 ℃培养箱中培养24 h,观察抑菌效果,并用游标卡尺测量抑菌圈。抑菌效果判定:抑菌圈直径≥20 mm为强抑菌作用,用“+++”表示;抑菌菌直径在15~20 mm为中等抑菌作用,用“++”表示;抑菌圈直径在10~15 mm为弱抑菌作用,用“+”表示;抑菌圈直径≤10 mm为无抑菌作用,用“-”表示。
1.2.4MIC的测定。采用倍比稀释法。试验组设9支无菌试管,编号为1~9,每支试管加入TSB 2 mL,向1号管加入1 g/mL药液2 mL,充分混匀后,从1号管中取出2 mL移入2号管,以此类推直至稀释到9号管,从中吸出药物混液2 mL,丢弃,再向前7支管各加入菌液20 μL,8号管作为阴性对照管,9号管作为空白对照管。最后将所有管置于28 ℃恒温摇床上培养24 h。无细菌生长的稀释管的药物浓度即为供试药物对溶藻弧菌的MIC。
1.2.5MBC的测定。从测定MIC的试管中取细菌生长不明显的试管,从中取100 μL涂布于TSA平板,于28 ℃恒温培养箱中培养24 h,观察结果。TSA平板上无细菌生长且含药液浓度最低管的药液浓度即为供试药物对溶藻弧菌的MBC[11]。
1.2.6溶藻弧菌生物膜的形成与定量检测。采用MTT法[11]。具体步骤:①生物膜培养。将菌悬液按1∶100比例稀释到新鲜TSB中;将稀释好的混液以每孔200 μL加入96孔板中,每组设8个重复孔,并设无菌TSB对照孔;在28 ℃湿盒中静止孵育。②染色。慢慢吸取培养液,用 PBS 缓冲液轻轻洗涤未黏附的菌细胞,吸弃培养基后,每孔加入二甲基亚砜150 μL,置摇床上低速振荡 10 min。③定量检测。用酶标仪测定OD(490 nm)值。各孔OD值与调零孔平均值之差代表各孔生物膜的代谢活性。
1.2.7不同培养时间对溶藻弧菌成膜的影响试验。溶藻弧菌接种于96孔板后,置于28 ℃湿盒中静止培养,每隔4~6 h取样,按“1.2.6”方法测定成膜情况。
1.2.8中草药液对溶藻弧菌生物膜形成的影响试验。在无菌条件下,把细菌悬浮液与新鲜TSB按1∶100的比例混合均匀,加入中草药水煎液,倍比稀释后,分别上样200 μL至96孔板中,每组设8个重复孔,并设置阳性对照组[含0.1 mol/L乙二胺四乙酸(EDTA)]、阴性对照组(含培养基和菌液)和仅含培养基的空白对照组,28 ℃湿盒中培养24 h,按“1.2.6”方法测定成膜情况。同上述方法设立无菌的药物对照组。
1.2.9数据处理。应用SPSS Statistics17.0 软件中的成对样本t检验进行数据统计分析。
2结果与分析
2.12种中草药的抑菌效果由表1可知,五倍子对溶藻弧菌有中等抑菌作用,石榴皮有弱抑菌作用。
表1五倍子和石榴皮对溶藻弧菌的体外抑菌试验结果
Table 1Antibacterial effect ofFoliumsennaeandRhuschinenisagainstVibrioalginolyticus

中草药Chineseherbalmedicine抑菌圈直径Diameterofinhibitionzone∥mm抑菌效果Antibacterialeffect五倍子Rhuschinenis16.37±0.14++石榴皮Foliumsennae12.37±0.06+
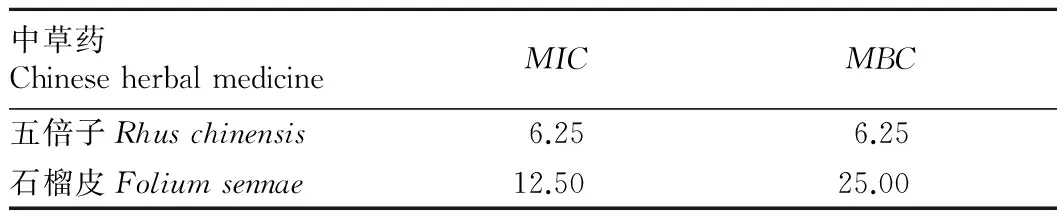
2.2MIC和MBC测定结果由表2可知,五倍子的抑菌效果较好,MIC和MBC均为6.25 mg/mL。石榴皮的抑菌作用较弱,MIC和MBC分别为12.50、25.00 mg/mL。
表2五倍子和石榴皮对溶藻弧菌的MIC和MBC
Table 2TheMICandMBCofFoliumsennaeandRhuschinensisagainstVibrioalginolyticus
mg/mL
2.3溶藻弧菌生物膜生长曲线由图1可知,溶藻弧菌生物膜的生长周期:2~4 h为初始定植阶段,8~16 h为黏附阶段,20~24 h为成熟阶段,36 h开始解聚。
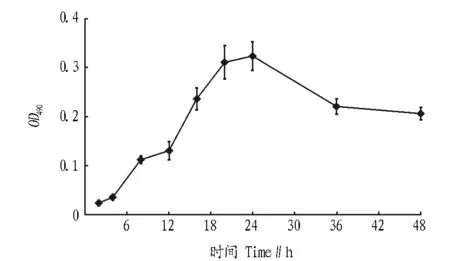
图1 溶藻弧菌生物膜生长曲线Fig.1 Growth cure of Vibrio alginolyticus biofilm formation
2.4不同药物浓度对溶藻弧菌生物膜形成的影响由图2可知,与未加药阴性对照孔相比较,五倍子药物浓度在0.78 mg/mL及以下时,其对溶藻弧菌生物膜的抑制作用无显著差异;五倍子浓度在1.56 mg/mL及以上时,其对溶藻弧菌生物膜的形成有极显著抑制作用。
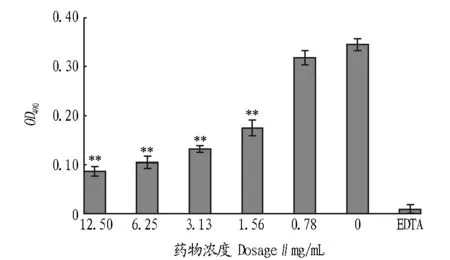
注:**表示P<0.01Note:** indicated P < 0.01.图2 五倍子对溶藻弧菌生物膜形成的影响Fig.2 Effects of Rhus chinensis on the formation of Vibrio alginolyticus biofilm
由图3可知,与阴性对照相比较,石榴皮药物浓度在3.13 mg/mL及以下时,其对溶藻弧菌生物膜的抑制作用无显著差异;石榴皮浓度在6.25 mg/mL及以上时,其对溶藻弧菌生物膜的形成有极显著抑制作用。
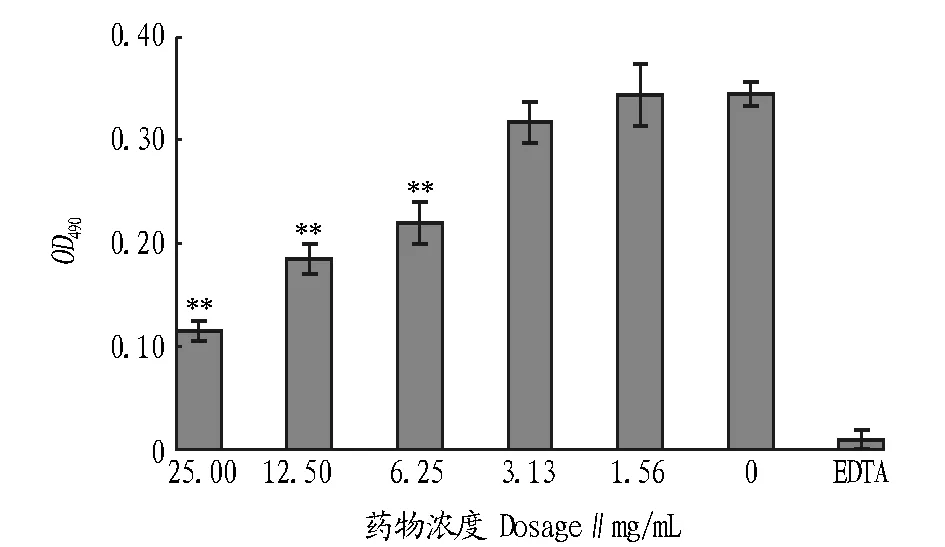
注:**表示P<0.01Note:** indicated P < 0.01.图3 石榴皮对溶藻弧菌生物膜形成的影响Fig.3 Effects of Folium sennae on the formation of Vibrio alginolyticus biofilm
3结论与讨论
该研究表明,五倍子和石榴皮对溶藻弧菌及其生物膜均有抑制作用。在药物成分中,当化学键振动的波长等于某种细菌的长度时会发生共振,化学键的共振有杀菌作用,鞣质中的O-H 键波长在很多细菌长度范围以内[12]。鞣质可凝固微生物体内的原生质及多种酶,对多种细菌、真菌、酵母菌都有明显的抑制作用。鞣质是五倍子的主要有效成分,研究表明五倍子对多种弧菌具有抑制作用。例如,张晓君等[13]研究了哈氏弧菌对中草药的敏感性,发现五倍子具有极强的抑菌作用;李忠琴等[14]研究了中药对鳗鲡病原菌的体外抑制作用,发现五倍子的抑菌作用最强;王玉娥等[15]发现五倍子对溶藻弧菌有明显的杀菌作用,其MIC、MBC均为1.56 mg/mL。该研究探索了五倍子对溶藻弧菌的体外抑菌作用,结果表明:五倍子对溶藻弧菌有中等抑菌作用(++),其抑菌圈直径为(16.37±0.14)mm,MIC和MBC均为6.25 mg/mL;五倍子除了有抑菌作用外还能抑制生物膜的形成,加药液的成膜量明显小于未加药,随着五倍子浓度的增加其抑制生物膜生长的效果逐渐增强,当五倍子浓度在1.56 mg/mL及以上时,其对溶藻弧菌生物膜的形成有极显著抑制作用。
现代药理研究表明,石榴皮中的鞣质、黄酮类化合物是其抗菌的活性组分[16]。陈霞等[17]对47种中草药体外抑杀嗜水气单胞菌的药效试验结果表明石榴皮的抑菌和杀菌效果最好。梁利国等[18]发现石榴皮对鳗弧菌、副溶血弧菌、河口弧菌及霍乱弧菌等细菌具有较好的抑菌和杀菌作用。该研究探索了石榴皮对溶藻弧菌的体外抑菌作用,结果表明:石榴皮的抑菌效果为弱抑菌(+),抑菌圈直径为(12.37±0.06)mm,其MIC和MBC分别为12.50、25.00 mg/mL;石榴皮除了抑菌作用外还能抑制生物膜的形成,石榴皮浓度在6.25 mg/mL及以上时明显抑制了生物膜的生长。
该试验证明了五倍子和石榴皮这2种中草药对溶藻弧菌的游离菌及其生物膜形成具有抑制作用,对致病性弧菌引起的水产动物疾病防治具有参考意义。但该试验是在细菌相对稳定的生长环境中进行的,并未考虑到环境和用药方式等对药效的影响,具有一定的局限性,今后应在养殖环境和用药方法方面进行综合研究。此外,虽然中草药以其资源丰富、天然绿色、高效低毒、抗药性不显著且兼有药物性和营养性的特点而广泛应用于各种水生经济动物疾病的预防和控制,并取得了一定的成果,但目前中草药防治鱼病的知识和经验尚不能满足生产上的需要,国内外相关研究较少,并且中草药的有效成分复杂,其类型、含量受遗传因素、外界环境、地域性和季节性影响较大,分子结构难以鉴定,今后既要研究渔用中草药的主要成分和功效,又要广泛开展应用研究,筛选出防治效果理想的中草药配方,从而达到标本兼治的目的。
参考文献
[1] STEFAN H,HELMUT W,KARIN N B,et al.Isolation ofVibrioalginolyticusfrom seawater aquaria[J].Int J Hyg Environ Health,2000,203(2):169-175.
[2] KANEKO T,COLWELL R R.Ecology ofVibrioparahaemolyticusand related organisms in the Atlantic ocean off South Carolina and Georgia[J].Appl Microbiol,1973,28(6):1009-1017.
[3] 林业杰,陈亢川,陈拱立,等.溶藻弧菌噬菌体的分离[J].微生物学报,1993,33(4):285-289.
[4] SCHMIDT U,CHMEL H,COBBS C.Vibrioalginolyticusinfections in humans[J].Journal of clinical microbiology,1979,10(5):666-668.
[5] 李京宝,韩峰,于文功.细菌生物膜研究技术[J].微生物学报,2007,47(3):558-561.
[6] 姚刚,覃映雪,邹文政,等.致病性溶藻弧菌生物膜形成特性研究[J].水产科学,2012,31(2):73-78.
[7] 张明,王建华,赵毅,等.20味中药对鳗弧菌的药敏试验[J].动物医学进展,2005(8):77-79.
[8] 金珊,王国良,赵青松,等.中草药对海水养殖鲈鱼病原菌的抑菌效果研究[J].海洋科学,1999(5):8-10.
[9] CAI S,WU Z,JIAN J,et al.Cloning and expression of the gene encoding an extracellular alkaline serine protease fromVibrioalginolyticusstrain HY9901,the causative agent of vibriosis inLutjanuserythopterus(Bloch)[J].Journal of fish diseases,2007,30(8):493-500.
[10] 陈辉,张其中.100种中草药对溶藻弧菌的体外抑菌实验[J].中国预防兽医学报,2012,34(6):452-455.
[11] 贾红玲.新生隐球菌生物膜外分泌蛋白初步分析的研究[D].上海:第二军医大学,2012.
[12] 李军红,田胜尼,方晓光,等.5种常见中草药的抑菌性研究[J].生物技术通报,2006,32(S1):395-399.
[13] 张晓君,秦国民,阎斌伦,等.病原哈氏弧菌对20种中草药的敏感性测定及分析[J].江苏农业科学,2009(2):214-216.
[14] 李忠琴,关瑞章,汪黎虹,等.中药对鳗鲡病原菌的体外抑制作用[J].湖南农业大学学报(自然科学版),2011,37(3):306-311.
[15] 王玉娥,邢晨光,王国良.5种海洋致病弧菌对34种中草药敏感性的测定[J].水产科学,2008,27(5):221-225.
[16] 杨淑文.32 种中草药抑菌活性的比较研究[J].安徽农业科学,2011,39(3):1361-1362,1366.
[17] 陈霞,张其中,李春涛.47种中草药体外抑杀嗜水气单胞菌的药效研究[J].水产科学,2012,31(7):387-391.
[18] 梁利国,阎斌伦,张晓君,等.常用中草药对4种病原弧菌体外抗菌效果的研究[J].渔业科学进展,2010,31(2):114-119.
Inhibitory Activity ofRhuschinenisandFoliumsennaeonVibrioalginolyticusand Its Biofilm
FENG Rui-ji1, PANG Huan-ying1,2*, HUANG Yu-cong1,2et al
(1. College of Fisheries, Guangdong Ocean University, Zhanjiang, Guangdong 524088; 2. Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals, Zhanjiang, Guangdong 524088)
Abstract[Objective] To detect the inhibitory effects of Rhus chinenis and Folium sennae on Vibrio alginolyticus and its biofilm. [Method] The inhibitory effects of R. chinenis and F. sennae on V. alginolyticus were tested by agar diffusion method. The MIC and MBC were detected by the double dilution; the effects of R. chinenis and F. sennae on V. alginolyticus biofilm were measured by improved micro plate method. [Result] Two species of Chinese herbal medicines had different degrees of inhibition. R. chinenis had inhibitory effects with the diameter of inhibition zone (DIZ) of (16.37 ± 0.14) mm, and the MIC and MBC were 6.25 mg/mL; F. sennae had inhibitory effects with the diameter of inhibition zone (DIZ) of (12.37 ± 0.06) mm, and the MIC and MBC respectively were 12.50 and 25.00 mg/mL, respectively. Both R. chinenis and F. sennae exhibited a potent inhibitory activity against V. alginolyticus biofilm formation. [Conclusion] R. chinenis and F. sennae can significantly inhibit V. alginolyticus and its biofilm.
Key wordsRhus chinenis; Folium sennae; Vibrio alginolyticus; In vitro inhibitory activity; Biofilm
基金项目广东省教育厅基础研究重大培育项目(2014GKXM046);广东高校国际合作创新平台项目(2013gjhz0008);广东海洋大学创新强校项目(GDOU2015050216)。
作者简介冯锐基(1990- ),男,广东肇庆人,本科生,专业:水产养殖。*通讯作者,副教授,博士,从事水产经济动物病害研究。
收稿日期2016-03-15
中图分类号S 941.43
文献标识码A
文章编号0517-6611(2016)11-001-03
