葡萄糖脱氢酶温控表达菌株的构建及其发酵工艺
2016-06-22张志萌董自星王正祥路福平
李 杨,张志萌,董自星,王正祥,路福平
(工业发酵微生物教育部重点实验室,工业酶国家工程实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
葡萄糖脱氢酶温控表达菌株的构建及其发酵工艺
李 杨,张志萌,董自星,王正祥,路福平
(工业发酵微生物教育部重点实验室,工业酶国家工程实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
摘 要:膜结合型的吡咯喹啉醌依赖性葡萄糖脱氢酶(mPQQGDH,EC 1.1.5.2)是一种重要的氧化还原酶,因其在血糖诊断及葡萄糖传感器中的重要应用而受到广泛的关注.但是其低表达水平限制了这种酶的大规模工业化生产及应用.本文利用λ噬菌体的温敏型启动子PL-PR替换葡萄糖脱氢酶基因的启动子,构建了重组菌大肠杆菌(E. coli)B0013-120/pGCd::Km-PL-PR,并使重组菌的酶活比原始菌株提高了21.2%,.再通过发酵条件的优化,确定了mPQQGDH的最适诱导表达条件为:以甘油为碳源、诱导温度42,℃、诱导时间4,h、诱导前菌体密度A600=1.6.最后对该酶的酶学性质进行了分析,其最适反应温度和pH分别为25,℃和6.0,所得mPQQGDH的热稳定性在45,℃条件下可维持稳定的活性.这为葡萄糖脱氢酶更广泛的应用及工业化生产奠定了基础.
关键词:葡萄糖脱氢酶;温敏型启动子;高效表达;发酵工艺优化
数字出版日期:2015-10-16;数字出版网址:http://www.cnki.net/kcms/detail/12.1355.N.20151016.1454.010.html.
大肠杆菌葡萄糖脱氢酶(mPQQGDH,EC 1.1.5.2)是一种膜结合型醌蛋白,位于细胞膜外表面.在醌式辅酶吡咯喹啉醌(PQQ)的存在下能特异性催化葡萄糖生成葡萄糖酸.1975年,Banauch 等就提出利用上述反应,采用动态法或终点法分析测定人体体液中的葡萄糖浓度[1].近年来,以葡萄糖脱氢酶特异性反应为基础制成的血糖检测仪和生物芯片已广泛应用于医疗诊断和人体保健检测等领域[2-3].
启动子是基因表达调控的一种重要顺式作用元件,它一般具有序列特异性、位置特异性、种属特异性、方向性等几个明显的特征[4].tac启动子能够以乳糖或IPTG作为诱导剂诱导重组蛋白表达,成本较高,不适用于大规模工业化生产.而λ 噬菌体启动子PL和PR能够通过改变培养温度快速、有效地开启或关闭重组蛋白的表达[5].而且已被用于多种目的产物的表达,具有显著优势[6].此外,λ 噬菌体启动子还具有作为代谢调控基因开关的潜在应用价值[7].本实验室通过引入温度开关(λ 噬菌体启动子)改变原有菌株代谢途径,使发酵前期获得足够的菌体量,再通过温度调节转入后续发酵,将代谢产物D-乳酸的产量提高了66%,[8-9].
因此,本研究通过将大肠杆菌葡萄糖脱氢酶基因(gcd)的启动子替换为λ 噬菌体启动子PL-PR,引入温度诱导型转录系统,改变了酶合成表达的诱导方式;找出在此表达系统下菌株的最适生长温度及葡萄糖脱氢酶的最适表达温度.通过摇瓶发酵实验,优化了相应的发酵条件,为后续生物法发酵生产葡萄糖脱氢酶提供相关实验数据支持.
1 材料与方法
1.1菌株与质粒
本实验所使用的菌株与质粒见表1.
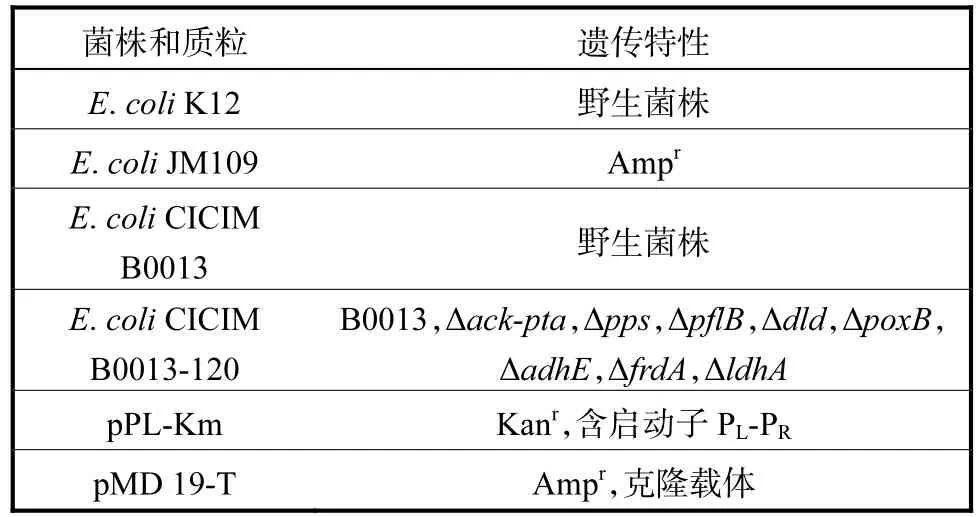
表1 菌株和质粒Tab.1 Strains and plasmids used in this study
1.2引物列表
本实验所使用的引物见表2,序列中的下划线部分为酶切位点.

表2 引物序列Tab.2 Primer sequences
1.3试剂与培养基
限制性内切酶(Pst Ⅰ、BamH Ⅰ、EcoR Ⅰ、XhoⅠ)、T4,DNA连接酶、DNA聚合酶和dNTPs均购自TaKaRa公司;其他药品和试剂均为分析纯.
LB培养基(g/L):酵母浸出物5,胰蛋白胨10,NaCl 10,用去离子水溶解并定容.1×105,Pa灭菌20,min.固体培养基加入2%,琼脂.
M9培养基(g/L):Na2HPO4·12H2O 15.113,KH2PO43,NH4,Cl 1,NaCl 1,用去离子水溶解并定容.每升 M9 液体培养基补加1,mL 1,mol/L MgSO4和1,mL微量元素母液.微量元素母液成分(g/L):FeCl3·6H2O 2.400,CoCl2·6H2O 0.300,CuCl2·2H2O 0.150,ZnCl20.300,Na2MoO4·2H2O 0.300,H3BO30.075,MnCl2·4H2O 0.495.
1.4葡萄糖脱氢酶基因gcd的扩增
根据GenBank中大肠杆菌(E.coli)K12的gcd基因序列设计两条特异性引物:Gcd-1与Gcd-2.提取E.coli K12的基因组DNA作为扩增模板,扩增葡萄糖脱氢酶基因序列.PCR反应体系(50,μL):基因组DNA 1,μL,10×buffer 5,μL,25,mmol/L dNTP 4,μL,LA Taq DNA聚合酶0.5,μL,10,mmol/L上、下游特异性引物各2,μL,ddH2O 37.5,μL.反应条件:94,℃ 5,min;94,℃ 45,s,58,℃ 45,s,72,℃ 1,min,30个循环;72,℃ 10,min.将PCR产物进行回收纯化,与线性化的pMD19-T载体连接,转化E.coli JM109感受态,涂布于含有氨苄青霉素的LB平板上,提取质粒酶切验证.
1.5重组菌株的构建
用引物pPL3和pPL4,并以质粒pPL-Km为模板,按照上述PCR体系与条件扩增得PL-PR启动子,回收纯化PCR产物并用EcoR I和EcoR V双酶切得到酶切产物(2.4,kbp).以重组质粒pMD19-T-gcd为模板,设计引物Gcd-3f和Gcd-4r,进行反向PCR,PCR产物为3.5,kbp,并用T4多聚核苷酸激酶对其产物平末端磷酸化.将PL-PR启动子序列与反向PCR产物进行连接构建重组质粒pGCd::Km-PL-PR,转化E.coli JM109,涂布于含有卡那霉素的LB平板上,提取质粒并用Pst Ⅰ酶切验证得到5.2,kbp和0.7,kbp两条条带.
用重组质粒pGCd::Km-PL-PR的质粒DNA作为模板,以Gcd-1和Gcd-2为引物,利用上述反应体系和条件(1.4部分)进行PCR扩增,扩增出pGCd::Km-PL-PR基因片段.电击转化(1,800,V,5,ms)含有辅助质粒pKD46并经2,mmol/L L-阿拉伯糖诱导的目的菌株 B0013-080C,在卡那霉素抗性平板筛选转化子.挑取阳性转化子,以D-gcd1和D-gcd2为引物,进行菌落PCR验证.
1.6重组菌株的诱导表达
分别挑取菌株B0013-120/pKD46以及重组菌株B0013-120/pGCd:Km-PL-PR的单菌落于50,mL LB培养基中,30,℃、200,r/min 培养过夜.以2%,的接种量接种于50,mL含有5,g/L葡萄糖的M9液体培养基中,以30,℃、200,r/min培养2,h后,以42,℃、200,r/min诱导培养4,h.8,000,r/min离心10,min,去除上清液,制成粗酶液,测定葡萄糖脱氢酶酶活.
1.7葡萄糖脱氢酶酶活测定[10]
D-Glucose+ox-PMS→D-glucono-5-lactone+
re-PMS
re-PMS+ox-DCIP→ox-PMS+re-DCIP氧化态的2,6-二氯靛酚(DCIP)溶液为蓝色,在600,nm处有吸光度,而还原态的DCIP溶液为无色.因此当反应进行时,蓝色会慢慢褪去,相应的A600值会逐渐减小,通过A600值的变化对酶活进行测定计算.
酶活单位(U):25,℃条件下,在1,min内能够使1,μmol的葡萄糖氧化(或1,μmol DCIP还原)的酶量.
酶活测定:50,mmol/L Tris-HCl(pH 8.0),20,mmol/L葡萄糖,0.75,mmol/L PMS,0.75,mmol/L DCIP和10,μL适当稀释的酶液.将反应试剂母液依次加入到1,cm比色皿中混合均匀,在25,℃下进行反应,开始计时,通过UV-9100型分光光度计读取记录下第1,min和3,min的A600.空白对照:50,mmol/L Tris-HCl(pH 8.0),20,mmol/L 葡萄糖,0.75,mmol/L吩嗪硫酸甲酯(PMS),0.75,mmol/L DCIP和10,μL去离子水.将反应试剂母液依次加入到1,cm比色皿中混合均匀,在25,℃下进行反应,开始计时,通过UV-9100型分光光度计读取记录下第0,min和3,min的A600.酶活按照式(1)进行计算.式中:A测定和A空白分别为600,nm下酶活测定和空白对照的吸光度;Vt为体系体积,2,mL;tmin为反应时间,3,min;Vs为加入的酶液体积,0.02,mL;df为酶液稀释倍数.

1.8诱导条件对重组葡萄糖脱氢酶表达的影响
1.8.1培养基碳源对重组葡萄糖脱氢酶表达的影响
本文选用甘油和葡萄糖两种常用碳源进行对比分析,分别挑取菌株B0013-120/pKD46以及转化子B0013-120/pGCd::Km-PL-PR的单菌落于50,mL LB液体培养基中,30,℃、200,r/min 培养过夜.以2%,的接种量接种于50,mL 分别以甘油(终质量浓度为5,g/L)和葡萄糖(终质量浓度为5,g/L)为唯一碳源的M9液体培养基中,30,℃、200,r/min 培养2,h后,以42,℃、200,r/min诱导培养4,h.8,000,r/min离心10,min收集菌体,测定葡萄糖脱氢酶酶活.
1.8.2诱导温度对葡萄糖脱氢酶表达的影响
分别将菌株B0013-120/pKD46以及重组菌株B0013-120/pGCd::Km-PL-PR按照1.8.1的培养方式进行过夜培养.以2%,的接种量接种于含有上述最佳碳源的50,mL M9 液体培养基中,30,℃、200,r/min培养至菌体密度为A600=1.0时,添加0.5%,酵母膏,分别在30、37、42,℃以及200,r/min诱导4,h后测定酶活.
1.8.3诱导前菌体密度对葡萄糖脱氢酶表达的影响
分别将菌株B0013-120/pKD46以及重组菌株B0013-120/pGCd::Km-PL-PR按照1.8.2的培养方式培养至菌体密度分别为A600=1.0、1.3、1.6、2.0时,添加0.5%,的酵母膏于最佳诱导温度下诱导4,h.收集菌体,用ddH2O清洗菌体后,收集30,mL菌体,添加约1,mL ddH2O(使每管菌体菌体密度一致)混匀并添加终浓度5,μmol/L PQQ和终浓度为1,mmol/L的Mg2+,25,℃孵育30,min,测定酶活.
1.8.4诱导时间对葡萄糖脱氢酶表达的影响
按上述最佳培养条件,分别将菌株B0013-120/pKD46以及重组菌株B0013-120/pGCd::Km-PL-PR培养至最佳菌体密度,添加0.5%,的酵母膏,分别在最佳诱导温度下诱导1、2、3、4,h.收集菌体,用ddH2O清洗菌体后,收集30,mL菌体,添加约1,mL ddH2O(使每管菌体菌体密度一致)混匀并添加5,μmol/L PQQ和终浓度为1,mmol/L的Mg2+,25,℃孵育30,min.测定酶活.
1.9葡萄糖脱氢酶酶学性质分析
1.9.1葡萄糖脱氢酶的最适反应温度
制备粗酶液并添加5,μmol/L PQQ和终浓度为1,mmol/L的Mg2+,分别于15、20、25、30、35、42、50,℃孵育30,min.测定酶活,确定其最适反应温度.
1.9.2葡萄糖脱氢酶的热稳定性
将粗酶液分别于45、50、55、60、65,℃水浴锅中进行孵育,每10,min取样1次,立即置于冰上2,min,室温恢复30,min.测定酶活.
1.9.3葡萄糖脱氢酶的最适反应pH
制备粗酶液并添加5,μmol/L PQQ和终浓度为1,mmol/L的Mg2+,于25,℃孵育30,min.分别在pH 为5.5、6.0、6.5、7.0、7.5、8.0的缓冲体系(0.2,mol/L磷酸二氢钠和0.3,mol/L磷酸氢二钠缓冲液)中测定酶活,分析其最适反应pH.
2 结果与分析
2.1重组菌株的构建
按照1.3、1.4的方法扩增出完整的gcd基因序列,经过凝胶电泳检测在0.9,kbp左右有明显条带(图1),与gcd序列大小一致.

图1 gcd基因的PCR产物Fig.1 Products of gene gcd after PCR
扩增出PL-PR启动子与卡那霉素抗性基因的序列经电泳检测,在约3.5,kbp有明显条带,大小相符.将两段序列进行连接转化至大肠杆菌感受态中,获得含有卡那霉素抗性序列的重组质粒pGCd::Km-PL-PR,PstⅠ酶切条带为0.7,kbp和5.2,kbp.以该重组质粒为模板,扩增出大小为3.2,kbp的pGCd::Km-PL-PR基因片段.将该片段电转至菌株B0013-120/pKD46的感受态细胞中,从而得到重组菌株B0013-120/pGCd::Km-PL-PR.提取该菌株的染色体,以引物D-gcd1和Gcd-2进行PCR验证,结果得到3.2,kbp的目的条带,如图2所示.

图2 重组菌株B0013-120/pGCd::Km-PL-PR的 PCR验证Fig.2 PCR verification of the recombined vector B0013-120/pGCd::Km-PL-PR
2.2重组菌的诱导表达
按照1.5的诱导方法,将得到的重组菌株B0013-120/pGCd::Km-PL-PR与原始菌株B0013-120/ pKD46转接摇瓶中进行诱导后,分别测定其酶活,发现对照菌和重组菌的酶活分别为(52±2)U/mL、(63±6)U/mL(图3).
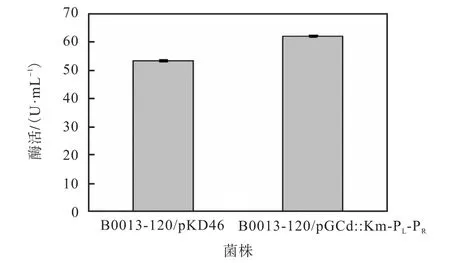
图3 重组菌的葡萄糖脱氢酶酶活Fig.3 Assay of the enzymatic activity of the engineered strains
在相同条件下,重组菌酶活力高于原始菌酶活力.这是因为重组菌株B0013-120/pGCd::Km-PL-PR使用温控开关替换了原始启动子,pPL451 具有λ噬菌体启动子PL和PR,在低温(28~30,℃)下生长时,cIts857基因表达的λ抑制物可以抑制该启动子的转录,当细胞生长至适宜菌体浓度时,进行42,℃培养可使λ抑制物快速失活.从而启动子恢复转录功能,进而表达蛋白.
2.3诱导条件对重组葡萄糖脱氢酶表达的影响
培养基中丰富的营养供给对细胞生长极为有利,使诱导前细胞密度达到一个较高值,可为温度诱导目标蛋白的高水平表达奠定良好的基础.此外,mPQQGDH作为一种膜蛋白,其表达量在一定程度上与菌体密度成正相关,因此提高菌体密度有利于膜蛋白产量的提高.M9培养基作为mPQQGDH的表达培养基,其氮源和微量元素非常丰富,但需要外源添加碳源.
分别以10%,甘油和葡萄糖作为碳源,它们对重组菌内葡萄糖脱氢酶表达的影响如图4所示.从图4可以看出,重组菌株在以甘油为碳源的培养基中葡萄糖脱氢酶的表达量较葡萄糖为碳源的培养基的高17,U/mL,表明甘油更适合作为重组菌表达的培养基碳源.
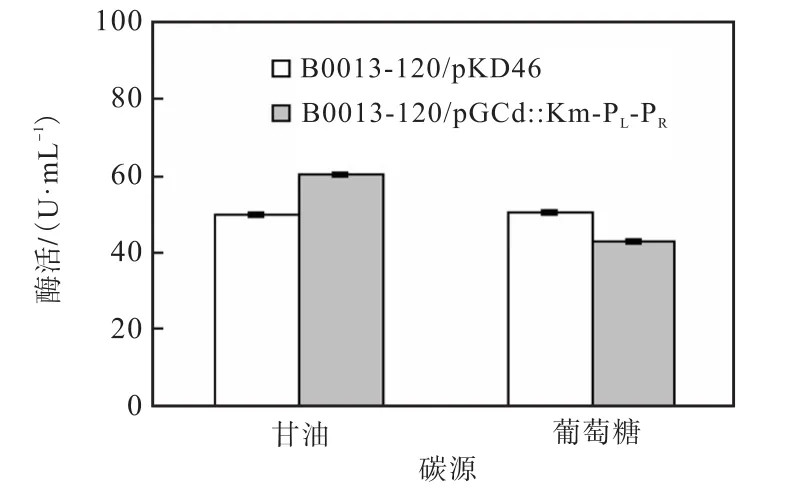
图4 碳源对葡萄糖脱氢酶酶活的影响Fig.4 Influence of carbon sources on the enzymatic activity
以10%,甘油作为碳源,分别在30、37、42,℃的条件下对重组菌和原始菌进行诱导,比较诱导温度对葡萄糖脱氢酶表达的影响,结果如图5所示.30,℃诱导时,重组菌的酶活反而低于原始菌,37,℃诱导时,重组菌与原始菌的酶活差别不大,而42,℃诱导时,重组菌酶活为60,U/mL大于原始菌的酶活47,U/mL.这说明42,℃是重组菌的最适诱导温度.
分别将原始菌和重组菌转接摇瓶培养至菌体密度分别达到A600=1.0、1.3、1.6、2.0时,在42,℃条件下进行诱导后,分别测定其酶活,结果如图6所示.由图6可知,在菌体密度为A600=1.6时,蛋白表达量最高.其原因可能是菌体密度达到一定程度时膜蛋白表达较高,但菌体密度过高的情况下,菌体老化等原因可能会对细胞有一定的毒害作用.因此,选取菌体密度为A600=1.6时进行诱导.

图5 诱导温度对酶活的影响Fig.5 Influence of induction temperature on the enzymatic activity
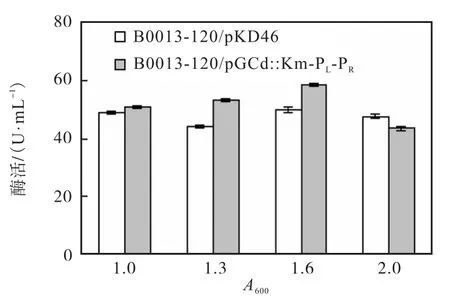
图6 诱导前菌体密度对酶活的影响Fig.6 Influence of optical density before induction on the enzymatic activity
分别将原始菌和重组菌转接摇瓶培养至菌体密度分别达到A600=1.6时,在42,℃条件下诱导1、2、3、4,h后,测定其酶活,其结果如图7所示.诱导时间为4,h时,酶活力最高.因此,选取诱导时间为4,h,以得到最高产酶量.
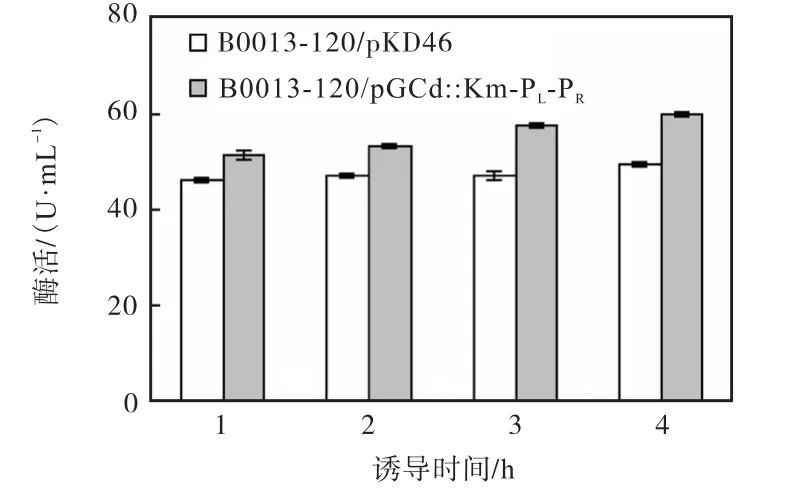
图7 诱导时间对酶活的影响Fig.7 Influence of induction time on the enzymatic activity
诱导温度以及诱导时间对重组蛋白的大量表达也有很大的影响.在升温诱导的后期,重组蛋白的大量表达和高温诱导条件下的热诱导会产生热休克蛋白(37,℃条件即可产生)[11].而这些热休克蛋白中含有许多蛋白水解酶[12],会降解部分重组蛋白,从而使得升温诱导一段时间后mPQQGDH的活性下降.持续的高温诱导和重组蛋白的大量表达除了促进包涵体形成之外,也会引起大肠杆菌的应急反应(SOS response).这种应急反应会诱导宿主菌表达Rec-A蛋白[13],它会和温度起到协同作用共同裂解cIts857阻遏蛋白,进一步促使PL-PR启动子的高效转录.经实验证明,在42,℃的温度条件下诱导4,h,能得到酶活较高的mPQQGDH.
2.4葡萄糖脱氢酶酶学性质分析
2.4.1葡萄糖脱氢酶的最适孵育温度
在不同的温度(15、20、25、30、35、42、50,℃)下测定酶活,以温度为横坐标,相对酶活为纵坐标绘制曲线,结果如图8所示.结果表明:葡萄糖脱氢酶的最适反应温度为25,℃.

图8 孵育温度对相对酶活的影响Fig.8 Influence of incubation temperature on the relative enzymatic activity
2.4.2葡萄糖脱氢酶的热稳定性
热稳定性的研究表明(图9),mPQQGDH在45,℃条件下比较稳定,而在55,℃条件下半衰期为20,min,在65,℃、20,min酶活力仅为6,U/mL,而75,℃可直接导致酶的失活.与吡咯喹啉醌型水溶性葡萄糖脱氢酶(sPQQGDH)一样,具有热稳定性差的特点.后续研究中可以采用定点突变等方法提高其热稳定性.比如,Sode等[14]利用linker将PQQGDH-B的两个亚基连起来,使该酶在55,℃孵育20,min后残留的酶活提高了1倍,达到40%,以上.
2.4.3葡萄糖脱氢酶的最适测定pH
将葡萄糖脱氢酶粗酶液分别在不同pH的缓冲体系中测定酶活,以pH为横坐标,相对酶活为纵坐标绘制曲线,结果如图10所示,葡萄糖脱氢酶的最适测定pH为6.0.

图9 酶的热稳定性Fig.9 Thermal stability of the enzyme

图10 pH对相对酶活的影响Fig.10 Influence of pH on the relative enzymatic activity
3 结 语
由于大肠杆菌具有遗传背景清楚、表达体系稳定以及大规模发酵经济等优点,常用作外源基因表达的高效宿主,也是获得外源基因稳定高效表达的较好选择.IPTG是tac启动子常用的诱导物,但其具有毒性且价格昂贵,不适用于工业化生产.本文利用温敏型启动子PL-PR替换葡萄糖脱氢酶原有的启动子,通过温度的变化对其进行诱导控制,节省了添加诱导剂的成本及步骤,使发酵过程更简便.此外,优化了摇瓶发酵条件并研究了葡萄糖脱氢酶的酶学性质,这为其工业化生产及更广泛的应用奠定了基础.
参考文献:
[1] Duine J A,Frank J,Van der Meet R. Different forms of quinoprotein aldose-(glucose-)dehydrogenase in Acinetobacter calcoaceticus[J]. Archives of Microbiology,1982,131(1):27-31.
[2] Bilen H,Kilicaslan A,Akcay G,et al. Performance of glucose dehydrogenase(GDH)based and glucose oxi-dase(GOX)based blood glucose meter systems at moderately high altitude[J]. Journal of Medical Engineering and Technology,2007,31(2):152-156.
[3] Zhang M,Mullens C,Gorski W. Coimmobilization of dehydrogenases and their cofactors in electrochemical biosensors[J]. Analytical Chemistry,2007,79(6):2446-2450.
[4] 夏江东,程在全,季鹏章,等. 高等植物启动子功能和结构研究进展[J]. 云南农业大学学报,2006,21(1):7-14.
[5] Love C A,Lilley P E,Dixon N E. Stable high-copynumber bacteriophage λ promoter vectors for overproduction of proteins in Escherichia coli[J]. Gene,1996,176(1):49-53.
[6] Makrides S C. Strategies for achieving high-level expression of genes in Escherichia coli[J]. Microbiological Reviews,1996,60(3):512-538.
[7] Ptashne M. A genetic switch:Phage [lambda] and higher organisms[M]. 2nd ed. Cambridge:Cell Press,1992:11.
[8] Tian K M,Chen X Z,Shen W,et al. High-efficiency conversion of glycerol to D-lactic acid with metabolically engineered Escherichia coli[J]. African Journal of Biotechnology,2012,11(21):4860-4867.
[9] Zhou L,Tian K M,Niu D D,et al. Improvement of D-lactate productivity in recombinant Escherichia coli by coupling production with growth[J]. Biotechnology Letters,2012,34(6):1123-1130.
[10]Koji S,Hiroyuki S. Glu742 substitution to Lys enhances the EDTA tolerance of Escherichia coli PQQ glucose dehydrogenase[J]. Biotechnology Letters,1994,16(5):455-460.
[11]Guisbert E,Yura T,Rhodius VA,et al. Convergence of molecular,modeling,and systems approaches for an understanding of the Escherichia coli heat shock response [J]. Microbiology and Molecular Biology Reviews,2008,72(3):545-554.
[12]Rosen R,Ron E Z. Proteome analysis in the study of the bacterial heat-shock response[J]. Mass Spectrometry Reviews,2002,21(4):244-265.
[13]Liveris D,Mulay V,Schwartz I. Functional properties of Borrelia burgdorferi recA[J]. Bacteriology,2004,186(8):2275-2280.
[14]Sode K,Shirahane M,Yoshida H. Construction and characterization of a linked-dimeric pyrroloquinoline quinone glucose dehydrogenase[J]. Biotechnology Letters,1999,21(8):707-710.
责任编辑:郎婧
Construction of a Recombined Bacterium for the Thermo-regulated Expression of Glucose Dehydrogenase and the Optimization of the Fermentation Process
LI Yang,ZHANG Zhimeng,DONG Zixing,WANG Zhengxiang,LU Fuping
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,National Engineering Laboratory for Industrial Enzymes,Tianjin Key Laboratory of Industrial Microbiology,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Abstract:Membrane-bound pyrroloquinoline quinine-dependent glucose dehydrogenase(mPQQGDH,EC1.1.5.2)is a significant kind of oxidoreductase,and has received considerable attention for its wide application in the fields of clinical diagnosis and industrial glucose sensors.However,the low expression level limits its mass industrial production and application scope.In this study,temperature sensitive promoter PL-PRwas used to replace the promoter of mPQQGDH,resulting in a recombined bacterium E.coli B0013-120/pGCd::Km-PL-PRwhose glucose dehydrogenase activity was 21.2%, higher than that of the original strain.Subsequently,the fermentation conditions were optimized to determine the suitable carbon source,induction temperature,optical density before induction and the induction time for the expression of mPQQGDH. Finally,by characterizing the enzymatic properties of this enzyme,the temperature and pH optima were determined to be 25,℃ and 6.0,respectively,and this enzyme was stable at 45,℃.These results can lay a solid foundation for the wider range of application and industrial production of mPQQGDH.
Key words:glucose dehydrogenase;temperature sensitive promoter;overexpression;fermentation process optimization
中图分类号:Q93
文献标志码:A
文章编号:1672-6510(2016)02-0013-07
收稿日期:2015-05-06;修回日期:2015-06-02
基金项目:国家高技术研究发展计划(863计划)资助项目(2013AA102106-07)
作者简介:李 杨(1988—),女,天津人,硕士研究生;通信作者:路福平,教授,lfp@tust.edu.cn.
DOI:10.13364/j.issn.1672-6510.20150057
