无功能性胰腺神经内分泌肿瘤17例CT影像表现
2016-06-21彭盛坤陈加源四川省医学科学院四川省人民医院放射科四川成都610072
彭盛坤,陈加源,蒋 瑾,赵 原(四川省医学科学院·四川省人民医院放射科,四川 成都 610072)
无功能性胰腺神经内分泌肿瘤17例CT影像表现
彭盛坤,陈加源,蒋 瑾,赵 原
(四川省医学科学院·四川省人民医院放射科,四川 成都 610072)
目的 探讨无功能性胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,P-NENs)的CT表现及临床特征。方法 我院经手术治疗并行病理学证实的17例P-NENs患者,分析其CT平扫及增强后的影像特点。结果 17例患者共19处病灶。病理分级:3例为G1,9例为G2,5例为G3。影像表现:平扫均呈稍低密度影,边界较清晰,除2处病灶强化不明显外,其余17处病灶均呈现延迟强化表现,其中2例病灶可见边缘包膜样强化,所有病例胰腺导管未见明显受侵。淋巴结转移:G1~G3病例均出现淋巴结转移。结论 P-NENs容易发生淋巴结转移,结合典型CT征象结合临床特征可于术前做出诊断。
CT表现;胰腺肿瘤;神经内分泌肿瘤
胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,P-NENs)是罕见的胰腺肿瘤,其发病率较低,占胰腺肿瘤的1%~2%[1,2],依据临床表现及激素水平P-NENs可分为无功能性及功能性两类,前者占75%~85%[3]。本文回顾性分析2009年10月至2015年1月本院17例经手术及穿刺病理证实的P-NENs的CT表现,提高影像诊断的准确率。
1 资料与方法
1.1 一般资料 我院经穿刺及手术病理证实的17例P-NENs患者,其中男12例,女5例,年龄38~74岁,平均年龄51.9岁。17例术前均行CT增强检查。
1.2 检查方法 CT检查采用Siemens sensation 16层螺旋CT扫描,准直15 mm,层厚8 mm,层距8 mm,螺距12,管电压120 kV,管电流180 mAs,增强采用高压注射器以团注法经肘前静脉注射威视派克80~100 ml,注射流率2.5~3 mUs,分别于25~30 s,50~60 s,2~3 min行三期(动脉期、静脉期、延迟期)增强扫描。
1.3 图像分析 由两名高年资诊断医师双盲法分别对病灶位置、病变范围、邻近周围结构、大体形态、淋巴结情况及病变强化特点进行系统评价并作出诊断。
2 结果
2.1 临床病史 17例患者均无内分泌相关性表现,8例患者因腹痛入院,其中2例伴有腹泻症状,1例患者因腰痛入院,4例患者因体检发现,并无特殊临床症状,2例患者因皮肤黄染入院。实验室检查:全部患者AFP阴性,CEA阴性,2例患者CA199增高,2例患者CA50增高,4例患者铁蛋白增高。1例患者胰高血糖素实验弱阳性。
2.2 CT表现 ①肿瘤大小及分布:本组患者共19个病灶,2例患者发现多发病灶,其余均为单发病灶;其中位于胰头8例,胰颈1例,胰体部3例,胰尾5例;病灶0.9 cm×1.0 cm~9.0 cm×5.0 cm(图1 a)。②CT增强表现:19个病灶平扫均表现为结节状或类圆形等或低密度影。强化方式:增强扫描动脉期明显强化9个病灶,中度强化6个病灶,4个病灶轻度强化,所有病灶中央低密度区域未见确切强化,其中2例病灶可见边缘包膜样强化(图1b),门脉期及延迟期除2个病灶呈强化不明显外,其余病灶均呈延迟强化(图1c,d)。③钙化灶与坏死区域分布:1例病灶内可见点状钙化灶,钙化灶密度较高,其余病例未见钙化灶。坏死:5例病灶可见片状低密度坏死区,3例坏死区域位于肿瘤中央区,2例位于周边。④淋巴结:7例病灶周围可见肿大淋巴结,5例术后证实为原发肿瘤转移灶,2例为反应性增生,转移淋巴结短径最大者约1.0 cm。④病灶周边情况:11例患者病灶边界较清晰,病变周围结构分界清楚,未见明显侵犯,2例病灶位于胰头,分别压迫临近十二指肠伴肝内胆管扩张和侵犯门脉右支并胆总管扩张,2例位于尾部的病灶分别侵犯脾动静脉和包绕腹腔干并侵及左肾上腺及胃后壁下端(图1e),1例位于胰体的病灶侵犯前方肠系膜上动静脉并与脾静脉粘连,另1例位于胰体部的病灶包绕脾动静脉(图1f),并与胃小弯横结肠部分粘连。
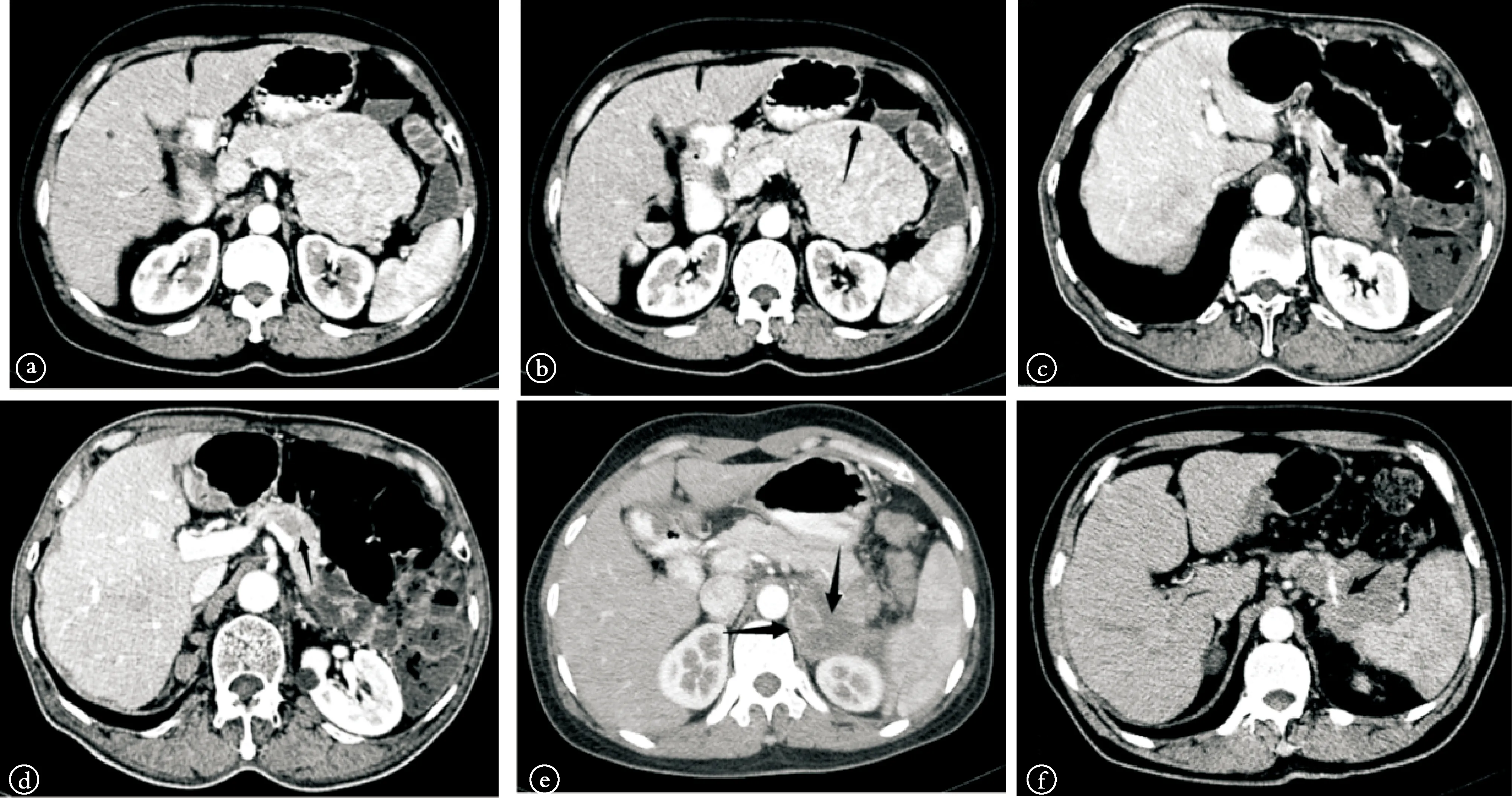
图1 胰腺内分泌肿瘤CT增强图像 a:肿块最大层面大小约10.41 cm×7.81 cm;b:箭头所在区域可见局限性包膜强化;c:肿瘤位于胰尾部;d:肿瘤位于胰体部,病灶呈延迟强化;e:肿瘤累及左侧肾上腺;f:包绕脾动脉(箭头所指为脾动脉)
2.3 病理及免疫组化
2.3.1 肿瘤分级 17例患者均行外科手术切除并行病理学检查,参照2010年消化系统肿瘤分类指南,按照Ki-67指数将胰腺内分泌肿瘤分为三类,其中3例为G1(17.6%),9例为G2(52.9%),5例为G3(29.4%);标本颜色呈灰黄色或灰红色,见表1。

表1 胰腺内分泌肿瘤分类
2.3.2 免疫组化 免疫组化染色显示突触素(Syn)阳性17例(100%),神经元特异性烯醇化酶(NSE)阳性14例(82.4%),铬粒素(CgA)阳性17例(100%)。
3 讨论
P-NENs是一种发生在胰腺的少见病变,占胰腺肿瘤的1%~2%[1,2]。美国流行病学调查显示,P-NENs发病率较过去30年相比增加了近5倍,呈现逐年上升的趋势[4]。P-NENs原称为胰岛细胞瘤、胰腺内分泌肿瘤等,依据患者临床表现及激素的分泌状态,分为功能性和无功能性两类。无功能性P-NENs占75%~85%,功能性P-NENs常见的有胰岛素瘤和胃泌素瘤。胰岛素瘤一般位于胰腺,而胃泌素瘤多见于十二指肠或胰腺[5]。按照2010年WHO消化系统肿瘤分类和命名指南[6],根据核分裂和Ki-67指数将P-NENs分为三类(G1~3),级别越高,分化程度越差,其肿瘤的恶性程度越高。本组G2类最多(9例),G1及G3分别有3、5例。4例(5枚淋巴结)出现肿瘤淋巴结转移现象的患者中,2例属于G3类,1例属于G2类,1例属于G1类。有研究发现[7],P-NENs就诊时早期转移率为12.5%,其中G2、3类的患者早期转移率接近25%,以上表现提示胰腺神经内分泌肿瘤低度恶性的倾向。病理诊断免疫组化检查中,CgA在血清及血浆中均很稳定,且与肿瘤的原发部位不相关,研究发现CgA蛋白在PENT诊断中阳性率约75%,而Syn阳性率约95%,在高级别肿瘤中CgA可能会呈现阴性结果,建议行CgA+Syn联合染色,避免漏诊[7]。手术切除是P-NENs的首选治疗手段,即便肿瘤出现转移征象,依然可以通过手术切除原发灶及淋巴结的清扫,提高患者生存率[8]。胰腺外分泌肿瘤患者的平均生存时间(3~5个月),要文青等[7]研究发现P-NENs患者5年无进展生存率约91.4%,即使发生转移,5年无进展生存率约60.0%,较外分泌肿瘤相比,P-NENs恶性程度明显较低。所以,早期诊断及治疗对患者的预后极为重要。
CT影像学检查对P-NENs检出具有重要作用。本组病灶最小者呈结节状,直径约1.0 cm;所有病例均进行了增强扫描,动脉期中度及明显强化病灶占所有病灶的78.9%,且在门脉期及延迟期呈持续性强化。CT增强扫描有助于显示病灶与周围组织结构的关系,3例位于体、尾部的病灶与邻近血管关系密切,2例位于胰头的病灶(1例位于胰头钩突处)侵犯压迫胆总管与胰管汇合处导致肝内胆管扩张,扩张的胰管管壁光滑、连续,未见中断。有学者提出包膜强化为此病变的特征性表现[9],本组中有2例呈包膜明显强化表现。所有病例中,胰腺导管未见明显受侵,可能与病例较少有关,有学者研究表明[10],P-NENs来源于胰腺胰岛细胞系,不是与导管密切相关的导管上皮细胞来源,故胰腺内分泌来源的肿瘤不会对胰管造成侵犯,当肿瘤较大时对邻近胰管产生推挤偏移正常路径而顺着肿块边缘绕行,当肿瘤较小时不会引起胰管的改变。本组病灶大小超过8 cm的患者有3例,其中2例属于G2,1例属于G3,由此推断病变越大其恶性程度的可能性越大。在5例G3类病灶中,2例病灶周围界限清晰,另外3例均有邻近组织受侵犯;9例G2类病灶中,仅1例侵犯周围组织;3例G1病灶中,2例与邻近组织分界不清,说明级别较低的肿瘤可能也有向周围组织侵犯的趋势。4例患者出现淋巴结转移,1例属于G1,1例属于G2,2例属于G3,说明低级别肿瘤同样可能发生早期转移。故术前对病灶的诊断有助于外科手术方式的选择。
P-NENs应与以下疾病进行鉴别诊断:①胰腺癌:胰腺癌预后较差,五年生存率较低,如发生转移即失去了手术的最佳机会,胰腺癌在CT上最重要的表现为:胰腺局部肿大、正常轮廓比例失调,增强后密度对比明显,静脉期肿块呈相对低密度。胰腺周围脂肪层消失,常出现“双管征”(胰管及胆管扩张)。肿块极易侵犯邻近血管,直接征象为血管受侵犯、血管内栓子形成;间接征象为侧支循环开放、脾大以及淋巴转移[11]。②胰腺导管内乳头状瘤(intraductal papillary mucinous neoplasms,IPMN):该肿瘤常常表现胰腺炎症状,IPMN在CT上主要表现为单房或多房囊性肿瘤,常伴有分隔及壁结节;增强扫描分隔及壁结节轻中度强化。IPMN薄层CT扫描显示主胰管弥漫性或节段性扩张。胰管内黏液造成密度不均与增高。乳头状肿瘤增强扫描后有强化以区别于黏液瘤。主胰管及分支胰管不同程度的扩张,磁共振胰胆管造影(MRCP)可见囊性肿瘤与明显扩张的主胰管相连且扩张主胰管内可见乳头状充盈缺损中可清晰显示病变与扩张胰管的关系,直接显示病变与扩张胰管相通有利于本病的诊断及鉴别诊断[12]。③胰腺实性假乳头状瘤:好发于青年女性。大部分病变位于胰头部,呈囊实性肿块,一般边界清晰,病灶直径较大,很少引起胰管扩张,增强扫描病灶实性成分及囊壁多明显强化,强化方式呈逐渐强化,部分病例可见纤维分隔[13]。
P-NENs是一种少见的低度恶性肿瘤,早期也有发生转移的可能,故早期诊断对治疗及愈后极为关键,CT增强扫描结合临床特点有助于与其他胰腺肿瘤进行鉴别。
[1] Klimstra DS,Arnold R,Capella C,et al.Neuroendocrine neoplasms of the pancreas.WHO Classification of Tumoum of the Digestive system[M].Lyon:IARC Press,2010:322-326.
[2] 王英伟,王叶,李杰,等.非功能性胰腺神经内分泌肿瘤的MRI检查特征[J].中华消化外科杂志,2014,13(10):768-770.
[3] Niederle MB,Haekl M,Kaserer K,et al.Gastroenteropancreatic neuroendocrine tumours:the current incidence and staging based on the WHO and European Neuroendocrine Tumour Society classification:an analysis based on prospectively collected parameters[J].Endocr Relat Cancer,2010,17(4):909-918.
[4] Yao JC,Hassan M,Phan A,et al.One hundred years after "carcinoid":epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J].J Clin Oncol,2008,26(18):3063-3072.
[5] 刘瑞,黄怡.实用胰腺病学[M].北京:人民军医出版社,2009:136.
[6] 韩序,赵婧,方圆,等.年龄对胰腺神经内分泌肿瘤患者术后生存的影响[J].中华消化外科杂志,2012,11(4):346-350.
[7] 要文青,王威亚,李甘地.64例胰腺神经内分泌肿瘤的临床病理特征[J].中华肿瘤杂志,2014,36(4):287-293.
[8] 郑楷炼,彭智勇,胡先贵,等.胰腺神经内分泌癌60例临床病理特征及外科治疗策略[J].中华肝胆外科杂志,2014,20(1):32-34.
[9] 史玉振,王中秋,卢光明,等.胰腺神经内分泌肿瘤的影像学表现与临床病理对照分析[J].临床放射学杂志,2011,30(11):1618-1623.
[10]肖波.主胰管绕道征——胰腺神经内分泌肿瘤的一个重要MRI征象[J].磁共振成像,2015,6(3):194-198.
[11]王中秋,杨斌,吴江,等.胰腺癌和炎性胰腺肿块的各种CT征象探讨[J].中华放射学杂志,2009,43(6):621-624.
[12]边云,李骁,陈炜,等.CT和MRI对主胰管型胰腺导管内乳头状黏液瘤良恶性鉴别的价值[J].中华胰腺病杂志,2015,15(3):182-186.
[13]李阔,盛伟伟,周建,等.CT对胰腺实性假乳头状瘤的临床诊断价值:26例病例报告[J].中国医科大学学报,2015,44(4):375-378.
CT imaging characteristics of 17 patients with nonfunctioning pancreatic neuroendocrine neoplasm
PENGSheng-kun,CHENJia-yuan,JIANGJin,ZHAO-Yuan
(DepartmentofRadiology,SichuanAcademyofMedicalSciences&SichuanProvincialPeople’sHospital,Chengdu610072,China)
Objective To explore the CT characteristics and clinical features of nonfunctioning pancreatic neuroendocrine neoplasm (P-NENs).Methods The image of CT scan and enhanced features of 17 P-NENs patients treated and confirmed in our hospital were analyzed.Results There were total 19 lesions in these 17 patients.There were 3 cases with G1 (pathological grading),9 with G2 and 5 with G3.CT features analysis showed that most of the lesions demonstrated low-density with clear boundary.Enhanced signal in all the lesions was detected in the delayed phase except two cases which had peri-lesional enhancing rim.All of the main pancreatic ducts were not invented.All cases had lymph node metastasis regardless of pathological grading.Conclusion P-NENs is prone to lymph node metastasis.Combination of CT findings with clinical features can be used as preoperative diagnosis.
Computed tomography;Pancreatic neoplasm;Neuroendocrine neoplasm
R814.42
A
1672-6170(2016)06-0093-03
2016-01-09;
2016-06-24)
