聚乙烯醇-海藻酸钠-活性炭固定化大肠杆菌在不同水体中的毒性检测
2016-06-20徐颖超常晓杰
徐颖超, 刘 畅, 常晓杰
(锦州医科大学 药学院, 辽宁 锦州 121000)
聚乙烯醇-海藻酸钠-活性炭固定化大肠杆菌在不同水体中的毒性检测
徐颖超, 刘畅*, 常晓杰
(锦州医科大学 药学院, 辽宁 锦州 121000)
摘要:为构建以铁氰化钾为探针的电化学用于化学品的毒性检测方法,初步探讨了聚乙烯醇(PVA)与添加剂海藻酸钠(SA)、活性炭(AC)共固定包埋大肠杆菌(E.coli)的活性微生物颗粒在实验室废水、毒物3,5-二氯苯酚(DCP)、杀虫剂乙嘧酚以及除草剂五氰磺草胺的水样毒性分析中的应用性能。结果表明:添加剂SA和AC的质量分数均为1%,交联剂CaCl2的质量分数为2%为本研究最优实验条件,此时所测毒物对微生物固定化颗粒的呼吸抑制作用依次为DCP>乙嘧酚>五氰磺草胺>实验室废水,抑制率分别是30.23%~55.35%、25.14%~46.23%、20.12%~38.33%和5.74%~27.89%,抑制率和灵敏度均明显优于仅由PVA-SA单独固定包埋的大肠杆菌颗粒。
关键词:添加剂; 微生物固定化; 电化学; 毒性检测
聚乙烯醇(PVA)是一种无色无毒、生物相容性好、抗微生物降解能力强、化学性能稳定且力学性能优良的合成高分子聚合物,具有很好的成膜性,被认为是最有效的固定化载体之一[1-5]。海藻酸钠(SA)是一种天然多糖,具有很好的稳定性和黏性,且价格低廉,广泛应用于固定活细胞和敏感细胞[6-11]。PVA中添加SA可以避免固定化颗粒制备过程中的粘连现象,改善PVA的成球性[12-16]。
目前,PVA-SA固定微生物技术已被广泛应用于废水处理领域,如去除废水中氨氮、重金属及水体富营养化等方面[13,17-22]。然而,PVA-SA固定化存在着机械强度较低、颗粒易破裂及微生物活性降低不利于长期使用等缺点[23-26]。因此,为了提高微生物活性和共混颗粒的机械强度,本研究尝试同时混合PVA、SA与活性炭(AC)制备PVA-SA-AC共混颗粒,以改善PVA-SA固定化载体的缺陷,制备出更加优良的共混颗粒应用于工农业的废水处理。
根据前期实验,电化学结合铁氰化钾探针可有效应用于化学品的毒性检测[27-28]。以此为基础,本文通过监测铁氰化钾还原产物量的变化,考察共混微生物颗粒的呼吸作用强度,从而对共混颗粒中的添加剂含量和交联剂CaCl2含量进行择优筛选,寻找最优包埋条件。进而研究在最优条件下共混颗粒的菌种活性、机械强度及膨胀性,最终将其用于不同毒物的毒性检测,并监测其保存周期内对毒物灵敏度的变化。
1 材料与方法
1.1 实验材料
菌种:大肠杆菌从辽宁医学院附属第一医院采集,纯化后用体积分数15%的甘油于-20 ℃冷冻保存。
LB培养基:酵母粉质量浓度为5 g/L,NaCl质量浓度为10 g/L,蛋白胨质量浓度为10 g/L,调节pH值为7.0,于120 ℃下灭菌20 min后备用。
磷酸缓冲溶液(PBS):KH2PO40.08 mol/L,Na2HPO40.12 mol/L,于120 ℃下灭菌20 min后备用。
葡萄糖-谷氨酸(GGA)标准溶液:葡萄糖质量浓度为150 mg/L,谷氨酸质量浓度为150 mg/L。
铁氰化钾母液的量浓度为0.33 mol/L。
3,5二氯苯酚(DCP)、乙嘧酚和五氰磺草胺母液质量浓度均为100 mg/L。
铁氰化钾和标准GGA溶液均为使用当天配制。AC和SA为化学纯,除蛋白胨和酵母提取物外的其他试剂均为分析纯。
1.2 实验仪器
CHI832C电化学分析仪,上海辰华仪器有限公司;KYC-100B空气恒温摇床,上海福玛实验室设备有限公司;721可见分光光度计,上海欣茂仪器有限公司;TG16-WS台式高速离心机,湖南湘仪实验室仪器开发有限公司;数显恒温水浴锅 HH-4,常州国华电器有限公司。
1.3 实验方法
1.3.1 菌种处理方法 取200 μL大肠杆菌(Escherichcoli,E.coli)菌种接入330 mL的LB培养基中,于恒温摇床中培养14 h(37 ℃,120 r/min),平行培养2份。将培养后的菌液在4 000 r/min下离心10 min,弃去上层培养基,菌体沉淀用PBS洗涤2次后,悬浮于20 mL PBS中。采用721可见分光光度计检测菌悬液的光密度值(OD600),检测波长为600 nm,并将其调节为10.0后,放于4 ℃冰箱中备用。
1.3.2 固定化微生物颗粒制备将聚乙烯醇与一定量的SA和AC充分热融,冷却后与上述处理后的菌种均匀混合,保持总体积为10 mL,聚乙烯醇的终浓度为10 g/L,细菌OD600=10.0。随后将混合液用针管注射器滴入到含一定量CaCl2的100 mL饱和H3BO3溶液(pH值为6.7)中,并不断搅拌,形成固定化颗粒(平均直径约1.5 mm)。于4 ℃冰箱内,固定微生物的复合胶粒在CaCl2-H3BO3溶液中交联24 h后,滤出凝胶颗粒,采用PBS洗涤后备用。
1.3.3 分析方法将固定化微生物颗粒放于已通入高纯氮20 min的K3Fe(CN)6和GGA的混合培养液中,并保证混合培养液的总体积为10.0 mL,混合后悬液中的K3Fe(CN)6为45 mmol/L,GGA 为220 mg/L,3,5-二氯苯酚(3,5-Dichlorophenol,DCP)、乙嘧酚和五氰磺草胺的浓度范围均为0~5 mg/L,实验室废水体积为0.1~0.5 mL。37 ℃水浴通氮培养1 h后,取1 mL悬液(每份样品平行取3份)于8 000 r/min离心3 min,结束反应。其中,固定化微生物活性检测时,混合培养液中毒物的质量浓度为0 mg/L。
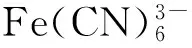

(1)
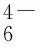
毒物毒性大小用毒物对微生物的抑制率表示,如式(2)所示
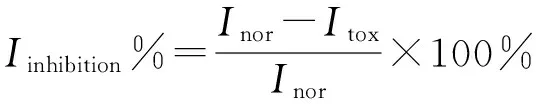
(2)
其中:Inor为正常微生物进行新陈代谢的极限电流强度;Itox为加入毒物后微生物进行新陈代谢的极限电流强度;Iinhibition为毒物对固定化微生物颗粒的抑制率。
1.4 实验内容
1.4.1 添加剂及交联剂用量对固定化微生物活性的影响分别选取海藻酸钠(质量分数为0.5%、1.0%、1.5%)及活性炭(质量分数为0.5%、1.0%、1.5%)与质量浓度10 g/L的聚乙烯醇混合包埋的固定化颗粒各3颗,于不含毒物的铁氰化钾和GGA的混合培养液中通氮保温培养1 h后,采用电化学方法检测添加剂与交联剂的使用量对E.coli活性影响。正交试验设计如下。
实验条件:海藻酸钠的质量分数为A(%),活性炭的质量分数为B(%),交联剂的质量分数C(%),以电流比值为主要评价指标,各因素的取值范围及其水平设计如表1所示。
1.4.2 添加剂对固定化微生物颗粒活性的影响随机取固定化微生物颗粒30颗,放入培养皿中4 ℃真空冷藏保存,备用。每隔5天各选取固定化颗粒3颗,进行检测。用计时电流法检测相同时段固定化微生物颗粒的生物活性。将各极限电流代入公式(1),并绘制出活性随存贮周期变化曲线。
1.4.3 固定化微生物颗粒的机械强度将所得的最优条件下的30颗PVA-SA-AC包埋的微生物颗粒放入含100 mL PBS的反应器内,在25 ℃,120 r/min磁力搅拌器下均匀搅拌,记录1~12 h内固定化颗粒完好的个数占颗粒总数的比率以表示其机械稳定性。
1.4.4 固定化微生物颗粒的膨胀性随机取30颗固定化微生物颗粒,分别用游标卡尺测定每颗颗粒的直径;随后将其放入250 mL含100 mL PBS的锥形瓶中4 ℃冷藏,用游标卡尺记录1~5 h存储时间内颗粒直径的变化;根据颗粒在不同时间的平均溶胀直径与初始颗粒的平均直径之比来表示颗粒的膨胀性能。
1.4.5 固定化微生物颗粒在不同水体中的毒性检测实验选取了毒物DCP、杀虫剂乙嘧酚、除草剂五氰磺草胺和实验室废水作为研究对象,用计时电流法考察优化后的固定化微生物颗粒对上述毒物的响应,并与只含有10 mg/LPVA-1% SA固定化E.coli的颗粒作对比。分别选取PVA-SA-AC或PVA-SA固定E.coli颗粒投入已通氮20 min的培养液中。培养液成分包括:45 mmol/L铁氰化钾,220 mg/L GGA及不同浓度的有机毒物或实验室废水,其中DCP、乙嘧酚和五氰磺草胺的浓度范围均为1~5 mg/L,实验室废水的体积添加量为0.1~0.5 mL。继续通氮恒温(37 ℃)培养1 h后,离心结束反应并检测各样品的极限电流,记为Itox。在相同培养条件下,固定化微生物颗粒在不含毒物的培养液中反应1 h后,检测得电流记为Inor。将所得电流值带入公式(2),以抑制率为纵坐标,毒物浓度为横坐标,绘制曲线。
2 结果与讨论
2.1 添加剂及交联剂用量对固定化微生物
活性的影响
实验结果如表2所示。交联剂浓度过小时,交联不完全,颗粒强度弹性差;交联剂浓度过大,会降低小球的传质性能,因此选择2%的CaCl2最为合适。而海藻酸钠和活性炭浓度均为1%时达到最好的固定条件,低于或高于此浓度水平,都会影响微生物的活性。
分析结果显示,各因素对两种固定方法的影响顺序均依次为:A—B—C,即海藻酸钠质量分数>活性炭质量分数>CaCl2质量分数。得到的实验理论最优组合为A2B2C2,即海藻酸钠和活性炭质量分数均为1%,CaCl2质量分数为2%。对其进行验证,得其活性比为7.47,效果较其他实验组合都好,故此配比将继续应用于后续实验制备固定化微生物颗粒。
2.2 固定化微生物颗粒的活性
添加剂和交联剂含量影响微生物活性,进而影响其存储周期。图1中曲线a和b分别表示由10 mg/LPVA -1%SA-1%AC及10 mg/LPVA-1% SA包埋的固定化微生物颗粒的活性随时间变化趋势。由图可知,PVA-SA-AC包埋微生物颗粒的初始活性比为7.47,经50 d后菌活性仍达55.29%,80 d后活性下降为19.54%;PVA-SA包埋微生物颗粒的初始活性比为6.95,50 d后菌活性为52.23%, 80 d后活性仅为0.14%。可见,添加了AC后固定化颗粒的传质能力增强,微生物与外界有机物和PBS等有利生长因素接触更加充分,因此可有效地延长菌体活性,增加颗粒储藏时间。此外,AC表面有大量含氧官能团,例如羧基、内酯基和酚羟基等,这次官能团经常应用于修饰生物电极,以提供更好的生物相容性。
固定化微生物颗粒的机械强度随时间的变化如图2所示,30 min之内固定化颗粒机械强度随时间变化均匀降低。随着时间增加,固定化颗粒的机械强度急速下降,原因可能是固定化微生物颗粒在测定过程中吸水使得颗粒逐渐膨胀,导致微生物颗粒的机械强度迅速下降。
2.4 固定化微生物颗粒的膨胀性能
颗粒经过活化后开始出现水溶膨胀现象,这主要是因为PVA与H3BO3进行反应形成凝胶时,硼酸上的3个羟基只部分地进行了反应,尚未完全反应的羟基基团与水形成氢键,使凝胶颗粒发生水溶膨胀的现象。图3为由10 mg/LPVA-1%SA-1%AC包埋的微生物颗粒的膨胀性(a线)与仅由10 mg/LPVA-1% SA 包埋的微生物颗粒的膨胀性(b线)的比较。由图可知,0~1 h之间a线上升速度明显快于b线,1 h时PVA-SA-AC及PVA-SA包埋的固定化微生物颗粒的水溶膨胀系数分别增加了55%和40%,其原因可能是,AC可以使原本结构紧密的颗粒变得相对疏松,易在水中膨胀。随着时间的增加,1~5 h之间a线上升速度逐渐慢于b线,5 h后相应的膨胀系数分别增加了30%和31.25%。可见添加AC后更有利于长期的固定化颗粒中微生物活性的保存。
选定优化微生物固定颗粒,即10 g/L的PVA、1%的SA以及1%的AC共混包埋E.coli,建立微生物电化学传感平台,分别应用于实验室采集的水样、毒物DCP、农药乙嘧酚和除草剂五氰磺草胺的毒性检测,并以仅由10 g/L的PVA与1%的SA共混固定包埋的E.coli颗粒作为对照,结果如图4所示:A、B、C和D分别为水样、DCP、乙嘧酚和五氰磺草胺对固定化微生物颗粒的抑制曲线;曲线a和b分代表毒物对PVA-SA-AC固定的E.coli颗粒及PVA-SA固定的E.coli颗粒的抑制作用。
图4A中水样对优化的固定微生物颗粒的作用随水样添加体积的增加而增加,其抑制率为5.74%~27.89%;而相同条件下,对照颗粒的抑制率仅为3.27%~17.78%。图4B中,DCP的浓度为1~5 mg/L时对优化的固定微生物颗粒的抑制率为30.23%~55.35%;相同条件下的DCP对对照颗粒的抑制率为18.21%~48.32%。图4C为1~5 mg/L乙嘧酚对E.coli的抑制率,其中优化颗粒被抑制为25.14%~46.23%,相应的对照颗粒的被抑制为20.12%~38.33%。图4D是1~5 mg/L五氰磺草胺对优化颗粒的抑制率为23.11%~45.15%;同样浓度范围内对对照颗粒的抑制率为19.32%~32.54%。结果显示,所测毒物对E.coli的呼吸抑制作用大小顺序为DCP>乙嘧酚>五氰磺草胺>实验室废水;经优化包埋的固定化颗粒对毒性的灵敏度明显高于对照微生物颗粒,主要是因为AC建立的疏松结构在有利于营养物质传输的同时,也加强了毒物与固定微生物的接触,使其更加敏感。
3 结论
本文采用PVA-SA-AC掺杂胶体对E.coli进行包埋,形成固定化微生物颗粒。通过计时电流法对固定微生物的活性变化进行监测,检测其对各种毒物的灵敏度;通过浸泡和机械搅拌考察固定化颗粒的膨胀性能和机械强度。结果表明,添加剂SA、AC以及交联剂CaCl2的浓度对所固定的微生物颗粒活性、机械强度及膨胀性能均有一定影响。其中添加剂SA与AC的最优质量分数均为1%,交联剂CaCl2的质量分数为2%。经优化的固定化微生物颗粒储存80 d后活性仍可达19.54%,且其机械强度及膨胀性能均有所改善。相对于PVA-SA包埋E.coli颗粒,PVA-SA-AC固定化微生物颗粒对测试毒物具有更好的灵敏度,毒物毒性顺序为DCP>乙嘧酚>五氰磺草胺>实验室废水。可见,经优化的PVA-SA-AC固定化方法可有效提高固定化颗粒的物理性能和对毒物的灵敏度,延长被固定菌株的活性,因此在水质毒性检测领域具有良好的应用前景。
参考文献:
[1] HUANG Z Z, CHEN G Q,ZENG G M, et al.Polyvinyl alcohol-immobilized phanerochaete chrysosporiumand its application in the bioremediation of composite-polluted wastewater[J].Journal of Hazardous Materials,2015, 289:174-183.
[2] 王杏佳,徐丽,高静,等.PVA固定化微生物凝胶小球的制备及性能研究[J].塑料工业,2014,42(2): 89-92.
[3] 张永栋,汪龙眠,张毅敏,等.聚乙烯醇凝胶包埋固定化细菌联合植物的除氮研究[J].生态与农村环境报,2014,30(6):744-748.
[4] 陈朝琼,廖银章,李旭东. 固定化高效降解菌处理废水的研究[J].水处理技术,2011,37(2):77-80.
[5] 姜立春,阮期平,王晓丽.固定化Corybacterium sp. JYO3降解苯酚的特性研究[J].环境工程,2014,32(2):36-40.
[6] DARAH I, NISHA M, LIM S H. Polygalacturonase production by calcium alginate immobilized enterobacter aerogenes NBO2cells[J]. Applied Biochemistry & Biotechnology,2015, 175:2629-2636.
[7] 董锐,孙晓斌,孙建勋,等.海藻酸钠杂化膜的制备及性能研究[J].化工新型材料,2014,42(1):65-70.
[8] 甄静,王继雯,李冠杰,等.海藻酸钠固定化包埋对枯草芽孢杆菌有机磷降解效果的影响[J].中国农学报,2014,30(18):84-88.
[9] 孙亚东,韩小萌,吴志伟,等.金属离子对海藻酸钠在固体表面的吸附性能影响研究[J].水处理技术,2015,41(4):45-49.
[10] 翟晓萌,李道棠.海藻酸钠固定化包埋微生物处理有机微污染源水[J].环境科学,2000,21(6):80-84.
[11] 张静进,刘云国,张薇,等.海藻酸钠包埋活性炭与细菌的条件优化及其对Pb2+的吸附特征研究[J].环境科学,2010,31(11):2684-2690.
[12] 杨旭俊,蔡冠竟,郑伟,等.固定化微生物技术在受污养殖水体和水华水域生物修复中的应用[J].微生物学通报,2015,42(4):712-720.
[13] 贲月,陈一明,刘云国,等.聚乙烯醇-海藻酸钠固定铜绿微囊藻对磷的吸附[J].环境工程学报,2013,7(7):2563-2568.
[14] 何立芳,邱如斌,张夏红,等.海藻酸钠/聚乙烯醇共混膜制备及对离子吸附性能[J].环境科学与技术,2010,33(1):48-51.
[15] 冯超阳,崔园园,康晓梅,等.PVA-SA复合微球的制备及性能研究[J].化学工业与工程,2010,27(5):381-386.
[16] 王孝华,聂明. 聚乙烯醇-海藻酸钙的制备[J].化学工业与工程,2005,22(3):187-191.
[17] 秦胜东,郭嘉昒,刘玉存,等.固定化微生物技术研究进展及其在水处理中的应用[J].水处理技术,2014,40(10):6-11.
[18] 胡俊. 固定化微球菌降解废水中邻苯二甲酸酯的研究[D]. 北京:中国地质大学水资源与环境学院, 2014.
[19] 李中华,尹华,叶锦韶,等.固定化菌体吸附矿山废水中重金属的研究[J].环境科学学报,2007,27(8):1245-1249.[20] 刘少敏,储磊,朱敬林.固定化硝化细菌去除生活污水中的氨氮[J].环境工程学报,2014,8(10):4261-4266.
[21] 王里奥,崔志强,袁辉,等.固定化微生物处理甲醇废水的包埋条件优化选择[J].重庆大学学报(自然科学版),2005,28(6):113-117.
[22] 胡金星,苏晓梅,韩慧波,等.固定化微生物技术修复多氯联苯污染土壤的应用前景[J].应用生态学报,2014,25(6):1806-1814.
[23] 王家东,贾淑丽,王荣荣,等.活性炭覆聚乙烯醇-海藻酸钠膜固定化糖化酶的研究[J].酿酒,2014,41(5):57-61.
[24] LI F, MAO W J, LI X, et al. Characterization of microcystis aeruginosa immobilized in complex of PVA and sodium alginate and its application on phosphorous removal in wastewater[J].Journal of Chentral South University of Technology,2015, 22(1):95-102.
[25] 李婷,任源,韦朝海,等.固定化Lysinibacillus cresolivorans的PVA-SA-PHB-AC 复合载体制备及间甲酚的降解[J].环境科学,2013,34(7):2899-2905.
[26] 张秀华,张著森,周云龙,等.PVA/SA/TiO2复合膜的制备及其对甲基橙的降解性能[J].广州化工,2014,42(10):101-126.
[27] CHANG L. Direct toxicity assessment of toxic chemicals with electrochemical method[J]. Analytica Chimica Acta,2009, 641(1/2): 59-63.
[28] 刘畅. 基于铁氰化钾的微生物传感技术的研究[D]. 沈阳:东北大学理学院, 2009.
〔责任编辑王勇〕
Application of polyvinyl alcohol-alginate-activated carbon immobilizedE.coliin testing toxicity of different wastewater
XU Yingchao, LIU Chang*, CHANG Xiaojie
(College of Pharmacy,Jinzhou Medical University,Jinzhou 121000,Liaoning, China)
Abstract:To construct electrochemical detection toxicity of chemicals in water using ferricyanide as a probe, the toxicity of chemicals in different wastewater including laboratory wastewater, and poison of 3,5-dichlorophenol (DCP), pesticide ethirimol, herbicide five cyanide alachlor were determined by polyvinyl alcohol-alginate-activated carbon immobilizedE.coli. The following optimal experimental conditions were obtained.The quality score of sodium alginate and activated carbon additive are 1%, amount of cross-linking agent CaCl2is 2%. The order in the respiratory depression effect of toxicants on the microorganisms immobilized on particle are as following, DCP > ethirimol > five cyanide alachlor > laboratory waste, inhibition rate range of 30.23%~55.35%, 25.14%~46.23%, 20.12 %~38.33%~27.89% and 5.74%, respectively, and the sensitivity was significantly better than that treated by the PVA-SA immobilizedE.coli.Keywords: addition agent; immobilized microorganism; electrochemistry; toxicity testing
文章编号:1672-4291(2016)03-0085-06
doi:10.15983/j.cnki.jsnu.2016.03.335
收稿日期:2015-06-25
基金项目:辽宁省自然科学基金(2014022037); 辽宁医学院博士启动基金(Y2012B006)
*通信作者:刘畅,女,副教授,博士。E-mail:liuchang_198006@163.com
中图分类号:X522
文献标志码:A
