杭白菊压制前后品质和稳定性比较研究
2016-06-20贺小青
贺小青
台州市中医院,浙江 台州 317700
杭白菊压制前后品质和稳定性比较研究
贺小青
台州市中医院,浙江 台州 317700
[摘要]目的研究杭白菊压缩前后品质的变化和稳定性。方法通过性状、水分、薄层色谱、有效成分含量比较传统饮片和压缩饮片的稳定性及品质差异。结果杭白菊压缩前后,性状、水分、浸出物、薄层色谱和指标性成分含量无明显变化;压缩饮片比传统饮片稳定性好。结论压缩饮片适合花类药材生产及推广。
[关键词]杭白菊;压缩饮片;品质;稳定性
0引言
杭白菊为菊花的一个中药品种,是我国的传统中药之一,已有2 000多年的应用历史。2002年列入我国卫生部公布的既是食品又是药品的物品之一。其性味甘、苦、微寒,归肺肝经,菊花具有疏风、清热解毒、平肝明目、消疲怡神之功效[1]。杭白菊化学成分比较复杂,其中黄酮类[2]、挥发油[3-4]、绿原酸[5]、木犀草苷[6]和3,5-O-二咖啡酰基奎宁酸[6]是其主要有效成分,另外,杭白菊中含有维生素A、B、C、E等,还含有17种氨基酸,其中8种为人体必需氨基酸[7]。经临床药理研究杭白菊具有抗菌[4]、抗炎、抗自由基、抗氧化[8-9]、舒血管[10]、降血脂、增强毛细血管抵抗力、抗肿瘤[11]、驱铅等作用。
目前,杭白菊的医药处方及日常食用量比较大,但其质地疏松、体积庞大,难以储存及包装,在储存过程中占用较大的空间,其易受环境的影响而使品质发生变化。为改进生产储存的方便性及药材品质的稳定性,本试验选取花类药材杭白菊为实验对象,进行定量压制成为定量压缩饮片,比较传统饮片和压缩饮片在压制前后及储存过程中相关性状、鉴别、有效成分含量的差异。
1仪器与试药
1.1仪器戴安U3000高效液相色谱仪(美国赛默飞世尔科技有限公司);智能压制机;电热恒温鼓风干燥箱(上海一恒科技有限公司);薄层扫描色谱仪(瑞士卡玛公司);数显电子恒温水浴锅(天津泰斯特仪器有限公司);高速台式离心机(上海安亭仪器厂);电子分析天平(梅特勒AL-204);Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm)色谱柱。
1.2试药杭白菊(批号:20130501,产地:浙江),购自温州华宇中药饮片有限公司;绿原酸对照品(批号:110753-200413),木犀草苷对照品(批号:111720-200905,含量94.0%),3,5-O-二咖啡酰基奎宁酸对照品(批号:111782-201204,含量:94.2%),均购自中国药品生物制品检定所;甲醇、乙醇、甲酸、磷酸、乙酸乙酯、冰醋酸、甲苯为分析纯;液相用甲醇、乙腈为色谱纯;水为娃哈哈纯净水。
2方法与结果
2.1压缩饮片的制备选取杭白菊传统饮片,定量称取于智能压制机的压制模具中,设置智能压制机压制参数,压力为30 t,压制时间5~20 s,压制成型,包装保存,供实验用。
2.2性状比较杭白菊呈蝶形或扁球形,直径2.5~4 cm,常数个相连成片。舌状花类白色或黄色,平展或微折叠,彼此粘连,通常无腺点;管状花多数,外露。压缩饮片散开后以上性状特点在压缩饮片均可见,叶花未见破碎,并且压缩饮片断面压制紧实,层状,储存体积大大减小。
2.3煮散时间取杭白菊压缩饮片,单个,置20倍量水中,静置浸泡30 min后进行煎煮,记录煎液开始沸腾至本品全部散开所需时间,饮片在5 min内全部散开,结果煮散时间符合要求。
2.4薄层鉴别取本品1.0 g,剪碎,加石油醚(30~60 ℃)20 mL,超声处理10 min,弃去石油醚,药渣挥干,加稀盐酸1 mL与乙酸乙酯50 mL,超声处理30 min,滤过,滤液蒸干,残渣加甲醇2 mL使溶解,作为供试品溶液。取菊花对照药材1 g,同法制成对照药材溶液。取绿原酸对照品,加乙醇制成每1 mL含0.5 mg的对照品溶液。照薄层色谱法[1],吸取上述3种溶液各0.5~1 μL,分别点于同一聚酰胺薄膜上,以甲苯-乙酸乙酯-甲酸-冰醋酸-水(1∶15∶1∶1∶20)的上层溶液为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的荧光斑点。杭白菊传统饮片和压缩饮片无差别。
2.5水分测定取0、3、6、9、12、18个月的杭白菊传统饮片与压缩饮片,照水分测定方法[1]测定杭白菊传统饮片和压缩饮片的水分含量,见表1。
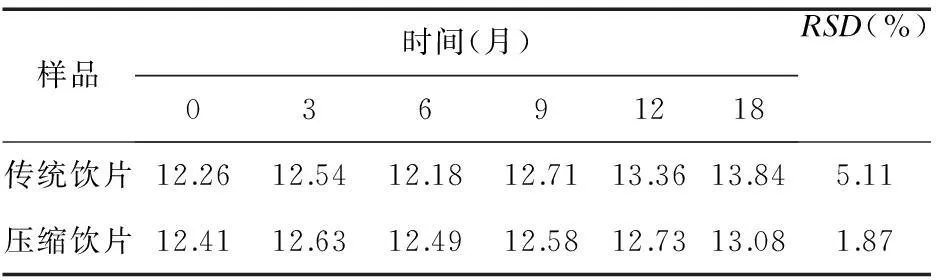
表1 杭白菊传统饮片和压缩饮片水分含量比较(%)
由表1结果可知,同一批杭白菊药材,在压缩之后,水分含量无明显变化;在18个月储存期内,传统饮片和压缩饮片水分含量都略有增加,但压缩饮片相较于传统饮片更加稳定,故从水分方面分析,压缩饮片优于传统饮片。
2.6菊花含量测定[1,5-6]
2.6.1色谱条件以Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm)为色谱柱。以乙腈为流动相A,以0.1%磷酸溶液为流动相B,按如下比例进行梯度洗脱:0~11 min,10%~18% A;11~30 min,18%~20% A;30~40 min,20%~80% A。检测波长为348 nm。菊花对照品和杭白菊样品色谱图如图1所示。

图1 菊花对照品及杭白菊样品色谱图
2.6.2对照品溶液的制备精密称取绿原酸对照品3.42 mg、木犀草苷对照品3.24 mg、3,5-O-二咖啡酰基奎宁酸对照品4.14 mg,分别置于10 mL容量瓶中,加70%甲醇至刻度,摇匀,制成储备液。据下述实验要求,将对照品溶液稀释,浓度分别为:绿原酸114.0、68.4、34.2、17.1、13.7 μg/mL,木犀草苷101.5、60.9、30.5、15.2、12.2 μg/mL,3,5-O-二咖啡酰基奎宁酸对照品130.0、78.0、39.0、19.5、15.6 μg/mL。
2.6.3供试品溶液的制备取本品粉末(过一号筛)约0.25 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇25 mL,密塞,称定重量,超声处理(功率300 W,频率45 kHz)40 min,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.6.4线性关系考察精密取浓度分别为114.0、68.4、34.2、17.1、13.7 μg/mL的绿原酸对照品溶液,101.5、60.9、30.5、15.2、12.2 μg/mL的木犀草苷对照品溶液,130.0、78.0、39.0、19.5、15.6 μg/mL的3,5-O-二咖啡酰基奎宁酸对照品溶液各10 μL,注入高效液相色谱仪,以进样量(μg/mL)为横坐标,测定峰面积为纵坐标,作标准曲线。并以最小二乘法计算得回归方程:绿原酸Y=0.159 6 X+0.101 8,R2=0.999 8;木犀草苷Y=0.250 9 X-0.216 0,R2=0.999 7;3,5-O-二咖啡酰基奎宁酸Y=0.185 4 X-0.148 7,R2=0.999 7。结果显示,绿原酸在线性范围13.7~114.0 μg/mL、木犀草苷在线性范围12.2~101.5 μg/mL、3,5-O-二咖啡酰基奎宁酸在线性范围15.6~130.0 μg/mL内有良好的线性关系,符合试验要求。
2.6.5精密度考察取对照品溶液绿原酸68.4 μg/mL、木犀草苷60.9 μg/mL、3,5-O-二咖啡酰基奎宁酸78.0 μg/mL,按以上色谱条件,重复进样6次,测定峰面积,计算RSD值结果显示,绿原酸的RSD为0.59%,木犀草苷为1.06%,3,5-O-二咖啡酰基奎宁酸为0.94%,表明仪器精密度符合试验要求。
2.6.6准确度考察精密称取已知含量菊花粉末6份,每份约0.25 g,吸取绿原酸、木犀草苷、3,5-O-二咖啡酰基奎宁酸对照品溶液适量,按“2.6.3”项下的方法进行提取制备,对照品溶液和供试品溶液各进样10 μL,测得峰面积并计算含量,得绿原酸平均回收率为99.05%、RSD=1.73%,木犀草苷为98.74%、RSD=1.32%,3,5-O-二咖啡酰基奎宁酸为101.35%、RSD=1.91%,结果表明,准确度符合试验要求。
2.6.7稳定性考察称取菊花粉末约0.25 g,按“2.6.3”项下的方法进行提取制备,取供试液10 μL,分别在0、5、10、15、20、25 h进样,测定绿原酸、木犀草苷、3,5-O-二咖啡酰基奎宁酸,在25 h内绿原酸峰面积为3.683 5、3.571 6、3.592 8、3.663 6、3.637 2、3.660 2,RSD=1.21%;木犀草苷为2.457 5、2.439 1、2.516 8、2.485 2、2.409 4、2.505 9,RSD=1.67%;3,5-O-二咖啡酰基奎宁酸为12.727 9、12.518 3、12.693 7、12.705 6、12.649 2、12.593 6,RSD=0.63%。结果表明,样品溶液在25 h内稳定。
2.6.8重复性考察称取菊花粉末6份,每份约0.25 g,按“2.6.3”项下的方法进行提取制备,对照品溶液和供试品溶液各进样10 μL,测得峰面积并计算含量,绿原酸平均含量为0.24%、RSD=1.53%,木犀草苷平均含量为0.17%、RSD=0.87%,3,5-O-二咖啡酰基奎宁酸平均含量为0.91%、RSD=1.15%。
2.6.9样品测定取杭白菊传统饮片和压缩饮片,以及储存0、3、6、9、12、18个月的杭白菊相应样品,打粉,按“2.6.3”项下方法进行提取制备,对照品溶液和供试品溶液各进样10 μL,测得峰面积并计算含量。如表2所示杭白菊饮片经过压缩后,含量无明显变化;在18个月储存期内,杭白菊传统饮片含量有所减少,压缩饮片含量无明显变化,压缩饮片较传统饮片更加稳定,故从含量方面分析,压缩饮片优于传统饮片。

表2 杭白菊传统饮片和压缩饮片含量比较
3结论
本试验所用绿原酸、木犀草苷、3,5-O-二咖啡酰基奎宁酸的含量测定方法经线性考察,精密度、准确度、稳定性及重复性均符合规定,可作为杭白菊含量的测定方法。
杭白菊压缩饮片在煎煮的过程中,可恢复至原有药材或饮片的形状。不改变中药饮片或中药材的原有性状,也不会改变药性和原有煎药效果。且在储存过程中,压缩饮片较传统饮片更稳定。因此,其既保持了传统中药方剂的疗效和特点,又克服了传统中药剂量不准和卫生状况差的缺点,
便于实现中药配方的标准化、自动化,符合中药饮片行业的发展趋势。
参考文献:
[1]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:292.
[2]徐菊茂.杭白菊中黄酮类成分的提取动力学研究[J].中国药业,2012,21(16):31-32.
[3]杨秀伟,韩美华,陶海燕,等.微波加工和蒸制杭白菊挥发油成分的GC-MS分析[J].中国中药杂志,2007,32(3):227-231.
[4]殷红,黄越燕,蒋小红,等.杭白菊挥发油的抗菌抗炎作用及对PGE2的影响[J].浙江预防医学,2007,19(8):8-12.
[5]杨俊,蒋惠娣,戈震,等.杭白菊绿原酸及其他成分的含量在采摘期中的动态变化[J].中国中药杂志,2003,38(11):833-836.
[6]程亮,杜伟锋,丛晓东,等.近红外光谱法快速测定杭白菊中3种成分的含量[J].中国实验方剂学,2013,19(7):85-89.
[7]高学玲,贺曼曼,邹敏亮,等.不同品种菊花中游离糖类及游离氨基酸含量的HPLC分析[J].天然产物研究与开发,2012,24(5):639-643.
[8]王婷婷,王少康,黄桂玲,等.菊花主要活性成分含量及其抗氧化活性测定[J].食品科学,2013,34(15):95-99.
[9]陈倩,陈尊委,徐竑珂,等.酵母细胞提取物依赖NO信号途径提高杭白菊抗氧化活性[J].杭州师范大学学报(自然科学版),2013,12(3):227-232.
[10]蒋惠娣,王玲飞,周新妹,等.杭白菊乙酸乙酯提取物的舒血管作用及相关机制[J].中国病理生理杂志,2005,21(2):334-338.
[11]孙向珏,沈汉明,朱心强.菊花提取物抗肿瘤作用的研究进展[J].中草药,2008,39(1):148-151.
Studies on the quality and stability of Chrysanthemum morifolium before and after compression
HE Xiao-qing
(Taizhou Hospital of TCM,Taizhou 317700,China)
[Abstract]ObjectiveTo study the quality changes and stability of Chrysanthemum morifolium before and after compression.MethodsThe stability and quality of Chrysanthemum morifolium before and after compression were compared according to the changes of description,water,TLC and the content of active ingredient.ResultsBefore and after compression,the description,water,extracts,TLC and the content of active ingredient did not significantly change;the compressed Chrysanthemum morifolium was more stable than traditional dandelion.ConclusionCompressed decoction pieces are suitable for production and promotion of flower medicine.
Key words:Chrysanthemum morifolium; Compressed decoction pieces; Quality; Stability
收稿日期:2015-08-24
基金项目:台州市科技资金补助项目(14SF05)
DOI:10.14053/j.cnki.ppcr.201604027
