饲粮中燕麦干草含量对绵羊瘤胃液pH及微生物区系的影响
2016-06-17赵生国刘立山吴建平
周 瑞 赵生国 刘立山 王 川 吴建平*
(1.甘肃农业大学动物科学技术学院,兰州730070;2.甘肃农业大学动物医学院,兰州730070)
饲粮中燕麦干草含量对绵羊瘤胃液pH及微生物区系的影响
周瑞1赵生国1刘立山1王川2吴建平1*
(1.甘肃农业大学动物科学技术学院,兰州730070;2.甘肃农业大学动物医学院,兰州730070)
摘要:本试验旨在研究饲粮燕麦干草含量对绵羊瘤胃液pH及微生物区系的影响。选取9只体况和体重[(70.32±2.14) kg]相近、装有永久性瘘管的德国美利奴与蒙古羊杂种公羊,采用3×3拉丁方设计,随机分为3组,每组3只,各组分别采用全株玉米青贮、全株玉米青贮+燕麦干草(1∶1)(混合组)、燕麦干草为粗饲料。饲粮精粗比34.50∶65.50。进行3期饲养试验,每期20 d,15 d预试期,5 d采样期。采集饲喂前(0 h)和饲喂后1、3、5和7 h的瘤胃液,测定pH,采用实时定量PCR方法测定微生物相对含量。结果表明:1)全株玉米青贮组的瘤胃液pH在1、5 h均显著低于燕麦干草组(P<0.05),在3 h极显著低于混合组(P<0.01);2)混合组和燕麦干草组瘤胃液真菌的相对含量在0 h均极显著高于全株玉米青贮组(P<0.01),燕麦干草组在5 h真菌相对含量显著高于全株玉米青贮组(P<0.05);3)混合组原虫的相对含量在1、5 h显著低于全株玉米青贮组(P<0.05);4)饲喂后5 h,混合组和燕麦干草组的纤维分解菌相对含量均较高,其中燕麦干草组黄色瘤胃球菌相对含量显著高于全株玉米青贮组(P<0.05),白色瘤胃球菌和产琥珀酸丝状杆菌的相对含量极显著高于全株玉米青贮组(P<0.01)。综上所述,在精粗比为34.50∶65.50的饲粮中采用全株玉米青贮+燕麦干草(1∶1)的粗饲料,有利于维持绵羊瘤胃内环境的稳态及瘤胃微生物的生长,白色瘤胃球菌和产琥珀酸丝状杆菌为优势菌。
关键词:绵羊;粗饲料;瘤胃;微生物区系;实时定量PCR
反刍动物可以消化利用粗饲料,是由于其瘤胃内栖息着大量的微生物,这些微生物包括细菌、原虫、古菌和真菌[1]。这些微生物可以将植物纤维转化为易消化的化合物,然后被宿主进一步吸收利用[2]。经过长期的选择和进化,微生物与宿主间已经形成了相互制约相互依赖的关系,这种关系对于维持反刍动物健康、提高生产性能等起到至关重要的作用[3-5]。其中瘤胃细菌起着重要的作用[6],种类(50多个种属)和数量(1010~1011个/mL)也最多[7]。目前,白色瘤胃球菌(Ruminococcusalbus,R.albus)、黄色瘤胃球菌(Ruminococcusflavefaciens,R.flavefaciens)和产琥珀酸丝状杆菌(Fibrobactersuccinogenes,F.succinogenes)是研究饲粮纤维降解过程中研究最多的菌,也是被公认的瘤胃三大优势纤维分解菌[8]。研究表明绝大部分的瘤胃厌氧真菌都能分解纤维素,都具有高活性的降解植物细胞壁的纤维素酶、木聚糖酶、果胶酶和酯酶[9]。原虫约占到瘤胃内容物总生物量的1/2[10],部分纤毛原虫在消化纤维物质的同时还可以使甲烷的产量增加[11]。大量研究表明,瘤胃微生物的组成及丰度受很多因素的影响,如动物个体差异[12]、精粗比[13]和饲粮组成,且饲粮因素最为关键[14-15]。目前,国内已经普遍将玉米青贮和燕麦干草作为反刍动物饲粮中粗纤维的主要来源[16],但是其在瘤胃内的消化机理及对微生物区系的影响研究报道较少。本试验通过给绵羊饲喂不同燕麦干草含量的粗饲料,采用实时定量PCR技术对瘤胃中真菌、原虫和3种纤维分解菌进行定量研究,为进一步研究饲粮结构对瘤胃微生物区系的影响及提高绵羊对粗饲料利用率提供理论依据。
1材料与方法
1.1试验设计及饲养管理
选取9只体况和体重[(70.32±2.14) kg]相近,装有永久性瘘管的德国美利奴与蒙古羊杂种公羊为试验动物。粗饲料为全株玉米青贮和燕麦干草,燕麦干草由铡草机铡成3~5 cm长,精饲料由玉米、棉籽粕、菜籽粕、预混料等组成。
采用3×3拉丁方设计,9只羊随机分为3组,每组3只,各组分别采用全株玉米青贮、全株玉米青贮+燕麦干草(1∶1)(混合组)、燕麦干草为粗饲料。饲粮精粗比34.50∶65.50。试验饲粮组成及营养水平见表1。进行3期饲养试验,每期20 d,15 d预试期,5 d采样期。
试验羊单栏饲养,每天分别于08:00和18:00分2次等量饲喂,自由饮水。

表1 试验饲粮组成及营养水平(干物质基础)
1)预混料为每千克饲粮提供 The premix provided the following per kg of diets:VA 220 000 IU,VD372 000 IU,VE 2 000 IU,D-生物素D-biotin 40 mg,烟酰胺 nicotinic acid amide 2 000 mg,Mn (as manganese sulfate) 710 mg,Zn (as zinc sulfate) 2 005 mg,Fe (as ferrous sulfate) 830 mg,Cu (as copper sulfate) 680 mg,Co (as Cobalt sulfate) 12 mg。
2)实测值 Measured values。
1.2样品采集
分别于每期试验最后1 d饲喂前(0 h)、饲喂后1、3、5和7 h采集瘤胃液,立即用HI98103型笔式酸度计(北京泰亚赛福有限公司)测定瘤胃液pH,经4层灭菌纱布过滤,滤液装于经高压灭菌的采样管内,-70 ℃保存。
1.3引物设计与合成
根据GenBank上白色瘤胃球菌和产琥珀酸丝状杆菌的16S rRNA序列,真菌、原虫的18S rRNA序列,利用Primer Premier 3.0(http://bioinfo.ut.ee/primer3-0.4.0/primer3/)分别设计特异性引物,结果见表2。引物由上海生物工程有限公司合成。

表2 瘤胃微生物实时定量PCR的引物序列
*:细菌16S rDNA为管家基因,引物参考Muyzer等[17];**:黄色瘤胃球菌引物参考王海荣[18]。
*: bacterial 16S rDNA was the reference gene, and the primer was cited from Muyzer, et al[17]; **: the primer ofR.flavefacienswas cited from Wang[18].
1.4瘤胃微生物总DNA的提取与样品测定
瘤胃微生物总DNA的提取利用天根生化科技(北京)有限公司粪样DNA提取试剂盒(DP328)进行。瘤胃微生物定量采用实时定量PCR比较阈值法,目的菌相对含量计算采用2-△△Ct法。PCR反应体系及反应参数参照Roche试剂盒(Gat.No.06402712001)说明书进行。反应体系(20 μL)为:Master Mix 10 μL,模板2 μL(20 ng),上、下游引物各0.6 μL,ddH2O 6.8 μL。反应参数为:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸15 s,40个循环。在延伸期收集荧光信号。
1.5数据处理
试验数据用Excel 2010建立数据库,通过SPSS 19.0软件中的单因素方差分析对数据进行统计分析和显著性检验,运用LSD法进行多重比较,结果用平均值±标准误表示,P<0.05为差异显著,P<0.01为差异极显著。
2结果
2.1饲粮中燕麦干草含量对绵羊瘤胃液pH的影响
由表3可知,3组瘤胃液pH随时间的推移都呈先降低再升高的趋势,且晨饲前(0 h)3组瘤胃液pH都最高,晨饲后开始下降,3 h下降至最低后开始上升。晨饲前全株玉米青贮组瘤胃液pH最高,且显著高于燕麦干草组(P<0.05)。饲喂后1和5 h,全株玉米青贮组显著低于燕麦干草组(P<0.05),且饲喂后3 h全株玉米青贮组极显著低于混合组(P<0.01)。
2.2饲粮中燕麦干草含量对绵羊瘤胃液真菌、原虫及纤维分解菌相对含量的影响
由表4可知,以全株玉米青贮组作为为对照分析燕麦干草含量对绵羊瘤胃液真菌相对含量的影响,混合组、燕麦干草组真菌相对含量随时间的变化有所不同。混合组、燕麦干草组均在0 h真菌的相对含量最高,饲喂后3 h降至最低。晨饲前混合组和燕麦干草组的真菌相对含量极显著高于全株玉米青贮组(P<0.01),喂后1 h这2组真菌相对含量下降,混合组显著低于全株玉米青贮组(P<0.05)。喂后3 h混合组和燕麦干草组分别极显著(P<0.01)、显著(P<0.05)低于全株玉米青贮组。喂后5 h燕麦干草组真菌相对含量显著高于全株玉米青贮组(P<0.05)。喂后7 h燕麦干草组、混合组与全株玉米青贮组差异不显著(P>0.05)。
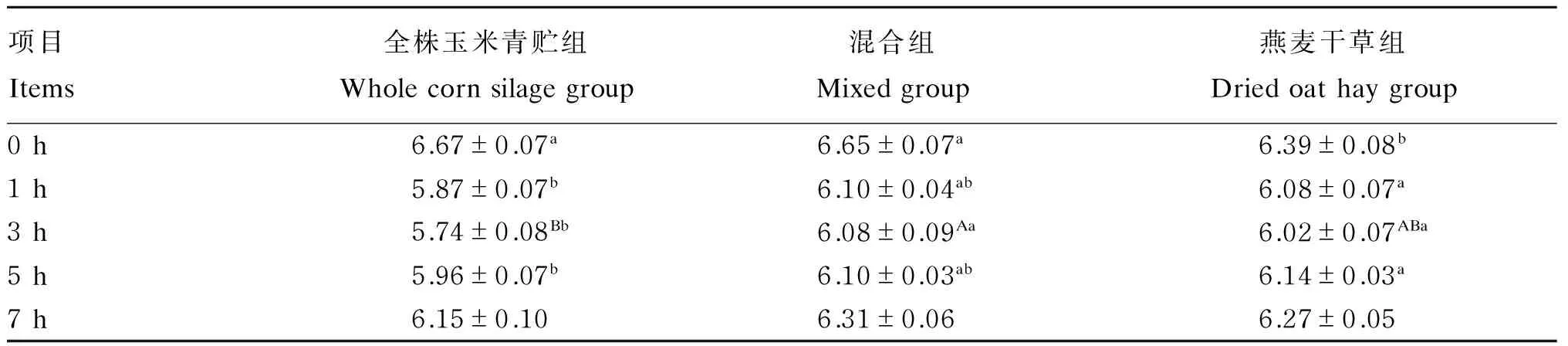
表3 饲粮中燕麦干草含量对绵羊瘤液pH的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P>0.01)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P>0.01). The same as below.
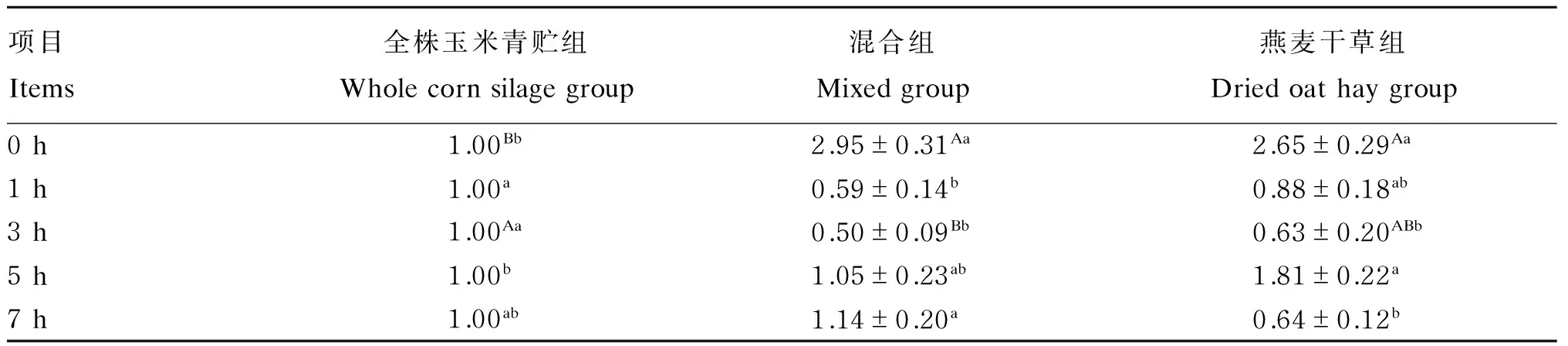
表4 饲粮中燕麦干草含量对绵羊瘤胃液真菌相对含量的影响
由表5可知,以全株玉米青贮组作为对照分析燕麦干草含量对绵羊瘤胃液原虫相对含量的影响,随时间的延长瘤胃液原虫的相对含量变化趋势不同,但混合组和燕麦干草组原虫相对含量都在饲喂后3 h最高。混合组在饲喂后1和5 h显著
低于青贮组(P<0.05)。而燕麦干草组原虫相对含量在喂后0和3 h分别等于、高于全株玉米青贮组外,其他时间点均低于全株玉米青贮组,且7 h降至最低。
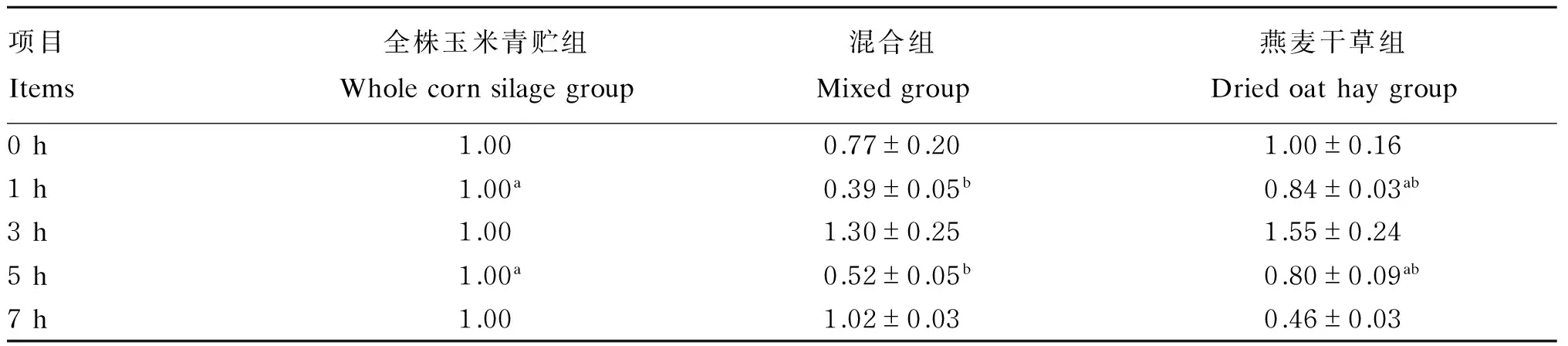
表5 饲粮中燕麦干草含量对绵羊瘤胃液原虫相对含量的影响
由表6可知,以全株玉米青贮组作为对照分析燕麦干草含量对绵羊瘤胃液黄色瘤胃球菌相对含量的影响,随时间的延长瘤胃液黄色瘤胃球菌的相对含量呈降低升高再降低的趋势。燕麦干草组在喂后1h极显著低于全株玉米青贮组(P<0.01),喂后3和7 h显著或极显著低于其他2组(P<0.05或P<0.01)。喂后5 h混合组和燕麦干草组黄色瘤胃球菌相对含量均高于全株玉米青贮组,且燕麦干草组显著高于其他2组(P<0.05)。
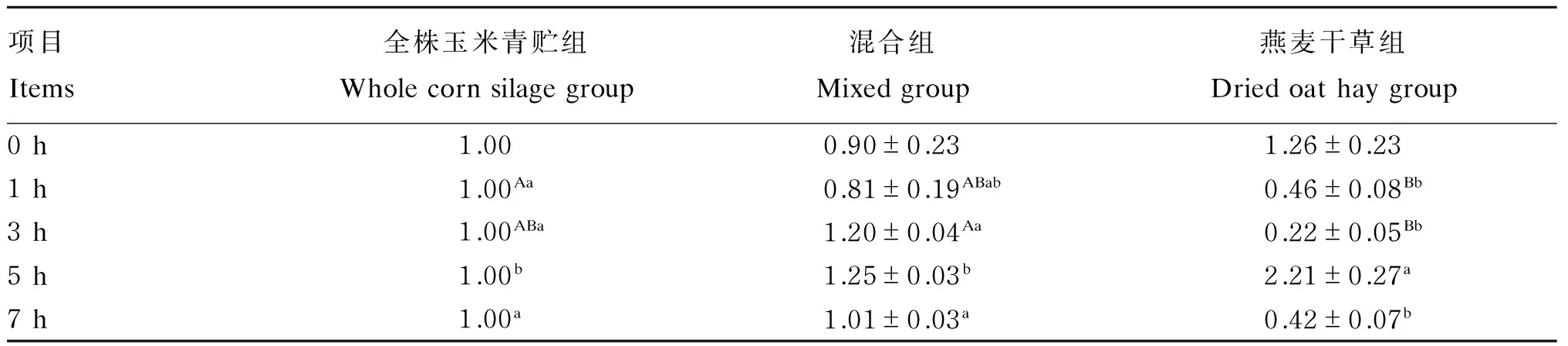
表6 饲粮中燕麦干草含量对绵羊瘤胃液黄色瘤胃球菌相对含量的影响
由表7可知,以全株玉米青贮组作为对照分析燕麦干草含量对绵羊瘤胃液白色瘤胃球菌相对含量的影响,混合组和燕麦干草组白色瘤胃球菌相对含量在0~7 h均高于全株玉米青贮组,且随时间延长呈先降低后升高再降低的趋势。除喂后1 h混合组和燕麦干草组显著高于全株玉米青贮组(P<0.05)外,其他时间均极显著高于全株玉米青贮组(P<0.01)。而且,喂后5和7 h燕麦干草组分别显著(P<0.05)、极显著(P<0.01)高于混合组。
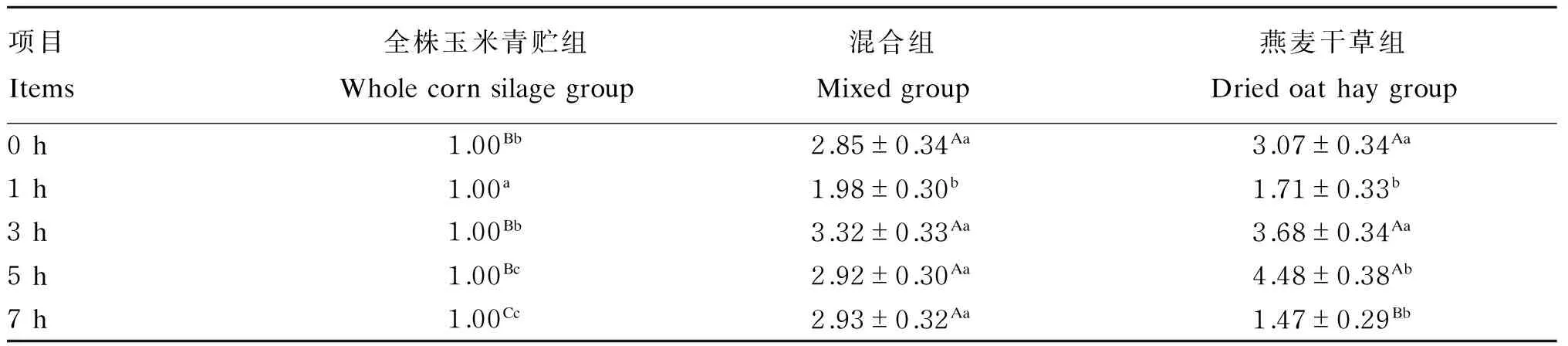
表7 饲粮中燕麦干草含量对绵羊瘤胃液白色瘤胃球菌相对含量的影响
由表8可知,以全株玉米青贮组作为对照分析燕麦干草含量对绵羊瘤胃液产琥珀酸丝状杆菌相对含量的影响,随时间延长产琥珀酸丝状杆菌的相对含量变化不一致。混合组在1 h极显著高于全株玉米青贮组和燕麦干草组(P<0.01)。全株玉米青贮组在5 h极显著低于混合组和燕麦干草组(P<0.01)。混合组在5 h显著高于燕麦干草组(P<0.05)。燕麦干草组在7 h时显著高于混合组(P<0.05)。
3讨论
3.1饲粮中燕麦干草含量对瘤胃液pH的影响
瘤胃液pH是综合反映反刍动物瘤胃发酵水平和内环境的重要指标,可以通过测定瘤胃液pH评定瘤胃发酵[19]。通常瘤胃液pH维持在6.0~7.0的范围内[20]。本试验中,瘤胃液pH维持在5.8~6.7之间,3组瘤胃液pH随时间的延长均呈先降低后升高的变化趋势,0 h pH最高,饲喂后逐渐下降至3 h pH达到最低,该结果与其他研究结果基本一致。王洪亮等[21]研究显示,在对肉牛饲喂不同粗饲料后,各组瘤胃液pH均降低,且在2~4 h降至最低,采食后8~10 h又回升至采食前水平,但组间pH无显著差异。郭勇庆等[22]研究表明,瘤胃发酵生理过程的最适pH各不相同,消化纤维素时pH最适范围为6.0~6.8,合成蛋白质时pH的最适范围为5.8~7.4,产生挥发性脂肪酸(VFA)时pH最适范围为4.2~6.6,氨产生最适pH为6.2。瘤胃液pH是食糜中VFA与唾液中缓冲液相互作用以及瘤胃上皮对VFA吸收及随食糜流出等因素综合作用的结果[24]。本试验中,全株玉米青贮组瘤胃液pH在1~3 h内略低于6.0,这可能是由于瘤胃微生物消化分解饲粮中碳水化合物产生大量了VFA所致[24]。随着饲粮被消化,唾液等缓冲性物质的增加,使得瘤胃液pH开始缓慢回升。3组瘤胃液pH差异不显著,说明精料水平在30%~50%时对瘤胃液pH影响较小[25-26]。但是,混合组和燕麦干草组的瘤胃液pH高于全株玉米青贮组,可能是由于燕麦干草的结构性碳水化合物含量高于全株玉米青贮,适口性较低,采食速度慢,导致其在瘤胃内降解率、外排速度低,滞留时间长[24]。
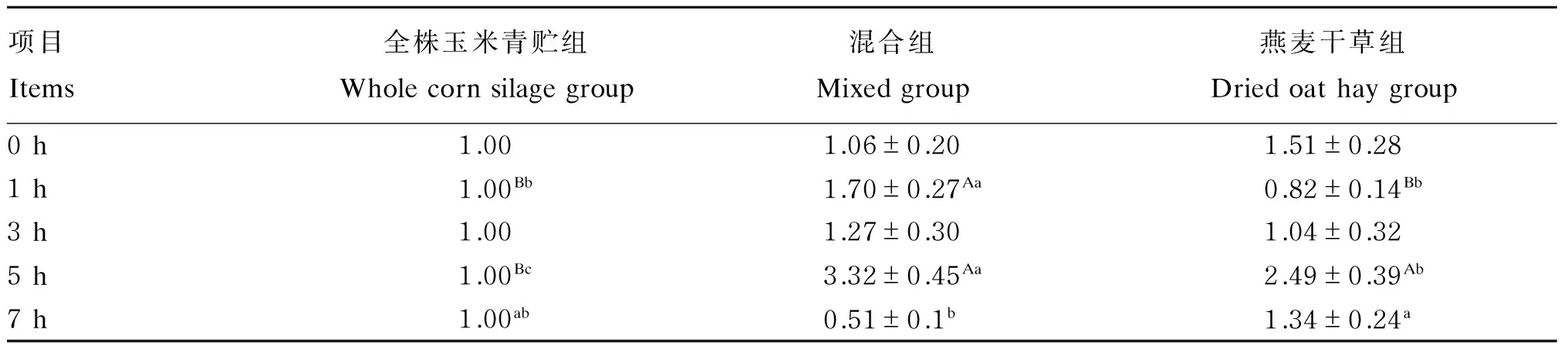
表8 饲粮中燕麦干草含量对绵羊瘤胃液产琥珀酸丝状杆菌相对含量的影响
3.2饲粮中燕麦干草含量对绵羊瘤胃液真菌、原虫及纤维分解菌相对含量的影响
本试验中,混合组和燕麦干草组瘤胃液真菌相对含量在0 h极显著高于全株玉米青贮组,饲喂后0~3 h随着3种瘤胃液细菌相对含量的增加,真菌的含量急剧下降。导致此现象出现的原因可能是真菌更偏向于利用饲粮中的木质素而非纤维素类物质[27]。同时,由于其在瘤胃总微生物所占比例较低,所以对纤维降解的总体贡献要小于瘤胃细菌[28]。早期的研究表明,白色瘤胃球菌和黄色瘤胃球菌能抑制厌氧真菌对玉米茎和纤维素的降解能力[29-30]。本试验中,燕麦干草组在饲喂后5 h时真菌和3种纤维分解菌的相对含量均较高,但3种纤维分解菌的相对含量高于真菌,说明瘤胃真菌与细菌存在拮抗作用[31]。Atasoglu等[32]研究认为,不同饲粮类型对瘤胃真菌种群有明显的影响,当饲喂纤维素含量较高的饲粮时,动物瘤胃中的真菌数量要比饲喂低纤维素饲粮动物多。这与本试验中混合组与燕麦干草组真菌在0 h的相对含量高于全株玉米青贮组的结果一致。
Jounay等[10]研究表明,原虫的主要发酵底物是淀粉和可溶性糖类。本试验中,混合组和燕麦干草组原虫的相对含量除在3 h高于全株玉米青贮组外,其他时间点均接近或低于全株玉米青贮组,而且低于同水平下3种纤维分解菌和真菌的相对含量。NRC(2001)指出,燕麦干草的非结构性碳水化合物(non structure carbohydrates,NSC)含量为13.6%(干物质基础),低于全株玉米青贮(34.7%)。这表明给绵羊饲喂燕麦干草时,真菌和纤维分解菌起主要作用。
产琥珀酸丝状杆菌、黄色瘤胃球菌和白色瘤胃球菌是瘤胃中最主要的纤维分解细菌,它们消化纤维素的能力要强于其他纤维分解菌,在牛瘤胃的总纤维分解菌中所占比例分别为33.0%、2.6%和46.0%[33]。本试验中,混合组和燕麦干草组产琥珀酸丝状杆菌和白色瘤胃球菌的相对含量显著高于全株玉米青贮组,表明给绵羊饲喂燕麦干草时,白色瘤胃球菌和产琥珀酸丝状杆菌为优势菌群。这可能是因为白色瘤胃球菌比黄色瘤胃球菌更具有亲和力,附着纤维的能力远高于黄色瘤胃球菌,它们在吸附过程中存在相同的吸附位点和屏障,白色瘤胃球菌可以抢占黄色瘤胃球菌的吸附位点。而黄色瘤胃球菌和产琥珀酸丝状杆菌由于吸附位点不一致,几乎不存在竞争关系,但是,当黄色瘤胃球菌和产琥珀酸丝状杆菌完全定植后,白色瘤胃球菌的吸附会增加黄色瘤胃球菌的脱落[34]。
4结论
① 在精粗比为34.50∶65.50的饲粮中采用全株玉米青贮+燕麦干草(1∶1)的粗饲料,可以使绵羊瘤胃液pH维持在正常范围内,有利于维持瘤胃内环境稳态和瘤胃微生物的生长。
② 在精粗比为34.50∶65.50的饲粮中采用全株玉米青贮+燕麦干草(1∶1)的粗饲料,绵羊瘤胃内原虫数量下降,而3种主要的纤维分解菌数量升高,且白色瘤胃球菌和产琥珀酸丝状杆菌为优势菌群。
参考文献:
[1]HESPELL R B,AKIN D E,DEHORITY B A.Bacteria,fungi and protozoa of the rumen[M]//MACKIE R I,WHITE B A,ISAACSON R E.Gastrointestinal microbiology.New York:Chapman and Hall Press,1997:59-186.
[2]MACKIE R I.Mutualistic fermentative digestion in the gastrointestinal tract:diversity and evolution[J].Integrative and Comparative Biology,2002,42(2):319-326.
[3]LEY R E,HAMADY M,LOZUPONE C,et al.Evolution of mammals and their gut microbes[J].Science,2008,320(5883):1647-1651.
[4]ZILBER-ROSENBERG I,ROSENBERG E.Role of microorganisms in the evolution of animals and plants:the hologenome theory of evolution[J].FEMS Microbiology Reviews,2008,32(5):723-735.
[5]RAWLS J F,SAMUEL B S,GORDON J I.Gnotobiotic zebrafish reveal evolutionarily conserved responses to the gut microbiota[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(13):4596-4601.
[6]祁茹,林英庭,程明,等.瘤胃微生物区系及其相互关系的研究进展[J].饲料博览,2011(8):9-13.
[7]薛丰,王洪荣,刘大程,等.瘤胃微生物区系的研究进展[J].畜牧与饲料科学,2007,28(2):31-33.
[8]FORSBERG C W,CHENG K J,WHITE B A.Polysaccharide degradation in the rumen and large intestine[M]//MACKIE R I,WHITE B A,ISAACSON R E.Gastrointestinal microbiology.New York:Chapman and Hall Press,1997:319-379.
[9]ORPIN C G,JOBLIN K N.The rumen anaerobic fungi[M]//HOBSON P N,STEWART C S.The rumen microbial ecosystem.London:Blackie Academic&Professional,1997,140-196.
[10]JOUNAY J P,USHIDA K.The role of protozoa in feed digestion-review[J].Asian-Australasian Journal of Animal Science,1999,12(1):113-128.
[11]付琦,侯先志,高爱武.瘤胃微生物区系及相互关系的研究进展[J].中国奶牛,2009(5):18-21.
[12]YANG S L,MA S C,CHEN J,et al.Bacterial diversity in the rumen of Gayals(Bosfrontalis),Swamp buffaloes (Bubalusbubalis) and Holstein cow as revealed by cloned 16S rRNA gene sequences[J].Molecular Biology Reports,2010,37(4):2063-2073.
[13]SADET-BOURGETEAU S,MARTIN C,MORGAVI D P.Bacterial diversity dynamics in rumen epithelium of wethers fed forage and mixed concentrate forage diets[J].Veterinary Microbiology,2010,146(1/2):98-104.
[14]PITTA D W,PINCHAK W E,DOWD S E,et al.Rumen bacterial diversity dynamics associated with changing fromBermudagrasshay to grazed winter wheat diets[J].Microbial Ecology,2010,59(3):511-522.
[15]BELANCHE A,DOREAU M,EDWARDS J E,et al.Shifts in the rumen microbiota due to the type of carbohydrate and level of protein ingested by dairy cattle are associated with changes in rumen fermentation[J].The Journal of Nutrition,2012,142(9):1684-1692.
[16]XU J,HOU Y J,YANG H B,et al.Effects of forage sources on rumen fermentation characteristics,performance,and microbial protein synthesis in midlactation cows[J].Asian-Australasian Journal of Animal Sciences,2014,27(5):667-673.
[17]MUYZER G,DE WAAL E C,UITTERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,1993,59(3):695-700.
[18]王海荣.不同日粮精粗比及氮源对绵羊瘤胃纤维降解菌群和纤维物质降解的影响[D].博士学位论文.呼和浩特:内蒙古农业大学,2006.
[19]KUMAR S,DAGAR S S,SIROHI S K,et al.Microbial profiles,invitrogas production and dry matter digestibility based on various ratios of roughage to concentrate[J].Annals of Microbiology,2013,63(2):541-545.
[20]郝正里,刘世民,孟宪政.反刍动物营养学[M].兰州:甘肃民族出版社,1999.
[21]王洪亮,孙晓玉,赵福忠.黑龙江省常用粗饲料对肉牛瘤胃内环境的影响研究[J].中国牛业科学,2013,39(2):6-10.
[22]郭勇庆,张英杰.瘤胃内环境优化技术及其应用[C]//第四届中国牛业发展大会论文集.南阳:中国畜牧业协会,2009:274-277.
[23]冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.
[24]张瑛,周建伟,刘浩,等.藏羊瘤胃发酵参数对燕麦干草为饲粮限饲的响应及其氮维持需要量估测[J].动物营养学报,2014,26(2):371-379.
[25]米歇尔·瓦提欧.营养与饲喂[M].石燕,施福顺,译.北京:中国农业大学出版社,2004.
[26]BARGO F,MULLER L D,DELAHOY J E,et al.Milk response to concentrate supplementation of high producing dairy cows grazing at two pasture allowances[J].Journal of Dairy Science,2002,85(7):1777-1792.
[27]TUYEN V D,CONE J W,BAARS J J P,et al.Fungal strain and incubation period affect chemical composition and nutrient availability of w heat straw for rumen fermentation[J].Bioresource Technology,2012,111:336-342.
[28]AKIN D E.Histological and physical factors affecting digestibility of forages[J].Agronomy Journal,1989,81(1):17-25.
[29]ROGER V,GRENET E,JAMOT J,et al.Degradation of maize stem by two rumen fungal species,PiromycescommunisandCaecomycescommunis,in pure cultures or in association with cellulolytic bacteria[J].Reproduction Nutrition Development,1992,32(4):321-329.
[30]BERNALIER A,FONTY G,BONNEMOY F,et al.Degradation and fermentation of cellulose by the rumen anaerobic fungi in axenic cultures or in association with cellulolytic bacteria[J].Current Microbiology,1992,25(3):143-148.
[31]DEHORITY B A,TIRABASSO P A.Antibiosis between ruminal bacteria and ruminal fungi[J].Applied and Environmental Microbiology,2000,66(7):2921-2927.
[32]ATASOGLU C,WALLACE R J.De novo synthesis of amino acids by the ruminal anaerobic fungi,PiromycescommunisandNeocallimastixfrontalis[J].FEMS Microbiology Letters,2002,212(2):243-247.
[33]KOIKE S,KOBAYASHI Y.Fibrolytic rumen bacteria:their ecology and functions[J].Asian-Australasian Journal of Animal Sciences,2009,22(1):131-138.
[34]MOSONI P,FONTY G,GOUET P.Competition between ruminal cellulolytic bacteria for adhesion to cellulose[J].Current Microbiology,1997,35(1):44-47.
(责任编辑王智航)
Effects of Dried Oat Hay Content in Diet on Rumen Fluid pH and Microflora of Sheep
ZHOU Rui1ZHAO Shengguo1LIU Lishan1WANG Chuan2WU Jianping1*
(1. College of Animal Science & Technology, Gansu Agricultural University, Lanzhou 730070, China; 2. College of Veterinary Medicine, Gansu Agricultural University, Lanzhou 730070, China)
Abstract:In order to investigate the effects of dried oat hay content in diet on rumen fluid pH and microflora of sheep. Nine German merino sheep×Ongolian sheep cross breed rams with similar body condition and body weight [(70.32±2.14) kg] were used in a replicated 3×3 Latin square design, and randomly divided into 3 groups with 3 rams per group. Sheep were fed whole corn silage, whole corn silage+dried oat hay (1∶1) (mixed group) and dried oat hay as roughages, and the dietary concentrate to roughage ratio was 34.50∶65.50. The experimental consisted of 3 periods with 20 d per period, and each period had 15 d for pre-test and 5 d for sampling. Rumen fluid was collected before feeding (0 h) and 1, 3, 5 and 7 h after feeding to measure pH, meanwhile, the relative contents of microorganisms with real-time quantitative PCR method. The results showed as follows: 1) ruminal pH of whole corn silage group was significantly lower than that of dried oat hay group at 1 and 5 h (P<0.05), extremely significantly lower than that of mixed group at 3 h (P<0.01); 2) the relative content of fungus in rumen fluid of mixed group and dried oat hay group was extremely significantly greater than that of whole corn silage at 0 h (P<0.01), and dried oat hay group was also significantly higher than whole corn silage group (P<0.05); 3) the relative content of protozoa in rumen fluid of mixed group was significantly lower than that of whole corn silage group at 1 and 5 h (P<0.05); 4) after 5 h of feeding, the relative contents of cellulolytic bacteria of mixed group and dried oat hay group were relatively high, among which the relative content of Ruminococcus flavefaciens was significantly higher than that of whole corn silage group (P<0.05), the relative contents of Ruminococcus albus and Fibrobacter succinogenes were extremely significantly higher than those of whole corn silage group (P<0.01). In conclusion, it is benefit for maintain stable ecosystem of rumen and growth of microorganisms that using whole corn silage+dried oat hay (1∶1) as roughage in diet with concentrate to roughage ratio of 34.50∶65.50, and Ruminococcus albus and Fibrobacter succinogenes are dominant bacteria.[Chinese Journal of Animal Nutrition, 2016, 28(5):1589-1597]
Key words:sheep; roughage; rumen; microflora; RT-qPCR
doi:10.3969/j.issn.1006-267x.2016.05.037
收稿日期:2015-11-23
基金项目:地区科学基金项目(31460592);农业部“绒毛用羊产业技术体系放牧生态岗位科学家”(CARS-40-09B);公益性行业(农业)科研专项(201503134);公益性行业(农业)科研专项(201303059);甘肃省高等学校科研项目(2013A-064)
作者简介:周瑞(1991—),女,宁夏中卫人,硕士研究生,动物营养与饲料科学专业。E-mail: zhour1222@163.com *通信作者:吴建平,教授,博士生导师,E-mail: wujp@gsau.edu.cn
中图分类号:S826
文献标识码:A
文章编号:1006-267X(2016)05-1589-09
*Corresponding author, professor, E-mail: Wujp@gsau.edu.cn
