吉富罗非鱼对饲料精氨酸的需要量
2016-06-17武文一
武文一 蒋 明 刘 伟 吴 凡
田 娟2 杨长庚2 文 华2*
(1.上海海洋大学水产与生命学院,上海201306;2.中国水产科学研究院长江水产研究所,农业部淡水生物多样性保护与利用重点开放实验室,武汉430223)
吉富罗非鱼对饲料精氨酸的需要量
武文一1,2蒋明2刘伟2吴凡2
田娟2杨长庚2文华2*
(1.上海海洋大学水产与生命学院,上海201306;2.中国水产科学研究院长江水产研究所,农业部淡水生物多样性保护与利用重点开放实验室,武汉430223)
摘要:以饲料精氨酸水平分别为0.67%、0.94%、1.24%、1.58%、1.86%和2.11%的6种等氮等能的半纯化饲料(粗蛋白质含量30.21%,总能17.77 MJ/kg),投喂初始体重为(81.52±2.00) g的吉富罗非鱼60 d,考察饲料精氨酸水平对吉富罗非鱼生长性能、饲料利用、体成分、血清生化指标和非特异性免疫指标的影响,以期获得吉富罗非鱼对饲料精氨酸的最佳需要量。每种饲料投喂3个网箱,每个网箱放养15尾鱼。结果表明:随着饲料精氨酸水平的升高,吉富罗非鱼的增重率、特定生长率、蛋白质效率以及蛋白质沉积率均呈现先上升后下降的趋势,并均在1.58%组达到最高值,与其他组差异显著(P<0.05);饲料系数、肝体比、脏体比则呈现先下降后上升的趋势,饲料系数在1.58%组达到最低值,与其他组差异显著(P<0.05);全鱼粗脂肪和肌肉粗灰分含量的变化趋势与饲料系数相似,肌肉粗脂肪呈现与增重率和特定生长率相似的变化趋势,而全鱼粗灰分和肌肉粗蛋白质含量则呈先上升后稳定的趋势。饲料精氨酸水平对吉富罗非鱼的肥满度,全鱼水分、粗蛋白质及肌肉水分含量无显著影响(P>0.05)。肌肉中各氨基酸(除酪氨酸、甘氨酸、丙氨酸外)、必需氨基酸、总氨基酸含量均随饲料精氨酸水平的升高呈先上升后下降的趋势。饲料精氨酸水平显著影响血清中谷草转氨酶、谷丙转氨酶活性及总胆固醇、甘油三酯、总蛋白、尿素氮和葡萄糖含量(P<0.05),也显著影响肝脏和血清中总超氧化物歧化酶、总一氧化氮合酶和溶菌酶的活性(P<0.05)。以增重率、饲料系数和蛋白质效率为主要评价指标,通过二次回归分析可知,吉富罗非鱼对饲料中精氨酸需要量为1.51%~1.58%,占饲料蛋白质的4.99%~5.25%。
关键词:吉富罗非鱼;精氨酸;需要量;生长;免疫
精氨酸(arginine,Arg)是一种脂肪族的碱性的含有胍基的极性α氨基酸,是养殖鱼类的必需氨基酸之一。精氨酸在鱼体内可直接参与蛋白质、尿素的合成[1],作为前体合成肌酸(creatine)、多胺类(polyamines)以及一氧化氮(NO);同时,它还可以促进胰岛素分泌,进而调节葡萄糖代谢。相关研究表明,饲料中含有适量的精氨酸可以显著提高大口黑鲈[2](Micropterussalmoides)、银大马哈鱼[3](Oncorhynchuskisutch)的增重率、特定生长率、蛋白质沉积率。Zhou等[4]对黄颡鱼(Pelteobagrusfulvidraco)的研究发现,饲料中适量的精氨酸可以提高鱼体对嗜水气单胞菌(Aeromonashydrophila)的抵抗力及非特异免疫力。饲料中缺乏精氨酸,建鲤(CyprinuscarpiovarJian)表现出生长性能、成活率和抵抗力的下降[5]。
当前已有研究者通过剔除法计算出鱼体氮保留率,并推算出罗非鱼(体重20 g)的精氨酸需要量为2.03%(占饲料百分比)[6];Santiago等[7]通过生长剂量效应得出罗非鱼(体重15 g)对精氨酸的需要量为1.18%(占饲料百分比);也有报道证实利用体氨基酸组成数据推算罗非鱼氨基酸需要量并不一定准确,需要应用生长观测法来确定罗非鱼对氨基酸的需要量[8]。但是,大多数研究并未综合考虑过营养代谢和鱼体健康问题,仅仅是通过生长指标确定其对精氨酸的需要量。
吉富罗非鱼(GIFT,Oreochromisniloticus)是我国罗非鱼养殖中主要养殖品系之一,是经过遗传性状改良后的尼罗罗非鱼,其生长速度较其他品系快5%~20%。不同品系和处于特定生长阶段的罗非鱼对精氨酸的需要量可能发生改变,需要通过全新的生长试验来确定需要量。因此,本试验通过配制不同精氨酸水平的半纯化饲料,饲养初始平均体重为81.52 g的吉富罗非鱼60 d,对吉富罗非鱼的生长性能、饲料利用、体成分、部分血清生化指标和非特异免疫指标进行综合考察,以确定此阶段吉富罗非鱼对精氨酸的需要量,为高效环保的吉富罗非鱼配合饲料的开发和利用提供理论科学依据。
1材料与方法
1.1试验饲料
试验饲料以鱼粉、菜籽粕、酪蛋白、明胶及氨基酸混合物为蛋白质源,大豆油、玉米油为脂肪源,糊精作为糖源,按表1配方比例进行半纯化饲料的配制,精氨酸水平设计梯度为0、0.35%、0.75%、1.10%、1.45%和1.80%(L-精氨酸等氮替代L-甘氨酸)。氨基酸混合物(除精氨酸和甘氨酸)参照吉富罗非鱼肌肉氨基酸组成模式配比,以羟甲基纤维素钠、卡拉胶、α-淀粉按1∶1∶1比例作为包被材料,参照Millamena等[9]的方法进行包膜,氨基酸混合物组成见表2。各原料经粉碎过80目筛网后,按照表1配比进行称重,充分混匀后,用小型绞肉机制成条状饲料,用饲料烘干机60 ℃短暂烘后常温风干,经粉碎机破碎成长度为5 mm的颗粒饲料,置于-20 ℃冰箱中保存。经检测,试验饲料中精氨酸水平(占饲料百分比)分别为0.67%、0.94%、1.24%、1.58%、1.86%和2.11%,占饲料蛋白质的百分比分别为2.15%、3.11%、4.10%、5.23%、6.16和6.98%。

表1 试验饲料组成及营养水平(风干基础)
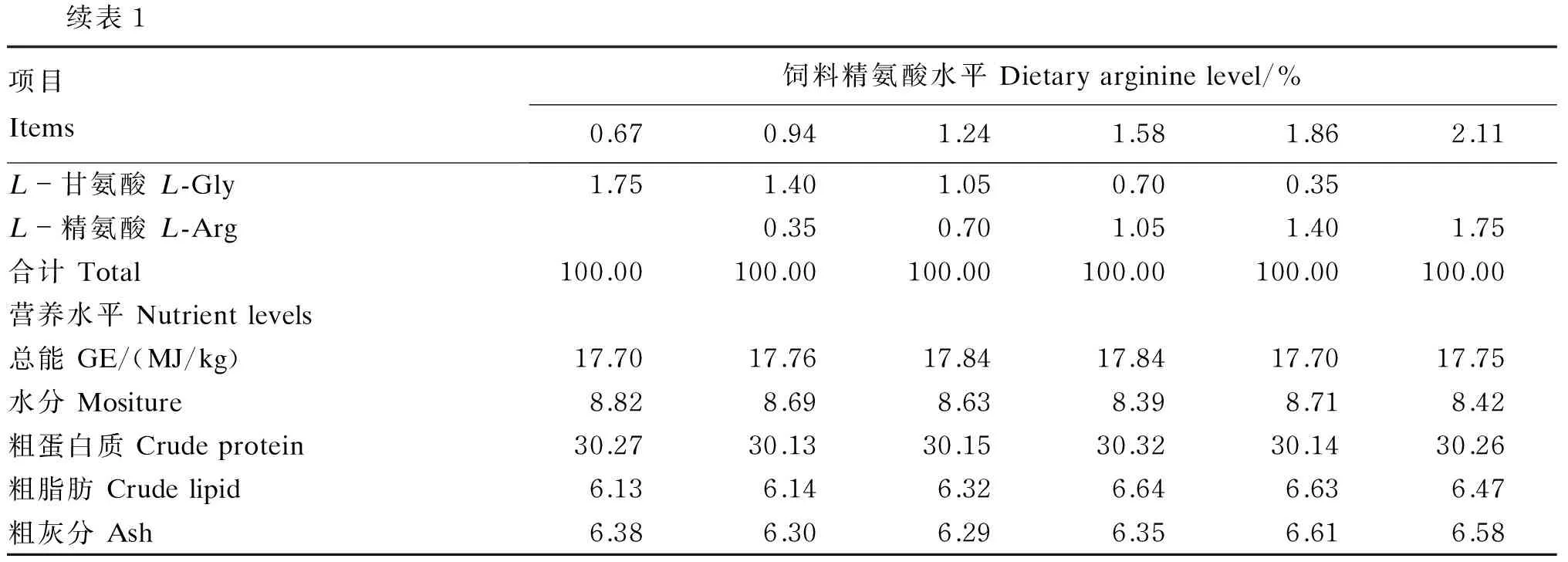
续表1项目Items饲料精氨酸水平Dietaryargininelevel/%0.670.941.241.581.862.11L-甘氨酸L-Gly1.751.401.050.700.35L-精氨酸L-Arg0.350.701.051.401.75合计Total100.00100.00100.00100.00100.00100.00营养水平Nutrientlevels总能GE/(MJ/kg)17.7017.7617.8417.8417.7017.75水分Mositure8.828.698.638.398.718.42粗蛋白质Crudeprotein30.2730.1330.1530.3230.1430.26粗脂肪Crudelipid6.136.146.326.646.636.47粗灰分Ash6.386.306.296.356.616.58
1)维生素预混料可为每千克饲料提供The vitamin premix provided the following per kg of diets:VA 5 000 IU,VD32 000 IU,VE 60 mg,VC 120 mg,VK 5 mg,VB15 mg,VB220 mg,VB610 mg,烟酸 nicotinic acid 120 mg,泛酸钙 calcium pantothenate 10 mg,叶酸 folic acid 1 mg,生物素 biotinn 0.1 mg,肌醇 inositol 400 mg。
2)矿物质预混料可为每千克饲料提供The mineral premix provided the following per kg of diets:Ca(H2PO4)26 000 mg,Ca(CH3CHOHCOO)26 540 mg,FeSO442.5 mg,MgSO41 340 mg,NaH2PO41 744 mg,NaCl 870 mg,AlCl33 mg,KIO32.5 mg,KCl 1 500 mg,CuCl22 mg,MnSO416 mg,CoCl220 mg,ZnSO460 mg。
1.2试验鱼与饲养管理
试验用吉富罗非鱼购自广西南宁罗非鱼国家级良种场,购回后用3%NaCl水溶液进行消毒,然后放入暂养池塘网箱(4.0 m×4.0 m×1.5 m)中,用基础饲料(精氨酸水平为0.67%的试验饲料)驯化15 d,使罗非鱼适应试验饲料和养殖环境。正式试验前,将吉富罗非鱼饥饿24 h,然后挑选270尾体格健壮的初始平均体重为(81.52±2.00) g吉富罗非鱼,养殖于18个池塘网箱(1.0 m×1.0 m×1.5 m)中,每个网箱15尾鱼,随机分成6组,每组3个重复(网箱),分别投喂6种试验饲料,持续饲养60 d(养殖试验时间从2015年8月中旬至2015年10月中旬)。每天定时投食2次(08:00、16:00),表观饱食投喂,并根据鱼体生长、摄食情况和水温等环境条件及时调整投喂量,每天记录鱼摄食及死亡情况。池塘面积约6 666.7 m2,水深1.8~2.5 m,池塘中间配有1个3 kW的叶轮增氧机,11:00—14:00和00:00—06:00开增氧机(阴雨天气定时检测溶氧浓度,当溶氧浓度低于4 mg/L时,开机增氧);同时,配有1台750 W的气泵向每个网箱不间断曝气增氧。试验期间水温为25~32 ℃(水深约50 cm),pH 6.5~7.0,溶氧浓度大于4 mg/L,氨氮浓度小于0.05 mg/L。
1.3样品采集
试验结束后,禁食24 h后以养殖网箱为单位进行称重,计数吉富罗非鱼成活的尾数;每个养殖网箱随机挑取3尾鱼,用于全鱼水分、粗蛋白质、粗脂肪、粗灰分含量等常规营养成分的测定。随后每个养殖网箱再随机选取3尾鱼,进行体重、体长的测定,并从尾静脉采血,血液4 ℃静置2 h后,3 000 r/min离心15 min,取上层血清,用于血清生化指标及部分非特异性免疫指标的测定。每个养殖网箱再随机另取3尾鱼,用30 mg/L的MS-222进行麻醉,分离内脏和肝脏进行称重;取侧线上方背部肌肉进行常规营养成分及氨基酸组成分析。全鱼、血清、肝脏、肌肉等样品均保存于-40 ℃的冰箱中。
1.4指标测定及计算
根据以下公式计算增重率、特定生长率、饲料系数、蛋白质效率、蛋白质沉积率、成活率、肥满度、肝体比、脏体比。
增重率(%)=100×(Wt-W0)/W0;
特定生长率(%)=100×(lnWt-lnW0)/t;
饲料系数=F/(Wt-W0);
蛋白质效率(%)=(Wt-W0)/F×P;
蛋白质沉积率(%)=100×(Wt×Pt-W0×P0)/F×P;
成活率(%)=100×Nt/N0;
肥满度(%)=100×W/L3;
肝体比(%)=100×Wh/W;
脏体比(%)=100×Wv/W。
式中:Nt为终尾数;N0为初尾数;Wt为终末体重(g);W0为初始体重(g);t为养殖时间(d);F为饲料摄入总重(g);P为饲料中粗蛋白质含量(%);Pt为试验鱼终末全鱼粗蛋白质含量(%);P0为试验鱼初始全鱼粗蛋白质含量(%);Wh为肝脏重(g);Wv为内脏重(g);L为体长(cm);W为体重(g)。
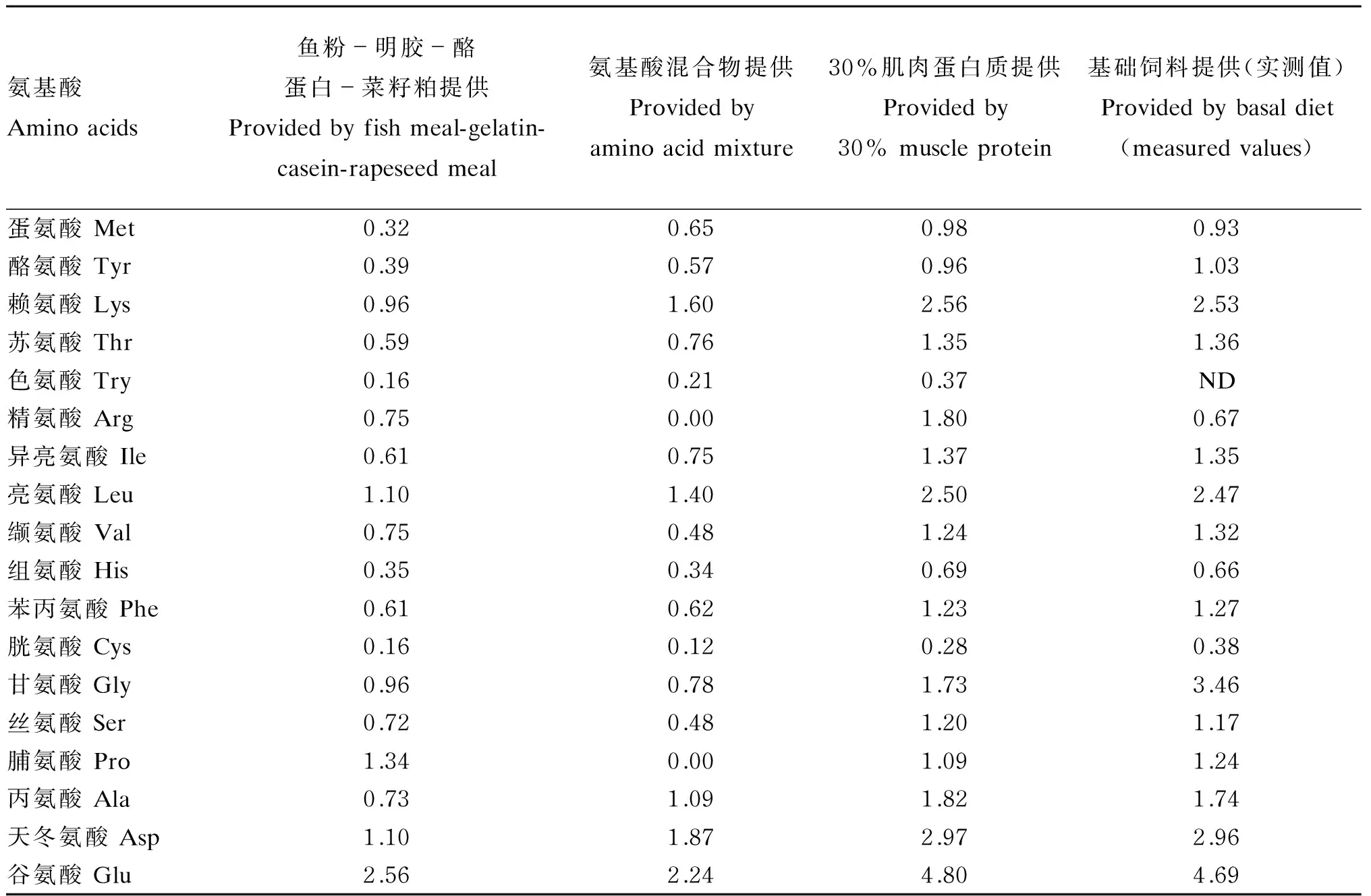
表2 基础饲料中氨基酸组成分析(风干基础)
ND:色氨酸没有检测Try was not detected。
全鱼、肌肉和饲料的常规营养成分采用AOAC(1995)[10]方法测定。其中,粗蛋白质含量采用凯氏定氮法测定,粗脂肪含量采用索氏抽提法测定,粗灰分含量采用马福炉灰化法,总能采用氧弹测热仪(Parr-6200)测定。此外,全鱼和饲料水分含量采用105 ℃烘干恒重法测定,肌肉水分含量采用冷冻干燥法测定;肌肉和饲料中氨基酸含量采用日立L-8900氨基酸分析仪测定(依据GB/T 5009.124—2003)。
血清谷草转氨酶(AST)、谷丙转氨酶(ALT)活性及尿素氮(UN)、甘油三酯(TG)、总胆固醇(T-CHO)、总蛋白(TP)和葡萄糖(GLU)含量使用希森美康原产试剂,采用紫外可见光分光光度法在全自动生化分析仪(Sysmex,CHEMIX-800,日本)上进行测定。
血清和肝脏总超氧化物歧化酶(T-SOD)、总一氧化氮合酶(T-NOS)、溶菌酶(LYZ)活性采用南京建成生物工程研究所生产的试剂盒进行测定。
1.5数据处理
本试验所有数据采用SPSS 18.0统计软件中单因素方差分析(one-way ANOVA)和Duncan氏平均值多重比较法进行差异显著性分析,结果均以平均值±标准差(mean±SD)表示。P<0.05为差异显著。采用二次回归分析对增重率、饲料系数、蛋白质效率与饲料精氨酸水平的关系进行拟合。
2结果
2.1饲料精氨酸水平对吉富罗非鱼生长性能、饲料利用和形态学指标的影响
饲料精氨酸水平对吉富罗非鱼生长性能、饲料利用和形态学指标的影响见表3。随着饲料精氨酸水平的上升,吉富罗非鱼的增重率、特定生长率、蛋白质效率及蛋白质沉积率均呈现先上升后下降的变化趋势,均在1.58%组达到最高值,与其他组差异显著(P<0.05)。随着饲料精氨酸水平的上升,吉富罗非鱼的饲料系数则呈先下降后上升的趋势,在1.58%组达到最低值,与其他组差异显
著(P<0.05)。肝体比和脏体比随着饲料精氨酸水平的上升呈现先下降后上升的趋势,肝体比在饲料精氨酸水平为1.24%时最小,与饲料精氨酸水平为0.67%、0.94%、1.58%时差异不显著(P>0.05),与饲料精氨酸水平为1.86%,2.11%时差异显著(P<0.05);脏体比在饲料精氨酸水平为1.58%时最小,与饲料精氨酸水平为1.58%、1.86%、2.11%时差异不显著(P>0.05),与饲料精氨酸水平为0.67%、0.94%时差异显著(P<0.05)。各组的吉富罗非鱼的成活率、肥满度无显著差异(P>0.05)。

表3 饲料精氨酸水平对吉富罗非鱼生长性能、饲料利用和形态学指标的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.
对吉富罗非鱼的增重率、饲料系数、蛋白质效率与饲料精氨酸水平进行二次曲线回归分析结果分别见图1、图2、图3。增重率(Y1)与饲料精氨酸水平(X)的二次回归方程为Y1=-65.711X2+198.13X+98.384(R2=0.971 1),当饲料精氨酸水平为1.51%(占饲料蛋白质的4.99%)时,增重率最大,为247.73%;饲料系数(Y2)与饲料精氨酸水平(X)的二次回归方程为Y2=0.159 6X2-0.507 4X+1.746 9(R2=0.816 2),当饲料精氨酸水平为1.58%(占饲料蛋白质的5.25%)时,饲料系数最小,为1.34%;蛋白质效率(Y3)与饲料精氨酸水平(X)的二次回归方程为Y3=-0.269 6X2+0.854 6X+1.785 1(R2=0.822 9),当饲料精氨酸水平为1.58%(占饲料蛋白质的5.25%)时,蛋白质效率最大,为2.46%。
2.2饲料精氨酸水平对吉富罗非鱼全鱼和肌肉组成的影响
饲料精氨酸水平对吉富罗非鱼全鱼和肌肉组成的影响见表4。随着饲料精氨酸水平的上升,吉富罗非鱼全鱼粗脂肪含量先降低后升高,在1.58%组达到最低值,与0.67%、2.11%组差异显著(P<0.05),与其余各组差异不显著(P>0.05);全鱼粗灰分含量呈现先上升后稳定的趋势,2.11%组显著高于0.67%组(P<0.05),其他组间无显著差异(P>0.05)。随着饲料精氨酸水平的上升,肌肉粗蛋白质含量先升高后趋于稳定,在1.86%、2.11%组显著高于0.67%、0.94%组(P<0.05),其他组间无显著差异(P>0.05);肌肉粗脂肪含量先升高后降低,在1.58%组达到最高值,与0.67%和2.11%组差异显著(P<0.05),与其余各组差异不显著(P>0.05);肌肉粗灰分含量呈现先降低后升高趋势,在1.58%组达到最低值,与0.67%和2.11%组差异显著(P<0.05),与其余各组差异不显著(P>0.05)。全鱼水分、粗蛋白质以及肌肉水分含量各组间均无显著差异(P>0.05)。

图1 吉富罗非鱼增重率与饲料精氨酸水平的关系

图2 吉富罗非鱼饲料系数与饲料精氨酸水平的关系
2.3饲料精氨酸水平对吉富罗非鱼肌肉氨基酸组成的影响
饲料精氨酸水平对吉富罗非鱼肌肉氨基酸组成的影响见表5。饲料精氨酸水平对肌肉中除酪氨酸、甘氨酸、丙氨酸外的其他氨基酸含量均有显著影响(P<0.05)。随着饲料精氨酸水平的上升,肌肉中各氨基酸(除酪氨酸、甘氨酸、丙氨酸)、必需氨基酸(EAA)、总氨基酸(TAA)含量均呈先上升后下降趋势,且均在1.58%组达到最高值。

图3 吉富罗非鱼蛋白质效率与饲料精氨酸水平的关系
2.4饲料精氨酸水平对吉富罗非鱼血清生化指标的影响
饲料精氨酸水平对吉富罗非鱼血清生化指标的影响见表6。随着饲料精氨酸水平的上升,血清总蛋白含量呈先上升后下降趋势,尿素氮含量呈现先上升后稳定趋势,均在1.58%组达到最高值;血清总胆固醇、甘油三酯和葡萄糖含量及谷草转氨酶活性呈现先下降后上升趋势,谷丙转氨酶活性呈现先下降后稳定趋势,总胆固醇、葡萄糖含量及谷草转氨酶、谷丙转氨酶活性均在1.58%组达到最低值,而甘油三酯含量则在1.24%组达到最低值。
2.5饲料精氨酸水平对吉富罗非鱼部分非特异性免疫指标的影响
饲料精氨酸水平对吉富罗非鱼部分非特异性免疫指标的影响见表7。随着饲料精氨酸水平的上升,血清中T-SOD、T-NOS和LYZ活性呈现先上升后下降的趋势,T-SOD、T-NOS活性在1.58%组达到最高值,与0.67%组相比差异显著(P<0.05);LYZ活性在1.86%组达到最高值,与0.67%、0.94%组相比差异显著(P<0.05)。随着饲料精氨酸水平的上升,肝脏中T-SOD活性基本呈上升趋势,在2.11%组达到最高值,显著高于其他各组(P<0.05);肝脏中T-NOS和LYZ活性则先上升后趋于稳定,分别在1.24%和1.86%组达到最高值。

表4 饲料精氨酸水平对吉富罗非鱼全鱼和肌肉组成的影响

表5 饲料精氨酸水平对吉富罗非鱼肌肉氨基酸组成的影响(干物质基础)
色氨酸没有检测Try was not detected。
3讨论
3.1饲料精氨酸水平对吉富罗非鱼生长性能、饲料利用和形态学指标的影响
精氨酸作为水产动物的一种必需氨基酸,直接参与体内蛋白质合成和鸟氨酸循环,促进机体生长及蛋白质沉积。饲料中添加适量的精氨酸能够提高鱼类的生长性能、饲料效率及蛋白质利用率[11]。在本试验中,饲料中过低或者过高的精氨酸水平对吉富罗非鱼生长性能、饲料利用及蛋白质利用均有不利影响。相关研究表明,当饲料精氨酸水平达到最适水平能显著提高牙鲆[12](Paralichthysolivaceus)、斜带石斑鱼[13](Epinepheluscoioides)、海鲈[14](Dicentrarchuslabrax)的增重率、饲料效率和蛋白质沉积率;相反,饲料中过量的精氨酸反而抑制杂交鲇[15](Clariasgariepinus×Clariasmacrocephalus)、真鲷[16](Pagrusmajor)和印度鲮[17](Cirrhinusmrigala)的生长和对蛋白质的利用。本试验的生长性能结果表明,当饲料中精氨酸水平达到最适后再继续提高,吉富罗非鱼的生长性能趋势是下降的,这有可能是当饲料中精氨酸水平高于最适需要量后,与饲料中的赖氨酸产生了拮抗作用,降低了赖氨酸在机体中的利用,造成生长受阻;同样,这种拮抗关系在禽类和小鼠上也有表现,可能是通过造成氨基酸的大量降解,进而干扰消化过程正常中间产物的代谢,从而降低消化能力来实现的[18]。而本试验的肌肉氨基酸组成结果表明,1.58%、1.86%和2.11%组的肌肉赖氨酸含量与饲料精氨酸水平存在负相关性,直接表明过量的精氨酸影响肌肉中赖氨酸的沉积,出现拮抗作用。但是在鱼类上精氨酸-赖氨酸拮抗还没有统一确凿的证据阐明其拮抗机制,其具体拮抗机制需要进一步深入研究。本试验中饲料精氨酸水平对吉富罗非鱼的肥满度无显著影响,与在金鲳[19](Trachinotusovatus)、草鱼[20](Ctenopharyngodonidellus)所得结果一致。随着饲料精氨酸水平的上升,印度囊鳃鲶(Epinephelusawoara)的肝体比与脏体比均呈上升趋势[21];Zhou等[22]在青石斑鱼(Epinephelusawoara)饲料中添加精氨酸后可以降低肝体比而不影响脏体比,而本试验中吉富罗非鱼的肝体比与脏体比均呈先下降后上升趋势。其原因可能是由于饲料中的精氨酸动用肝胰脏中贮存的能量物质大量合成蛋白质,造成肝胰脏质量与体积降低,肝体比与脏体比也因此而降低。

表6 饲料精氨酸水平对吉富罗非鱼血清生化指标的影响

表7 饲料精氨酸水平对吉富罗非鱼部分非特异性免疫指标的影响
本试验结果表明,当饲料中精氨酸水平为1.51%~1.58%(占饲料蛋白质的4.99%~5.25%),时,吉富罗非鱼的增重率、特定生长率、蛋白质效率及蛋白质沉积率均达到最大,饲料系数达到最小。其适宜的饲料精氨酸与蛋白质比值与遮目鱼[23](ChanoschanosForsskal)的5.25%、军曹鱼[24](Rachycentroncanadum)的5.17%、银大马哈鱼[3]的4.90%相近,但低于武昌鱼[25](Megalobramaamblycephala)的7.23%、尼罗罗非鱼[26](Oreochromisniloticus)(体重6.03 g)的6.24%。这说明鱼类对精氨酸的需求量因鱼种、规格、饲料中蛋白质源及组成蛋白质的氨基酸模式的不同而有所不同。
3.2饲料精氨酸水平对吉富罗非鱼体成分的影响
本试验中,吉富罗非鱼全鱼粗脂肪含量随着饲料精氨酸水平的升高发生显著下降,与黑鲷(Sparusmacrocephlus)全鱼粗脂肪含量受饲料精氨酸水平影响的变化趋势[27]是一致的;肌肉中粗脂肪含量的变化趋势却恰恰相反,与青石斑鱼肌肉粗脂肪含量变化趋势[26]一致,这可能与试验鱼的种类有关。全鱼粗灰分含量随着饲料精氨酸水平的升高先上升后趋于稳定的趋势,Luo等[13]在斜带石斑鱼的研究中也有类似的报道;肌肉粗灰分含量则是呈现先下降后上升的趋势,在1.58%组有最低值,这与在小规格异育银鲫[28](Carassiusauratusgibelio)和南亚野鲮[29](Labeorohita)的研究中得出的结果一致。机体内无机盐的沉积与氨基酸的摄入量有直接的联系,尤其是摄入一定量精氨酸后提高了机体内钙盐的吸收[30],这也可能是引起全鱼与肌肉粗灰分含量差异性的一个原因。本试验中,吉富罗非鱼肌肉的蛋白质合成和沉积量随饲料精氨酸水平的上升而增多;同时,大量研究表明,饲料精氨酸水平的不断升高,全鱼蛋白质的合成效率与沉积率直线上升,但超过其最适需要量后,蛋白质合成效率与沉积率则显著下降[15,25,29],这是由于过量精氨酸导致其余氨基酸降解加快而降低蛋白质的合成与沉积;但在军曹鱼的研究中发现,饲料中精氨酸水平超过最适需要量后,蛋白质合成效率和沉积率并未出现显著差异[24],这可能与鱼种及其规格不同有关。
水产动物通过消化吸收饲料中的氨基酸进而合成机体蛋白来实现蛋白质的沉积。Zhou等[27,31]报道,黑鲷肌肉必需氨基酸含量随着饲料精氨酸摄入量的增多而上升。本试验中,随着饲料精氨酸水平的上升,鱼体肌肉中各种氨基酸含量也随之增加;当精氨酸水平达到最适需要量时,饲料中各种氨基酸的含量达到理想平衡状态,鱼体吸收的氨基酸被更多地参与到蛋白质合成和沉积中;当饲料中精氨酸水平超过最适需要量后,多余的氨基酸则被氧化分解,造成损失,甚至损伤机体。本试验中,吉富罗非鱼肌肉中所有必需氨基酸,除了酪氨酸、甘氨酸、丙氨酸外其余的非必需氨基酸以及总氨基酸量的含量均随着饲料精氨酸的水平的上升呈现先上升后下降的趋势,这与以上研究结果一致。
3.3饲料精氨酸水平对吉富罗非鱼血清生化指标的影响
在血清中,尿素氮是氨基酸代谢的重要产物,而精氨酸是鸟氨酸循环过程中的重要中间体,有报道称虹鳟(Oncorhynchusmykiss)血清中尿素氮的含量与机体精氨酸的摄入量紧密相关[32]。本试验中,随着饲料精氨酸水平的上升,血清尿素氮含量呈上升趋势,这可能是随着饲料精氨酸水平上升直至最佳需要量后,氨基酸达到理想平衡状态,而且精氨酸在鸟氨酸循环中作用增强,蛋白质代谢最旺盛,代谢产物尿素氮含量达到最高;精氨酸水平继续上升,过多的精氨酸造成体内氨基酸理想平衡状态被打破,造成蛋白质合成和沉积量发生下降,同时大量精氨酸进入鸟氨酸循环,增强了其他氨基酸分解代谢,以上原因在本试验中综合造成血清尿素氮含量在饲料精氨酸水平超过最佳需要量后变化并不显著。Alam等[12]对牙鲆的研究也表明,血清中尿素氮含量随饲料中精氨酸水平的上升呈直线上升而后趋于稳定。
血清甘油三酯含量的升降总是伴随着总胆固醇含量的升降[33]。本试验中,血清甘油三酯和总胆固醇含量随饲料精氨酸水平的上升呈先下降后上升趋势,这可能是饲料中精氨酸水平接近最适需要量后,动员体内能量物质氧化供能,促进蛋白质合成与沉积,这也与全鱼粗脂肪含量变化趋势相印证,即均随饲料精氨酸水平的上升呈先下降后上升趋势。谷草转氨酶和谷丙转氨酶的联合脱氨基作用是肝脏氨基酸分解代谢的主要途径,饲料适宜的精氨酸水平抑制了转氨酶的活性,降低氨基酸分解,提高蛋白质合成与沉积。当饲料精氨酸水平过高或过低时,氨基酸分解代谢加强,造成肝细胞通透性增强,血流加快,血清中谷草转氨酶和谷丙转氨酶的活性会显著升高,这与在欧洲黑鲈(Dicentrarchuslabrax)上的研究结果[34]一致。血清总蛋白含量在一定程度上能够反映出机体对蛋白质的合成能力,也跟氨基酸代谢强度有关。Zhou等[31]发现黑鲷血清中总蛋白含量与鱼体生长性能呈高度正相关性,本试验中随着饲料精氨酸水平的上升,血清总蛋白含量先上升后下降,和氨基酸代谢强度关系一致。精氨酸是NO合成前体,由体内一氧化氮合酶(NOS)合成产生[35],起胰岛素样作用。Zhou等[31]报道,提高黑鲷饲料中精氨酸水平后,血清葡萄糖含量显著下降,原因可能是精氨酸代谢产生的NO作为机体内分泌信号传导分子调控肝脏肝糖原的产生,刺激体内葡萄糖含量降低,这也是本试验中血清葡萄糖含量随饲料精氨酸水平上升呈先下降后上升趋势的原因。
3.4饲料精氨酸水平对吉富罗非鱼部分非特异性免疫指标的影响
4结论
饲料中适宜的精氨酸水平能够提升吉富罗非鱼的生长性能,增加蛋白质在机体的沉积,降低饲料系数,增强机体氨基酸营养代谢及非特异免疫力。以增重率、饲料系数和蛋白质效率作为主要评价指标,通过二次回归分析可确定:吉富罗非鱼最佳生长、饲料利用、蛋白质沉积及机体最佳生理健康状态时对饲料中精氨酸的需要量为1.51%~1.58%,占饲料蛋白质的4.99%~5.25%。
参考文献:
[1]BARRETT G C.Chemistry and biochemistry of the amino acids[M].London:Chapman and Hall,1985:157-158.
[2]ZHOU H,CHEN N,QIU X,et al.Arginine requirement and effect of arginine intake on immunity in largemouth bass,Micropterussalmoides[J].Aquaculture Nutrition,2012,18(1):107-116.
[3]LUZZANA U,HARDY R W,HALVER J E.Dietary arginine requirement of fingerling coho salmon (Oncorhynchuskisutch)[J].Aquaculture,1998,163(1/2):137-150.
[4]ZHOU Q C,JIN M,ELMADA Z C,et al.Growth,immune response and resistance toAeromonashydrophilaof juvenile yellow catfish,Pelteobagrusfulvidraco,fed diets with different arginine levels[J].Aquaculture,2015,437:84-91.
[5]CHEN G F,LIU Y,JIANG J,et al.Effect of dietary arginine on the immune response and gene expression in head kidney and spleen following infection of Jian carp withAeromonashydrophila[J].Fish & Shellfish Immunology,2015,44(1):195-202.
[7]SANTIAGO C B,LOVELL R T.Amino acid requirements for growth of nile tilapia[J].The Journal of Nutrition,1988,118(12):1540-1546.
[8]FURUYA W M,FURUYA V R B.Nutritional innovations on amino acids supplementation in nile tilapia diets[J].Revista Brasileira de Zootecnia,2010,39(S):88-94.
[9]MILLAMENA O M,BAUTISTA-TERUEL M N,REYES O S,et al.Requirements of juvenile marine shrimp,Penaeusmonodon(Fabricius) for lysine and arginine[J].Aquaculture,1998,164(1/2/3/4):95-104.
[10]AOAC.Official methods of analysis[S].16th ed.Arlington,VA:Association of Official Analytical Chemists,1995.
[11]WILSON R P,HALVER J E.Protein and amino acid requirements of fishes[J].Annual Review of Nutrition,1986,6:225-244.
[12]ALAM SHAH M,TESHIMA S,KOSHIO S,et al.Arginine requirement of juvenile Japanese flounderParalichthysolivaceusestimated by growth and biochemical parameters[J].Aquaculture,2002,205(1/2):127-140.
[13]LUO Z,LIU Y J,MAI K S,et al.Effects of dietary arginine levels on growth performance and body composition of juvenile grouperEpinepheluscoioides[J].Journal of Applied Ichthyology,2007,23(3):252-257.
[14]TIBALDI E,TULLI F,LANARI D.Arginine requirement and effect of different dietary arginine and lysine levels for fingerling sea bass (Dicentrarchuslabrax)[J].Aquaculture,1994,127(2/3):207-218.
[15]SINGH S,KHAN M A.Dietary arginine requirement of fingerling hybrid clarias (Clariasgariepinus×Clariasmacrocephalus)[J].Aquaculture Research,2007,38(1):17-25.
[16]RAHIMNEJAD S,LEE K J.Dietary arginine requirement of juvenile red sea breamPagrusmajor[J].Aquaculture,2014,434:418-424.
[17]AHMED I,KHAN M A.Dietary arginine requirement of fingerling Indian major carp,Cirrhinusmrigala(Hamilton)[J].Aquaculture Nutrition,2004,10(4):217-225.
[18]罗智,刘永坚,麦康森,等.鱼类精氨酸需求研究进展[J].水产学报,2004,28(4):450-459.
[19]LIN H Z,TAN X H,ZHOU C P,et al.Effect of dietary arginine levels on the growth performance,feed utilization,non-specific immune response and disease resistance of juvenile golden pompanoTrachinotusovatus[J].Aquaculture,2015,437:382-389.
[20]GAO Y J,YANG H J,GUO D Q,et al.Dietary arginine requirement of juvenile grass carpCtenopharyngodonidella(Valenciennes in Cuvier & Valenciennes,1844)[J].Aquaculture Research,2015,46(12):3070-3078.
[21]KHAN M A,ABIDI S F.Dietary arginine requirement ofHeteropneustesfossilisfry (Bloch) based on growth,nutrient retention and haematological parameters[J].Aquaculture Nutrition,2011,17(4):418-428.
[22]ZHOU Q C,ZENG W P,WANG H L,et al.Dietary arginine requirement of juvenile yellow grouperEpinephelusawoara[J].Aquaculture,2012,350-353:175-182.
[23]BORLONGAN I G.Arginine and threonine requirements of milkfish (ChanoschanosForsskal) juveniles[J].Aquaculture,1991,93(4):313-322.
[24]赵红霞,曹俊明,吴建开,等.军曹鱼幼鱼对饲料中精氨酸的需要量[J].华南农业大学学报,2007,28(4):87-90.
[25]REN M C,LIAO Y J,XIE J,et al.Dietary arginine requirement of juvenile blunt snout bream,Megalobramaamblycephala[J].Aquaculture,2013,414-415:229-234.
[26]YUE Y R,ZOU Z Y,ZHU J L,et al.Effects of dietary arginine on growth performance,feed utilization,haematological parameters and non-specific immune responses of juvenile nile tilapia (OreochromisniloticusL.)[J].Aquaculture Research,2015,46(8):1801-1809.
[27]ZHOU F,ZHOU J,SHAO Q J,et al.Effects of arginine-deficient and replete diets on growth performance,digestive enzyme activities and genes expression of black sea bream,Acanthopagrusschlegelii,Juveniles[J].Journal of the World Aquaculture Society,2012,43(6):828-839.
[28]TU Y Q,XIE S Q,HAN D,et al.Dietary arginine requirement for gibel carp (Carassisauratusgibeliovar.CAS Ⅲ) reduces with fish size from 50 g to 150 g associated with modulation of genes involved in TOR signaling pathway[J].Aquaculture,2015,449:37-47.
[29]ABIDI S F,KHAN M A.Dietary arginine requirement of fingerling Indian major carp,Labeorohita(Hamilton) based on growth,nutrient retention efficiencies,RNA/DNA ratio and body composition[J].Journal of Applied Ichthyology,2009,25(6):707-714.
[30]RAZZAGHI A,ALIARABI H,TABATABAEI M M,et al.Effect of dietary cation-anion difference during prepartum and postpartum periods on performance,blood and urine minerals status of holstein dairy cow[J].Asian-Australasian Journal of Animal Sciences,2012,25(4):486-495.
[31]ZHOU F,XIONG W,XIAO J X,et al.Optimum arginine requirement of juvenile black sea bream,Sparusmacrocephalus[J].Aquaculture Research,2010,41(10):e418-e430.
[32]FOURNIER V,GOUILLOU-COUSTANS M F,MÉTAILLER R,et al.Excess dietary arginine affects urea excretion but does not improve N utilisation in rainbow troutOncorhynchusmykissand turbotPsettamaxima[J].Aquaculture,2003,217(1/2/3/4):559-576.
[33]张媛媛,刘波,戈贤平,等.不同脂肪源对异育银鲫生长性能、机体成分、血清生化指标、体组织脂肪酸组成及脂质代谢的影响[J].水产学报,2012,36(7):1111-1118.
[34]PERES H,OLIVA-TELES A.Effect of the dietary essential amino acid pattern on growth,feed utilization and nitrogen metabolism of European sea bass (Dicentrarchuslabrax)[J].Aquaculture,2007,267(1/2/3/4):119-128.
[35]李倬.一氧化氮的生物学意义及应用前景[J].西北民族学院学报:自然科学版,2001,22(3):39-43.
[36]POHLENZ C,BUENTELLO A,HELLAND S L J,et al.Effects of dietary arginine supplementation on growth,protein optimization and innate immune response of channel catfishIctaluruspunctatus(Rafinesque 1818)[J].Aquaculture Research,2014,45(3):491-500.
[37]BUENTELLO J A,GATLIN D M.Nitric oxide production in activated macrophages from channel catfish (Ictaluruspunctatus):influence of dietary arginine and culture media[J].Aquaculture,1999,179(1/2/3/4):513-521.
[38]BUENTELLO J A,REYES-BECERRIL M,DE JESSROMERO-GERALDO M,et al.Effects of dietary arginine on hematological parameters and innate immune function of channel catfish[J].Journal of Aquatic Animal Health,2007,19(3):195-203.
(责任编辑菅景颖)
Dietary Arginine Requirement of Genetically Improved Farmed Tilapia (Oreochromisniloticus)
WU Wenyi1,2JIANG Ming2LIU Wei2WU Fan2TIAN Juan2YANG Changgeng2WEN Hua2*
(1. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306, China;2. Key Laboratory of Freshwater Biodiversity Conservation and Utilization of Ministry of Agriculture,Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Science, Wuhan 430223, China)
Abstract:This experiment was conducted to study the effects of dietary arginine (Arg) level on growth performance, feed utilization, body composition, serum biochemical indices and non-specific immune indices of genetically improved farmed tilapia (GIFT, Oreochromis niloticus), in order to determine the dietary Arg requirement of GIFT. Six isonitrogenous and isoenergetic semipurified diets (contained 30.21% crude protein and 17.77 MJ/kg gross energy) were formulated with 0.65%, 0.94%, 1.24%, 1.58%, 1.86% and 2.11% Arg, respectively. Each experimental diet was fed to 3 net cages for 60 d, and 15 fish with the initial body weight of (81.52±2.00) g in each net cage. The results showed as follows: with the dietary Arg level increasing, the weight gain rate (WGR), specific growth rate (SGR), protein efficiency ratios (PER) and protein deposition efficiency (PDE) were firstly increased and then decreased, and reached their peaks in the 1.58% group, which were significantly higher than those in other groups (P<0.05); whereas the feed conversion ratio (FCR) was firstly decreased and then increased, and reached the lowest value in the 1.58% group, which was significantly lower than that in other groups (P<0.05); the hepatosomatic index (HSI) and viscerosomatic index (VSI) had the same trend with FCR. The change tendency of ash content in muscle and crude lipid content in whole body was similar to FCR with dietary Arg level increasing, but the change tendency of crude lipid content in muscle was similar to WGR and SGR, while the crude protein content in muscle and ash content in whole body were firstly increased with dietary Arg level increasing and then leveled off. Dietary Arg level had no significant effects on the condition factor (CF) and the contents of crude protein in whole body, moisture in whole body and muscle (P>0.05). With the increase of dietary Arg level, the contents of all amino acids (except tyrosine, glycine and alanine), essential amino acids and total amino acids in muscle were firstly decreased and then increased. Dietary Arg level significantly affected the activities of aspartate transaminase (AST), alanine aminotransferase (ALT) and the contents of total protein (TP), urea nitrogen (UN), total cholesterol (T-CHO), glucose (GLU) and triglycerides (TG) in serum (P<0.05), and significantly affected the activities of total superoxide dismutase (T-SOD), total nitric oxide synthase (T-NOS) and lysozyme (LYZ) in liver and serum (P<0.05). Regarding the WGR, FCR and PER as the evaluation indicators, the quadratic regression analysis shows that the dietary Arg requirement of GIFT is 1.51% to 1.58% of diet or 4.99% to 5.25% of dietary protein.[Chinese Journal of Animal Nutrition, 2016, 28(5):1412-1424]
Key words:GIFT (Oreochromis niloticus); arginine; requirement; growth; immune
doi:10.3969/j.issn.1006-267x.2016.05.017
收稿日期:2015-11-17
基金项目:现代农业产业技术体系专项(CARS-49);公益性行业(农业)科研专项(201003020)
作者简介:武文一(1991—),男,河南漯河人,硕士研究生,从事水产动物营养与饲料研究。E-mail: wenyi1991113@163.com *通信作者:文华,研究员,硕士生导师,E-mail: wenhua.hb@163.com
中图分类号:S963
文献标识码:A
文章编号:1006-267X(2016)05-1412-13
*Corresponding author, professor, E-mail: wenhua.hb@163.com
