无精子及少精子症患者染色体及生殖激素水平分析
2016-06-17群俞冬熠韩美艳于红1青岛大学医学院医学微生物学教研室青岛66071山东省青岛市妇女儿童医院遗传科
聂 群俞冬熠韩美艳于 红1. 青岛大学医学院医学微生物学教研室(青岛 66071);.山东省青岛市妇女儿童医院遗传科
无精子及少精子症患者染色体及生殖激素水平分析
聂 群1, 2俞冬熠2韩美艳2于 红1*
1. 青岛大学医学院医学微生物学教研室(青岛266071);2.山东省青岛市妇女儿童医院遗传科
摘要目的分析214例无精子及少精子症患者的染色体核型和生殖激素水平,探讨男性不育患者的遗传学因素。 方法采用外周血培养及G带染色分析214例无精子及少精子症患者的染色体核型,电化学发光法测定其血清生殖激素水平。结果 染色体分析显示,染色体正常核型150例,占样本总量的70.09%;性染色体异核常型39例,占18.22%;染色体多态性变异21例,占9.81%;染色体平衡易位携带者4例,占1.87%。与染色体正常组相比,染色体异常组的卵泡刺激素(FSH)、黄体生成素(LH)和血清泌乳素(PRL)水平显著升高(P<0.05) ,T值呈降低趋势(P<0.05),E2无显著性差异(P>0.05)。结论少精子及无精子症与染色体畸变及血清生殖激素异常密切相关,染色体核型及生殖激素的分析和检测,对临床不育症的诊治有指导意义。
关键词无精子症;少精子症;染色体;性腺甾类激素
我国不孕不育症患者逐年上升,平均发病率为10%~15%,而其中近50%是由男性不育所致[1]。男性不育有很多原因,包括染色体异常、性激素分泌功能紊乱、精索静脉曲张、隐睾、射精障碍和梗阻、生活方式及环境因素等。本文通过分析检测无精子及少精子症患者染色体核型及生殖激素,为临床男性不育症的诊断和治疗提供实验室依据。
资料与方法
一、研究对象
收集2012年1月至2015年10月来我院就诊的214例诊断为无精子症或少精子症(无精子症和少精子症的诊断标准参考WHO精液常规分析标准)的男性不育症患者,年龄22~54岁,平均年龄31.2岁。
二、研究方法
(一)染色体核型分析
常规抽取患者外周血2mL,进行外周血淋巴细胞培养68~72h,经过收获,处理,制片,G显带后进行染色体核型分析,必要时加做C显带进行分析。显微镜下计数30个中期分裂相,选取3~5个分散较好的分裂相进行染色体核型分析,异常核型要加大计数和分析。
(二)生殖激素的测定
取空腹静脉血3m L,分离血清,采用美国Abbott公司电化学发光试剂盒,测定血清泌乳素(prolactin,PRL)、黄体生成素(luteinizing hormone, LH)、卵泡刺激素(follicle-stimulating hormone, FSH)、睾酮(testosterone, T)、雌二醇(estradiol, E2)。本研究血清生殖激素参考值(试剂盒提供):PRL 2.58~18.12 ng/mL,LH 1.14~8.75 mIU/mL,FSH 1.37~13.58 mIU/mL,T 1.56~8.77 ng/ mL,E211~44 pg/mL。
三、统计学分析
采用SPSS 19.0统计学软件进行t检验分析。P<0.05具有显著性差异。
结 果
一、 染色体核型分析结果
214例无精子及少精子标本中发现染色体异常核型64例,占29.91%;其中性染色体异常核型39例,占18.22%;染色体多态性变异21例,占9.81%;染色体平衡易位携带者4例,占1.87%。具体结果见表1。
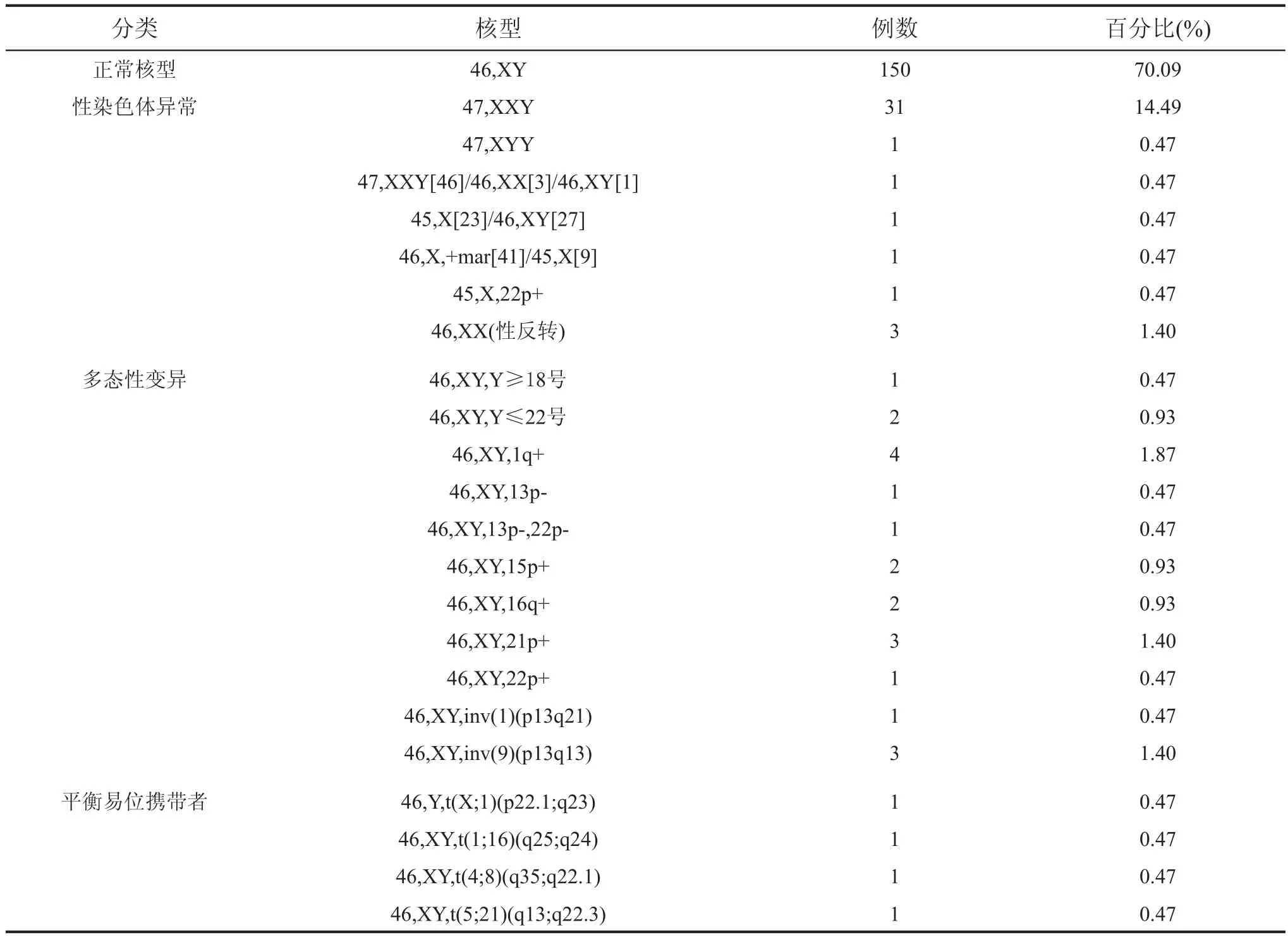
表11 221144例无精子及少精子患者的染色体核型分析
二、 生殖激素检查结果
染色体异常组的FSH、LH、PRL均高于染色体正常组(P<0.05),T值明显低于染色体正常组(P<0.05),E2无统计学差异(P>0.05)(表2)。

表22 染色体正常组和染色体异常组生殖激素水平比较(xx±ss)
讨 论
研究表明遗传缺陷及生殖激素异常是引起男性无精子及少精子症的重要原因之一。染色体异常及相关基因的缺失可以引起男性的生殖器官异常,影响精子的发生进而影响男性的生育能力。而精子发生则依赖激素连续不断的增生与分化。因此,有必要对无精子及少精子症患者进行染色体分析和生殖激素检查。
性染色体异常所致的无精子及少精子症是引起男性不育的重要原因。其中Klinefelter综合征是最常见的性染色体异常的先天性疾病。本文检出31例经典型47, XXY,1例嵌合型47, XXY[46]/46,XX[3]/46,XY[1]。患者多见阴茎短小,睾丸发育不良,第二性征发育延迟甚或不发育,性功能不良,无精子生成。该病是由于在减数分裂过程中精母细胞与卵母细胞的性染色体不分离所致。患者只有一条X染色体有活性,另一条X染色体是失活的,但失活的X染色体是否可以产生剂量效应进而影响男性的生育功能有待进一步研究。本文1例超雄综合征,核型为47, XYY。该病是由于精子在形成过程中发生第二次减数分裂时Y染色体的姐妹染色单体未发生分离所致[2]。该患者表现为身材高大,睾丸发育不全并有精子生成障碍和生育力下降。
本文有3例患者性腺发育为男性,小阴茎,小睾丸,无精子,但染色体核型为46,XX称为性反转综合征。该病的发生机制较复杂,常见的原因包括Yp/Xp末端易位和一条X染色体的短臂上能抑制睾丸不发育的片段丢失或失活,性腺功能低下,不能产生精子或只能产生极少数精子,故无生育能力[3]。另有1名患者因无精子症来做染色体检查,该患者身材矮小,性腺发育不全,外生殖器发育不良,没有精子。染色体核型为45, X[23]/46, XY[27]嵌合体。该病因含有发育不良的性腺组织,其发生性腺母细胞瘤的风险增加,在遗传咨询时应建议其定期诊查。本文还检出1例标记染色体(marker chromosome, mar)的核型。有研究用FISH证实,mar可来源于常染色体,也可是缺失了片段的X成分或Y成分。由于mar的不同来源和构成引起的遗传效应也不相同,3%~4%的性染色体异常的患者可含有mar。
染色体多态一般是指染色体形态的微小差异,如染色体在结构或着色等方面存在的细小差别。本文共检出21例染色体的多态性变异,占样本总数的9.81%。染色体多态性变异一般是在异染色质区,因其不含有编码基因,无转录活性,故一般认为其不产生表型效应。但随着分子生物学技术的发展,越来越多的研究认为多态有一定的临床意义。大Y多态其Y染色体长臂上过度重复的异染色质会造成有丝分裂错误,引起细胞分化的异常[4],影响精子的生成,导致生殖异常。小Y是由于Y染色体存在微小缺失可造成精子发生相关基因的缺失从而导致精子生成障碍。Y染色体长臂包含3个无精子因子(azoospermia factor,AZF)区域:AZFa、AZFb、AZFc,其全部缺失可以引起严重的生精功能障碍[5]。有研究表明对于严重少精子而无法自然生育的AZFc缺失的男性,行ICSI助孕是一个有效的方法[6]。9号臂间倒位是较常见的多态性变异,曾被认为是一种正常的多态变异,不具有病理学意义。近年来,越来越多的学者更倾向于9号臂间倒位是可以引起遗传效应的。它的表型虽然正常,但在第一次减数分裂配子形成过程中会形成倒位环,影响了正常精子的形成,造成无精子症或严重的少精子症。
平衡易位携带者也是造成男性不育的重要原因之一,本文共检出4例,占总数的1.87%,平衡易位是两条染色体发生断裂后相互交换一部分片段再重接而形成的两条新的衍生染色体。它们只是染色体上某些片段的位置发生了改变而没有遗传物质的丢失,因此患者的表型和智力都是正常的。染色体发生易位时,生殖细胞在减数分裂过程中同源染色体互换、分离、配对能产生18种不同配子,这些配子与正常配子结合后形成的合子中,1种是正常的合子,1种是表型正常的易位携带者,其余16种均为部分单体或三体[7],可导致胎儿畸形,死胎及流产。因此当男方为平衡易位携带者,女方妊娠后应在合适的孕周抽取绒毛细胞或羊水做产前诊断,检查胎儿的染色体是否正常,从而决定是否继续妊娠。
研究表明生殖激素和男性不育症密切相关。调节人体生殖功能的性激素受下丘脑-垂体-性腺轴的调控,其中FSH对支持细胞的增殖和精子的发生起着关键性的作用,LH可刺激间质细胞合成和分泌T,促进精子生成,FSH与LH在调控男性生殖功能方面有协同作用。有关文献报道[8],血清FSH水平升高使睾丸支持细胞-生精小管嵌合体受损,累及间质细胞,使LH水平随之升高。当LH显著升高时,表示睾丸受损不可逆转。T是最重要的雄激素,由睾丸间质细胞分泌,与LH有拮抗作用。PRL是由垂体前叶分泌的应激性激素,作用于精子成熟的最后阶段。当PRL升高时,可影响促性腺激素释放激素(GnRH)释放及垂体对GnRH的反应,使FSH和LH分泌减少,T合成分泌减少[9, 10]。本研究结果显示,染色体异常组的FSH、LH、PRL水平均高于染色体正常组,而T值明显低于染色体正常组,E2无显著性变化。表明血清生殖激素水平对男性不育症的病因分析有指导意义。
综上所述,少精子及无精子症与染色体畸变及多种生殖激素异常密切相关,其机制非常复杂。临床上对于无精子及少精子症患者,应及早进行染色体和生殖激素的检查,必要时作分子遗传学检测,以便明确不育症患者的真正病因,更好地为患者进行有效的遗传咨询和诊疗。
参 考 文 献
1 张思仲. 染色体诊断与遗传咨询中的多态性问题和困惑.中华医学遗传学杂志 2010; 27(6): 707-709
2 江峰, 陈美芳, 张月萍, 等. 304例染色体异常的不育男性细胞遗传学分析及精液状况的关系. 中国男科学杂志 2010; 24(10): 28-32
3唐开发, 徐绍源, 张杜平, 等. 46,XX 男性综合症患者细胞分子遗传学研究.中国男科学杂志 2011; 25(6): 18-21
4 田佩玲, 叶嘉玲, 陈平乐, 等. 大Y染色体核型376例分析. 中国男科学杂志 2004; 18(2): 32-33
5刘玉林, 张伟, 李朋, 等. Y染色体AZFc部分缺失或全缺失对精子发生的影响.中国男科学杂志2009; 23(9): 58-60
6 朱晓斌, 冯云, 纪冬梅, 等. Y染色体微缺失检测及生殖激素水平研究在非梗阻性无精子症患者睾丸穿刺中的意义. 中国男科学杂志 2010; 24(4): 30-32,35
7 Chiu RW, Akolekar R, Zheng YW, et al. Non-invasive prenatal assessment of trisomy 21 by multiplexed maternal plasma DNA sequencing; large scale validity study. BMJ 2011; 342: c7401
8Merino G, Martinez-Chequer JG, Chan RG, etal. Relationship between hormone levels and testicular biopsies of azoospermic men. Arch Androl 1999; 42(3):145-149
9Barratt CL, Aitken RJ, Bjorndahl L,et al. Sperm DNA:organization,protection and vulnera bility: from basic science to clinical applications-aposition report. Hum Reprod 2010; 25(4): 824-838
10 Bungum M, Bungum L, Giwercman A. Sperm chromatin structure assay(SCSA): a tool in diagnosis and treatment of infertility. Asian J Androl 2011; 13(1): 69-75
(2016-02-05收稿)
doi:10.3969/j.issn.1008-0848.2016.03.008
中图分类号R 698.2
*通讯作者,E-mail: yuhong0532@126.com
Analysis of chromosome and reproduction hormone in patients with azoospermia and oligospemia
Nie Qun1, 2, Yu Dongyi2, Han Meiyan2,Yu Hong1*
1.Department of Medical Microbiology, Medical College, Qingdao University,Qingdao,266071;2. Shangdong Qingdao Women and children Hospital Corresponding author: Yu Hong,E-mail: yuhong0532@126.com
AbstractObjective To analyze chromosome karyotype and reproductive hormones of 214 patients with azoospermia and oligospermia, and explore the genetic factors of male infertility. MetthhooddssTotal of 214 cases of patients with azoospermia and oligospermia were recruited in the study, karyotype analysis was performed in peripheral blood lymphotytes using stand G-banding, and levels of reproductive hormones were detected by electrochemoluminescence method. RessuullttssG-banding showed that the number of normal chromosome karyotype was 150 cases, accounting for 70.09%; the number of abnormal sex chromosome karyotype was 39 cases, accounting for 18.22%; 21 cases of chromosome polymorphism variation, accounting for 9.81%;4 cases of chromosome balanced translocation carriers, accounting for 1.87%. levels of FSH, LH and PRL in chromosome abnormality group were higher than those in normal chromosome group(P<0.05), T value showed a trend of drop(P<0.05), and level of E2had no signifi cant change(P>0.05). Conclusionn Chromosome aberrations and reproductive hormones play an important roles in azoospermia and oligospermia. Analysis of chromosome karyotype and reproductive hormones can provide guidance for the diagnosis and treatment of infertility.
Key wordsazoospermia;oligospermia;chromosomes;gonadal steroid hormones
