乳腺癌术前短期化疗对P-糖蛋白表达的影响
2016-06-15包芸李琼唐峰
包芸+李琼+唐峰
摘 要 目的:观察乳腺癌患者术前短期化疗对肿瘤细胞中P -糖蛋白(P-gp)以及相关因子表达的调节,并探讨其临床意义。方法:选择2002—2007年40例乳腺浸润性导管癌患者,均经紫杉醇和表阿霉素治疗后行改良根治术。对手术标本进行HE染色,比较患者化疗前、后肿瘤大小、组织形态学变化及局部淋巴结转移情况。采用免疫组化法检测P-gp及相关因子[表皮生长因子受体(EGFR)、C-erbB-2、CD147、Ki67)表达。结果:化疗后,40例患者中10例出现大量炎性细胞浸润,4例有大片肿瘤组织坏死,肿瘤间质胶原纤维弥漫增生,肿瘤细胞密度减少,散在分布。化疗前、后P-gp阳性率分别为35.0%和60.0%(P>0.05),EGFR阳性率分别为42.5%和80.0%(P<0.01);化疗后C-erbB-2、CD147、Ki67阳性率均较化疗前明显下降。EGFR、P-gp和C-erbB-2表达与临床分期、肿瘤大小、细胞核分级无关;化疗前P-gp表达与EGFR、C-erbB-2和CD147无明显相关性。结论:乳腺癌术前短期化疗可有效杀伤肿瘤细胞,诱导EGFR表达增强,但并不引起CD147等会导致肿瘤转移的下游因子表达,提示在肿瘤进展中肿瘤细胞的原发性耐药与其侵袭力可能并无关联。
关键词 乳腺癌 P -糖蛋白 表皮生长因子受体 化疗
中图分类号:R737.9 文献标志码:A 文章编号:1006-1533(2016)10-0006-05
The effect of short-term chemotherapy preoperatively on P-glycoprotein expression in breast cancer
BAO Yun, LI Qiong, TANG Feng
(Department of Pathology, Huashan Hospital, Fudan University, Shanghai 200040, China)
ABSTRACT Objective: To observe the effect of short-term chemotherapy preoperatively on the expression of P-glycoprotein(P-gp)and some related factors in patients with breast cancer and its clinical significance. Methods: Forty patients with invasive ductal breast cancer confirmed by biopsy were treated with paclitaxel and epirubicin for 2-3 courses followed by modified radical mastectomy from 2002 to 2007. The surgical specimens were stained using HE, and tumor size, histological changes, and the local lymph node metastasis were compaired before and after chemotherapy. The expressions of P-gp and some related factors of epidermal growth factor receptor(EGFR), C-erbB-2, CD147 and Ki67 were assessed by immunohistochemistry. Results: After chemotherapy, a large number of inflammatory cell infiltration was found in 10 cases and necrosis in 4 cases. It showed that the collagen fibers were proliferated and the density of cancer cells was reduced and scattered. The positive rate was 35.0% and 60.0% in P-gp expression(P>0.05), and was 42.5% and 80.0% in EGFR expression befor and after chemotherapy(P<0.01), respecitvely. The positive rates of C-erbB-2, CD147 and Ki67 were decreased after chemotherapy. The expressions of P-gp, EGFR and C-erbB-2 had no relation with clinical stage, tumor size and grade of the nucleus, so as the expression of P-gp, befor chemotherapy, with EGFR, C-erbB-2 and CD147. Conclusion: Short-term chemotherapy can kill tumor cells and increase the expression of EGFR, but does not alter the expressions of downstream factors such as CD147 that enough to cause the metastasis of tumor cells, which indicates that during the progression of breast cancer there was no relationship between invasion/ metastasis of tumor cells and primary drug resistance.
KEY WORDS breast cancer; P-glycoprotein; epidermal growth factor receptor; chemotherapy
化疗可有效缓解甚至治愈某些人类肿瘤,但在临床上,肿瘤细胞在化疗进程中普遍会产生耐药性,特别是多药耐药(MDR),从而严重影响肿瘤治疗的临床疗效。肿瘤细胞耐药机制较复杂[1-2],与细胞周期、增生状态及生化机制如解毒、细胞药物运输或DNA复制和修复有关[3]。已发现跨膜药泵基因扩增是造成耐药的最重要原因,对MDR研究最多的是MDR1基因。该基因编码的细胞膜上的P-糖蛋白(P-gp)能将化疗药物从细胞内泵至细胞外而引起肿瘤耐药,当肿瘤暴露于某一化疗药物后,可以上调MDR1基因表达,从而诱发肿瘤对其他多种化疗药物耐受。有研究证实P-gp表达与CD147表达密切相关,提示肿瘤细胞的获得性耐药与其侵袭性增强
密切相关[4]。
目前,乳腺癌术前化疗因具有可使瘤体缩小、降低肿瘤细胞活力、防止术中瘤细胞播散和转移等而普遍采用。但是,短期化疗对肿瘤细胞的MDR和肿瘤转移产生的效果尚少有评价。本研究对化疗前、后乳腺癌组织进行检测,探讨乳腺癌中P-gp表达与表皮生长因子受体(EGFR)、C-erbB-2、CD147表达间的关联,以期发现肿瘤细胞原发性耐药与侵袭力间的关系。
1 材料及方法
1.1 一般资料
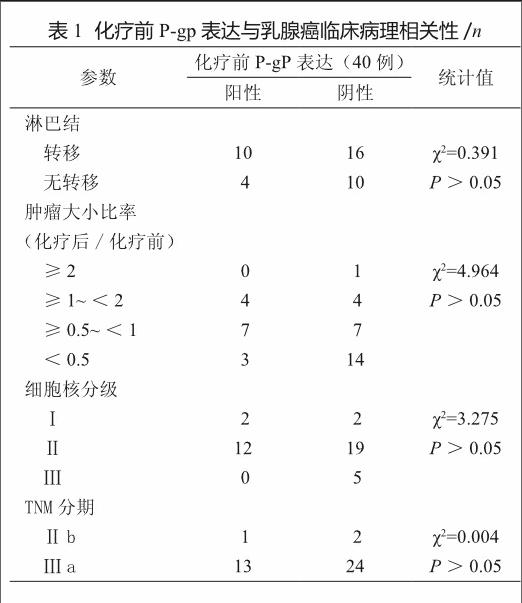
收集上海复旦大学附属华山医院2002—2007年乳腺浸润性导管癌患者40例,年龄31~68岁,平均51岁,均经活检病理证实,在行乳腺改良根治术前经紫杉醇及表阿霉素治疗2~3个疗程。按TNM分期,Ⅲa 37例,其中34例肿瘤直径>5 cm,3例<5 cm;Ⅱb 3例,肿瘤直径均<5 cm。手术后证实淋巴结转移26例(65.0%)。
1.2 方法
1.2.1 病理观察
取乳腺穿刺标本(大部分为条索状组织)5~10条,长度1.0~1.2 cm,直径0.1~0.2 cm;乳腺手术标本分别于肿块及交界处取材(1 cm×1 cm×0.3 cm),所有标本用4%甲醛液固定,石蜡包埋,切片(厚4 mm),常规HE染色。
1.2.2 免疫组化检测
实验中P-gp(Labvision)、EGFR(Labvision)、C-erbB-2(Dako)、CD147(Dako)和Ki67(Novocastia)一抗均按1∶50稀释,采用EnVision两步法染色。①石蜡切片经二甲苯脱蜡3次。②经100%、95%、80%乙醇蒸馏水水化,蒸馏水充分洗净。③阻断内源性过氧化物酶:0.3% H2O2甲醇液置室温10 min,TBS(0.05 mol/L,pH 7.6,下同)洗5 min×3次。④微波高温法抗原修复:枸橼酸缓冲液(0.01 mol/L,pH 6.0)高温预热10 min,将脱蜡水化后的组织切片置于耐高温塑料切片架上,放入已沸腾的缓冲液中,中火加热5 min×2次,低火保温5 min,取出微波盒冷却至室温,取出玻片,先用蒸馏水洗2次后用TBS洗5 min×3次。⑤去除组织非特异性吸附:5%小牛血清37 ℃孵育20 min(无需洗净)。⑥滴加一抗(阴性对照片以TBS代替一抗)37 ℃温箱1 h,TBS洗5 min×3次。⑦滴加二抗:EnVision抗鼠工作液,37 ℃温箱1 h,TBS洗5 min×3次。⑧辣根过氧化物酶新鲜配制DAB显色液:10 ml TBS液中加入4 mg DAB,充分混匀,滴加0.5 ml H2O2,室温下显色10 min。⑨常规苏木精复染细胞核1 min,充分水洗,烘干,二甲苯透明,中性树胶封片。
1.2.3 免疫组化结果评定
P-gp:阳性反应物主要表达于肿瘤细胞膜上,细胞质中也有少量表达,呈棕黄色颗粒状。以肿瘤细胞染色强弱程度进行半定量测定,每张切片随机选取10个高倍视野,以阳性细胞所占比例的平均值定义为阳性细胞率(%)。判断标准:阳性细胞≤10%为(-);>10%~25%为(+);>25%~75%为(++);>75%为(+++),并重复2次。
EGFR和CD147:阳性反应物质大多位于细胞膜,细胞质内亦有少量。光镜下观察5个具有代表性的高倍视野,分别计数200个细胞,共1 000个细胞。按阳性细胞所占比例分别计分,阳性细胞百分数0计0分,1%~50%计1分,51%~80%计2分,>80%计3分。染色深度以大多数细胞的呈色反应为准,不着色计0分,浅棕黄色计1分,棕黄色计2分,深棕黄色计3分。根据这2项指标的分数之和分为4级,0分为阴性(-),1~2分为弱阳性(+),3~4分为阳性(++),5~6分为强阳性(+++)。
C-erbB-2:阳性表达为细胞膜呈清晰的棕色染色。强度评定分为-、+、++和+++,肿瘤细胞无着色为(-),<10%的肿瘤细胞胞膜轻度着色为(+),>30%的肿瘤细胞出现连续而完整的强胞膜阳性为(+++),介于中间者为(++)。
Ki67蛋白:阳性染色为肿瘤细胞核呈棕黄色颗粒,每张切片随机选取10个高倍视野,以阳性细胞所占比例的平均值定义为阳性细胞率(%)。判断标准:阳性细胞≤10%为(-);>10%~25%为(+);>25%~75%为(++);>75%为(+++),并重复2次。
1.3 统计学处理
采用SPSS 15.0软件进行统计学分析,计数资料用百分率表示,行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 病理观察
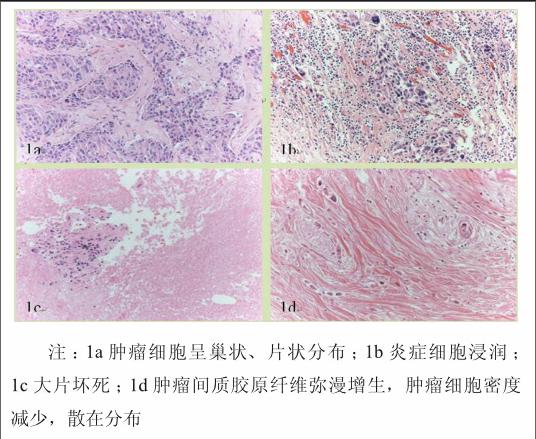
大体可见乳腺组织呈灰红和灰黄色。光镜下见化疗前肿瘤细胞呈巢状、片状分布(图1a),肿瘤伴坏死1例(2.5%),伴炎症细胞浸润2例(5.0%)。细胞核有异形,核分级Ⅰ级4例,Ⅱ级31例,Ⅲ级5例。化疗后肿瘤组织出现明显变化,主要改变有10例出现大量炎症细胞浸润(图1b),其中4例伴有大片坏死(图1c);肿瘤间质胶原纤维弥漫增生,肿瘤细胞密度减少,呈散在分布(图1d)。

图1 肿瘤细胞化疗前、后形态学特征(HE,×200)
2.2 免疫组化观察
40例患者中,化疗前P-gp表达阴性26例,阳性14例(35.0%),化疗后表达阴性16例,阳性24例(60.0%),治疗前、后P-gp表达差异无统计学意义(P>0.05)。
2.3 P-gp与临床及各蛋白间的关系
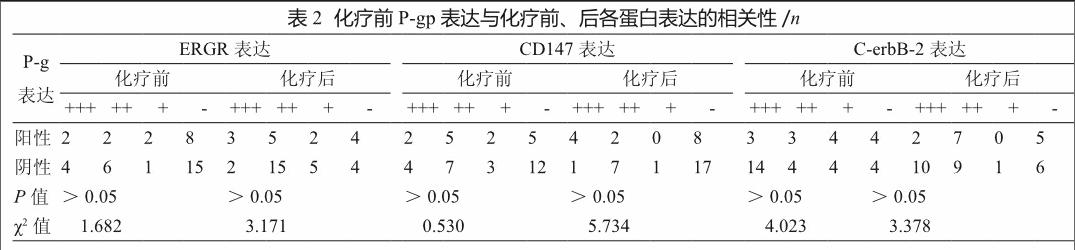
P-gp表达与肿瘤临床分期、大小、细胞核分级及淋巴结转移无明显相关性(表1);与EGFR、C-erbB-2、CD147蛋白表达均无明显相关性(表2)。
3 讨论
肿瘤细胞对化疗药物产生耐药性是造成化疗失败的主要原因,体内外研究发现,肿瘤耐药的分子机制很复杂,目前认为主要有4个方面:①跨膜药泵基因的扩增或过表达,这类基因以MDR1(产生P-gp)最为重要[5-7],另外,还发现一些耐药相关分子如多药耐药相关蛋白(MRP);②细胞内一些蛋白酶的变化引起细胞解毒功能增强,如谷胱甘肽S转移酶Pi的表达或活性增加;③核酶DNA拓扑异构酶Ⅱ含量减少或性质改变;④其他因素,其中跨膜药泵基因的扩增被认为是造成耐药的最重要原因。
MDR1定位于第7号染色体,基因蛋白编码区由27个外显子组成,其编码的170×103的P-gp属于腺苷三磷酸结合蛋白超家族成员,P-gp的主要生理功能可能与各种保护屏障有关,在耐药细胞膜上过表达。P-gp具有ATP依赖性药物泵功能,当肿瘤细胞与抗癌药物接触时,脂溶性药物按浓度梯度进入细胞,在细胞内,药物与P-gp结合,同时水解ATP获得能量,将药物从细胞内泵出,细胞内药物浓度不断下降,使药物对细胞的损伤减弱直至消失,最终出现耐药[8-10]。
Yang等[8]将耐药小鼠白血病细胞接种于同种小鼠腹腔后用P-gp相关药物治疗,与接种耐药肿瘤细胞后用P-gp不相关药物治疗或接种不耐药肿瘤细胞用同样化疗药物相比,其肝脏转移程度更为明显,小鼠带瘤生存时间也较短。这一现象提示P-gp的表达及其转运药物能力与肿瘤细胞的侵袭转移之间可能存在一定的内在联系。Yang等[4]的后续研究发现,阿霉素诱导的耐药乳腺癌细胞株(MCF7/AdrR)CD147和基质金属蛋白酶(MMP)的表达明显高于不耐药细胞,提示耐药细胞的高侵袭性可能与CD147的表达增强有关。文献中也有报道肿瘤细胞分泌的CD147可以通过自分泌和旁分泌作用刺激肿瘤周围成纤维细胞、血管内皮细胞和肿瘤细胞自身产生多种MMP降解周围基质而引起肿瘤浸润转移[11]。
然而,少有P-gp与CD147的内在联系以及MDR药物在其中作用的报道,特别是恶性肿瘤术前短期化疗中是否存在上述现象亦少见报道。我们前期的体外研究发现,MDR药物可以引起MCF7/AdrR细胞EGFR表达增强,而非MDR相关药物(博莱霉素)或用MDR药物作用于不耐药肿瘤细胞(MCF7)均无此作用。我们的实验以及文献报道均揭示EGFR能刺激肿瘤细胞产生CD147,从而诱导P-gp表达[12-13]。EGFR还参与了P-gp的磷酸化,从而使肿瘤细胞内药物的蓄积总量持续下降,引发耐药[14]。用P-gp中和抗体Hyb-241预处理MCF7/ Adr细胞后,可以出现与EGFR抑制剂AG1478相同的作用,即MDR药物的上述作用被完全阻断[15],说明MDR药物促进肿瘤细胞侵袭转移的机制中有P-gp功能活化的参与。
本研究发现,术前乳腺癌组织P-gp表达与MDR药物治疗后肿瘤组织EGFR、C-erbB-2和CD147无明显相关性,提示乳腺癌的原发性耐药与肿瘤侵袭力增强之间可能并无关联。这与我们以前发现不耐药乳腺癌细胞MCF7经MDR1基因转染后可以获得耐药性,但并不呈现上述MCF7/AdrR的类似表现相一致。这可能预示在化疗药物诱导MDR过程中还有目前尚不知的肿瘤细胞结构或功能变化,而这些变化是MDR药物促进肿瘤细胞侵袭转移所必需。
综上所述,本研究显示原发性MDR(术前肿瘤细胞表达P-gp)可能与肿瘤细胞侵袭能力之间并无内在联系,以往体外实验中MDR药物促进MDR细胞侵袭和转移的内在机制有待进一步探讨。临床上肿瘤术前短期化疗是安全的。
参考文献
[1] Lacueva FJ, Teruel A, Calpena R, et al. Detection of P-glycoprotein in frozen and paraffin-embedded gastric adenocarcinoma tissues using a panel of monoclonal antibodies[J]. Histopathology, 1998, 32(4): 328-334.
[2] Meijer GA, Schroeijers AB, Flens MJ, et al. Increased expression of multidrug resistance related proteins Pgp, MRP1, and LRP/MVP occurs early in colorectal carcinogenesis[J]. J Clin Pathol, 1999, 52(6): 450-454.
[3] Hutter G, Sinha P. Proteomics for studying cancer cells and the development of chemoresistance[J]. Proteomics, 2001, 1(10): 1233-1248.
[4] Yang JM, Xu Z, Wu H, et al. Overexpression of extracellular matrix metalloproteinase inducer in multidrug resistant cancer cells[J]. Mol Cancer Res, 2003, 1(6): 420-427.
[5] Hoffmann J, Schmidt-Peter P, Hansch W, et al. Anticancer drug sensitivity and expression of multidrug resistance markersin early passage human sarcomas[J]. Clin Cancer Res, 1999, 5(8): 2198-2204.
[6] Arts HJ, Katsaros D, Vries EGD, et al. Drug resistanceassociated markers P-glycoprotein, multidrug resistance- associated protein 1, multidrug resistance-associated protein 2, and lung resistance[J]. Clin Cancer Res, 1999, 5(10): 2798-2805.
[7] Robey-Cafferty SS, Bruner JM, Caffery LL. P-glycoprotein expression in gastroesophageal adenocarcinomas, their metastases, and surrounding mucosa: a mapping study[J]. Mod Pathol, 1991, 4(6): 694-697.
[8] Yang JM, Yang GY, Medina DJ, et al. Treatment of multidrug resistant (MDR1) murine leukemia with P-glycoprotein substrates accelerates the course of the disease[J]. Biochem Biophys Res Commun, 1999, 266(1): 167-173.
[9] Leeuwen FW, Buckle T, Kersbergen A, et al. Noninvasive functional imaging of P-glycoprotein-mediated doxorubicin resistance in a mouse model of hereditary breast cancer to predict response, and assign P-gp inhibitor sensitivity[J]. Eur J Nucl Med Mol Imaging, 2009, 36(3): 406-412.
[10] Ambudkar SV, Kimchi-Sarfaty C, Sauna ZE, et al. P-glycoprotein: from genomics to mechanism[J]. Oncogene, 2003, 22(47): 7468-7485.
[11] Guo H, Li R, Zucker S, et al. EMMPRIN (CD147), an inducer of matrix metalloproteinase synthesis, alsobinds interstitial collagenase to the tumor cell surface[J]. Cancer Res, 2000, 60(4): 888-891.
[12] Menashi S, Serova M, Ma L, et al. Regulation of extracellular matrix metalloproteinase inducer and matrix metalloproteinase expression by amphiregulin in transformed human breast epithelial cells[J]. Cancer Res, 2003, 63(22): 7575-7580.
[13] Shi Y, Ouyang P, Sugrue SP. Characterization of the gene encoding pinin/DRS/memA and evidence for itspotential tumor suppressor function[J]. Oncogene, 2000, 19(2): 289-297.
[14] Yang JM, Sullivan GF, Hait WN. Regulation of the function of P-glycoprotein by epidermal growth factor through phospholipase C[J]. Biochem Pharmacol, 1997, 53(11): 1597-1604.
[15] Li QQ, Wang WJ, Xu JD, et al. Up-regulation of CD147 and matrix metalloproteinase-2, -9 induced by P-glycoprotein substrates in multidrug resistant breast cancer cells[J]. Cancer Sci, 2007, 98(11): 1767-1774.
