人参皂苷Rg1对非酒精性脂肪肝病大鼠脂肪酸β-氧化的改善作用研究
2016-06-15廖文云
廖文云,徐 丹
人参皂苷Rg1对非酒精性脂肪肝病大鼠脂肪酸β-氧化的改善作用研究
廖文云1,徐丹2△
[摘要]目的研究人参皂苷Rg1对非酒精性脂肪肝病(NAFLD)大鼠β-氧化的作用。方法将120只SD大鼠分为对照组(CON组)、模型组(HFD组)及人参皂苷Rg1低、中、高剂量组(GLD、GMD、GHD组)和熊去氧胆酸钠治疗组(PDT组),每组20只,分别于治疗4、8周后处死大鼠各半,肝脏切片HE染色,检测肝功能、血脂、肝脏脂酰CoA合成酶1(CoASH1)、脂酰肉毒碱转移酶I(CATI)及酰基辅酶A氧化酶1(ACOX1) mRNA和蛋白表达。结果治疗4周后,肝脏HE染色GHD组有改善,PDT、GLD、GHD组未见改善;8周后,PDT组与GLD组仍有少量脂肪颗粒聚集,GMD组和GHD组看不到任何脂滴浸润;治疗4周后,PDT、GLD、GMD、GHD组与HFD组相比,天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(AKP)、总胆固醇(TC)、三酰甘油(TG)及低密度脂蛋白胆固醇(LDL-C)明显降低(P<0.05),8周后进一步降低;治疗4周后,高密度脂蛋白胆固醇(HDL-C)4个组均升高,8周后几乎恢复到对照组的水平;治疗4周后肝脏组织CoASH1、CACTI及ACOX1表达4个组均显著升高(P<0.05),治疗8周后改善更为明显。结论人参皂苷Rg1可通过调节大鼠β-氧化来改善脂代谢及肝功能。
[关键词]人参皂苷Rg1;非酒精性脂肪肝病;脂酰CoA合成酶;脂酰肉毒碱转移酶I;酰基辅酶A氧化酶1
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是临床中较为常见的一种代谢性肝病,随着人们饮食习惯的改变,该病有增加的趋势。最新的研究显示我国NAFLD发病率已高达25%,已经成为仅次于病毒性肝炎的第2大疾病[1-2]。人参皂苷Rg1是从人参以及三七中提取的一种皂苷单体化合物,近年来关于其在药学领域中的价值受到了众多学者的关注[3],Tushuizen等[4]研究显示人参皂苷Rg1有促进大鼠海马神经发育的作用,Zhou等[5]研究显示人参皂苷Rg1对肿瘤有很好的抑制作用,同时其对糖尿病糖代谢也有一定的促进作用。目前关于人参皂苷Rg1对NAFLD的作用也有文献报道[6],但具体机制尚不清楚,本文拟观察人参皂苷Rg1对NAFLD大鼠β-氧化的作用,现报道如下。
1材料与方法
1.1实验动物雄性SD大鼠120只,体质量160~180 g,大鼠[合格证号:SYXK(滇)2011-0004]、基础饲料均由昆明医科大学动物实验部提供。
1.2试剂猪油市场自购;胆固醇及胆酸钠购自上海金穗生物公司;人参皂苷Rg1由昆明医科大学药学院提供;三酰甘油(triglycerides,TG)、胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(ligh-density lipoprotein-C,LDL-C)及高密度脂蛋白胆固醇(high-density lipoprotein-C,HDL-C)试剂盒由南京建成生物提供;丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)及碱性磷酸酶(AKP)等试剂盒购自上海达为科生物科技有限公司;引物为上海英骏生物有限公司生产;总RNA提取试剂盒购自天根生物有限公司;琼脂糖购自美国Invitrogen生物公司;抗体肉碱酰基转移酶Ⅰ(carnitine acyltransferase I,CATI),脂酰CoA合成酶1(Acyl-CoA synthetase1,CoASH1)及乙酰辅酶A氧化酶1(Acyl-CoA oxidase1,ACOX1)购自美国Santa Cruz公司,二抗购于中杉金桥公司。
1.3方法
1.3.1大鼠饲料构成和造模方法大鼠高脂饲料的配方完全参考国际上目前流行的配方[7],所配制饲料由昆明医科大学动物试验部加工完成,具体成分为:猪油20%、TC 2%、胆酸钠0.5%及常规饲料营养成分构成。在造模期间所有造模组大鼠均给予充足的饲料和高浓度红糖水饮用,造模时间为8周,8周后每组各取二组大鼠检测其肝功能以及行肝脏HE染色检验是否造模成功。
1.3.2NAFLD模型的建立及给药方法为防止造模过程中大鼠死亡,本次共饲养150只大鼠,期间20只大鼠给予普通饲料作为空白对照组(CON组),剩余130只大鼠给予造模,期间有16只死亡,将造模成功的114只大鼠根据给药剂量的不同随机分组,共分为5组,其中高脂饮食组(不给予后期治疗,HFD组,n=20)、人参皂苷Rg1低、中、高剂量干预组(GLD、GMD、GHD组,n=24)及熊去氧胆酸钠治疗组(PDT组,n=22),造模成功后CON组及HFD组均不予任何干涉,GLD、GMD、GHD组分别给予人参皂苷Rg1 5、10、20 mg·kg-1·d-1治疗。
1.3.3标本采集在大鼠处死前严格控制卫生,所有手术人员均消毒且佩戴手套及口罩;之后开始采集标本,采集时首先称取大鼠体质量、然后给予水合氯醛麻醉;麻醉后将大鼠固定于解剖板上暴露腹腔,手术刀沿腹中线迅速切开腹部取出肝脏,之后使用注射器从心脏取血,将血液离心后和肝脏置于-80 ℃冰箱保存。
1.3.4病理学检查及相关指标检测方法病理学检查采用HE染色,取样时统一取肝左叶置于4%的中性甲醛中浸泡,之后交由云南省第一人民医院病理科完成。TC、TG、HDL-C以及LDL-C等指标的测定严格按照试剂盒说明书完成。
1.3.5RT-PCR检测mRNA的表达用微量天平精确称取30 mg肝脏组织,立即用相应试剂盒提取总RNA并定量,将定量后的RNA采用超纯水调平,之后根据逆转录试剂盒提示每组取2 μg逆转录cDNA,逆转录完成后将cDNA进行产物扩增,扩增条件为94 ℃预变性2 min,94 ℃变性30 s,48 ℃退火30 s,72 ℃延伸2 min,共35个循环;最后给予72 ℃总延伸5 min。扩增完成后进行琼脂电泳,拍照收集条带图像,Image J计算荧光强度值,每组实验重复3次。CoASH1引物设计为,Primer A:5′-CTT CGG TCG TGA TGA AAG GA-3′,Primer B:5′-ATA GCT GAC GGT TGC CGT AC-3′,产物长度为158 bp。CATI引物设计为,Primer A:5′-CTT GCA TGG CTG TGA GAA GA-3′,Primer B :5′-AGT CGG ACT GCC TTC AGT GA-3′,产物长度为188 bp。ACOX1引物设计为,Primer A:5′-GTT ACG TGG CGC ATT GAA GA-3′,Primer B :5′-TAG TTC CTC GCG GGA ACG AT-3′,产物长度为169 bp。β-actin引物设计为,Primer A:5′-GTG ACG AGG CCC AGA GCA AGA G-3′,Primer B:5′-ACG CAG CTC ATT GTA GAA GGT GTG G-3′,产物长度为123 bp。
1.3.6Western blot检测蛋白表达用微量天平精确称取肝脏100 mg,立即用组织裂解液制作匀浆,匀浆制作好后4 000 r/min离心收集上清液,上清液提取后采用BCA蛋白定量试剂盒对蛋白进行定量,定量后将蛋白调平,之后每组各取60 μg 进行SDS聚丙烯酰胺凝电泳,电泳完成后半干转移到PVDF模,然后按照常规方法添加一抗二抗反应,ECL发光试剂曝光洗片,图像扫描后用Image J计算各条带荧光值,每组实验重复3次。
1.4统计学处理采用SPSS19.0统计学软件进行统计分析,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2结果
2.1各组大鼠肝脏HE染色比较肝脏切片HE染色可以看出,CON组细胞表面光滑、大小均一,没有任何脂肪空泡,而HFD组细胞有一定的肿胀,且细胞核受到了一定的挤压,提示有脂肪空泡的存在,治疗4周后,脂肪空泡数量均明显减少,治疗8周后脂肪空泡进一步减少,但仍有一定的炎性反应,见图1。
2.2各组大鼠肝功能比较治疗4周后,PDT、GLD、GMD、GHD组与HFD组比较,AST、ALT及AKP水平明显降低(P<0.05),同时可看出PDT组改善没有GLD、GMD、GHD组明显;治疗8周后,PDT、GLD、GMD、GHD组与HFD组比较,ALT、AST和AKP 进一步降低,和CON组基本一致,同时可发现PDT改善效果与GLD及GMD相近,但仍然没有GHD组降低得多,见表1。
2.3各组大鼠血脂水平比较治疗4周后,4个治疗组TC均明显低于HFD组(P<0.05),同时PDT组低于GLD组,与GMD组及GHD组基本相近;TG水平PDT、GMD、GHD组要明显低于HFD组(P<0.05),PDT 组与GMD组改善大体一致,好于GLD组,但没有GHD组改善明显;HDL-C水平GMD组及GHD组要明显高于HFD组(P<0.05),PDT组低于GLD、GMD、 GHD组;PDT组与GLD、GMD、GHD组LDL-C水平比较,差异无统计学意义(P>0.05),但均低于HFD组(P<0.05)。治疗8周后,TC、TG及HDL-C 3个指标PDT组没有 GLD、GMD、GHD组改善明显;LDL-C与4周时情况基本一致,见表2。
表1 各组大鼠肝功能比较
*:P<0.05,与HFD组比较;#:P<0.05,与PDT组比较。
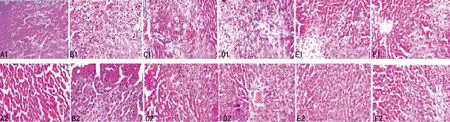
A:CON组;B:HFD组;C:GLD组;D:GMD组;E:GHD组;F:PDT组;1:治疗4周后;2:治疗8周后。
图1各组大鼠肝脏切片HE染色
表2 血清生化指标比较
*:P<0.05,与HFD组比较;#:P<0.05,与PDT组比较。
2.4各组大鼠CoASH1、CATI及ACOX1蛋白表达比较治疗4周后,PDT、 GLD、GMD、GHD组与HFD组比较,CoASH1,CATI及ACOX1 3个蛋白表达均明显升高(P<0.05),GMD、GHD组3个蛋白表达均高于PDT组(P<0.05);治疗8周后,上述3个蛋白呈现出明显的升高,同时分析可见,PDT组低于GLD、GMD及GHD组,与GMD、GHD组比较,差异有统计学意义(P<0.05),见图2、图3。
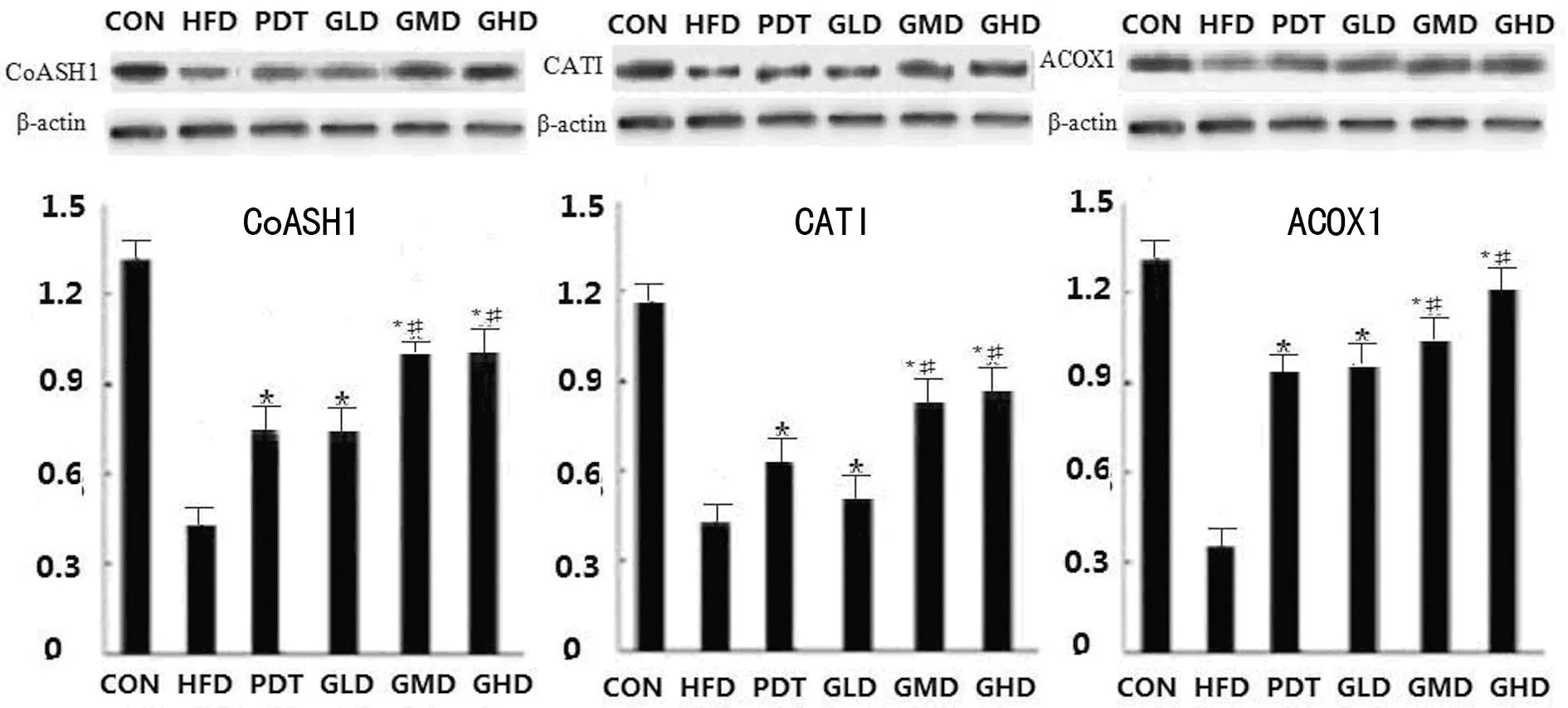
*:P<0.05,与HFD组比较;#:P<0.05,与PDT组比较。
图2治疗4周后大鼠肝脏提取液CoASH1、CATI及ACOX1蛋白表达
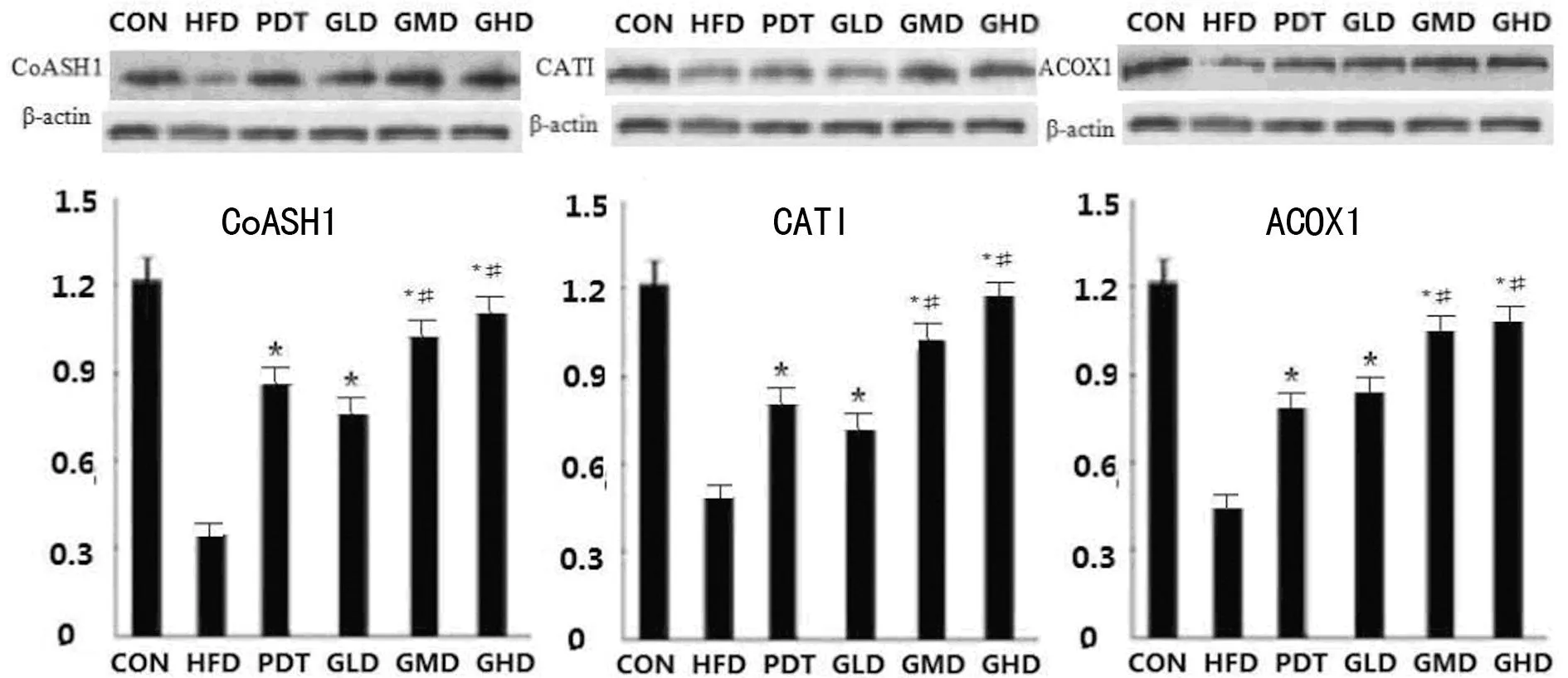
*:P<0.05,与HFD组比较;#:P<0.05,与PDT组比较。
图3治疗8周后大鼠肝脏提取液CoASH1、CATI及ACOX1蛋白表达

*:P<0.05,与HFD组比较;#:P<0.05,与PDT组比较。
图4治疗4周后大鼠肝脏提取液CoASH1、CATI及 ACOX1 mRNA表达
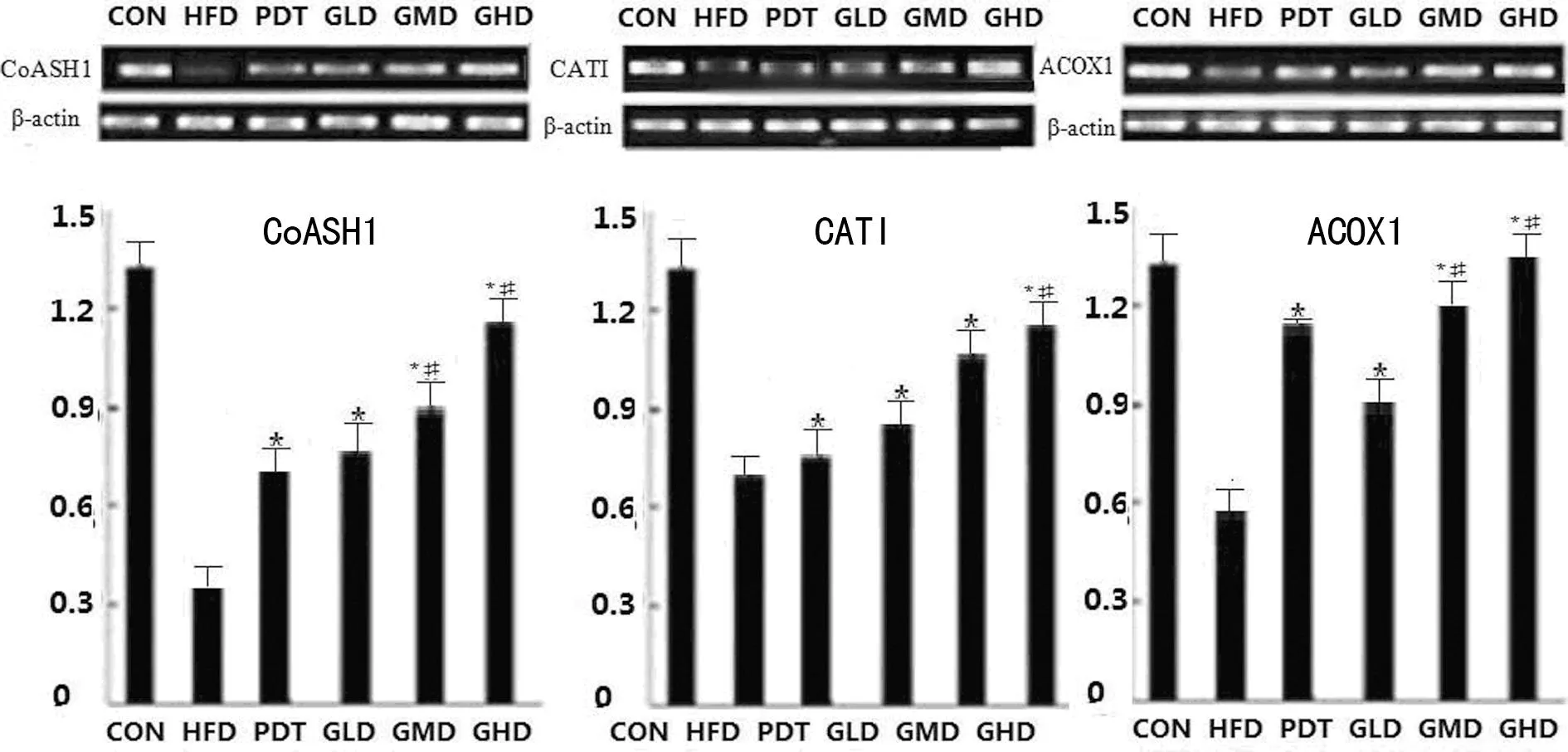
*:P<0.05,与HFD组比较;#:P<0.05,与PDT组比较。
图5治疗8周后大鼠肝脏提取液CoASH1、CATI及 ACOX1 mRNA表达
2.5各组大鼠CoASH1、CATI及ACOX1 mRNA表达比较RT-PCR与Western blot的变化趋势基本相似,但也有一些不同,治疗4周后,PDT、GLD、GMD、GHD组与HFD组比较,CoASH1、CATI及ACOX1 3个mRNA表达均明显升高(P<0.05),GMD及GHD组3个mRNA表达均高于PDT组(P<0.05);治疗8周后,上述3个mRNA呈现出明显的升高,同时分析可见,PDT组低于GLD、GMD、GHD组(P<0.05),CoASH1、ACOX1 2个mRNA表达,PDT组低于GMD、GHD组(P<0.05),CATI mRNA表达,PDT组低于GHD组,详见图4、图5。
3讨论
NAFLD近年来呈高发态势,以发达国家为例,在发达国家中西班牙发病率最高,约为45%,在欧洲其他国家,如法国和德国等,发病率也高达35%,而我国由于近年来经济发展较快,人民饮食日益丰富,但营养学知识相对匮乏,其发病率也高达25%[7-8],由于肝脏的适应和自我调节能力,NAFLD在临床中并没有典型症状,多由体检发现,容易被忽视,如果不积极治疗可导致患者后期发生肝纤维化甚至肝衰竭等[9],因此除了改变人们的饮食结构外,对NAFLD的治疗研究也逐渐加大。在关注NAFLD治疗进展时,许多专家认为NAFLD不应以药物治疗,而应以生活方式干预为主,但最新的研究显示即使给予充足的锻炼,由肝脏脂肪空泡受损的肝脏细胞也仍然呈病理状态(主要为肝细胞发生纤维化的细胞[10])不易恢复,因此药物的治疗仍然不易忽视。鉴于人参皂苷Rg1在糖尿病治疗中的辅助治疗作用,同时考虑NAFLD和人参皂苷的相关性,作者推测,人参皂苷可能对NAFLD有一定的治疗作用,因此开展了本次研究。
由于NAFLD患者肝脏受到脂肪细胞的长期浸润,因此肝细胞受到了一定损害,肝细胞受损首先表现为肝脏的病理学改变和肝功能的异常[11]。本文研究结果显示,HE染色CON组肝细胞结构完整、表面光滑,而HFD组大鼠则有明显的脂肪空泡与炎性反应,人参皂苷Rg1治疗4周后脂肪空泡明显减少;治疗8周进一步减少,同时比较分析可见,治疗8周后GMD、GHD组脂肪空泡几乎明显消失,但仍有一定的炎性反应,PDT组则和GLD组相似。此外治疗4周后,人参皂苷Rg1 3个治疗组与HFD组相比AST、ALT和AKP均明显降低(P<0.05),此外,人参皂苷Rg1 3个治疗组与PDT组相比明显升高。这提示给予高脂高糖饮食,大鼠可有明显的肝脏细胞变性,人参皂苷Rg1与临床中常用的治疗NAFLD药物相比,可以明显排出肝脏蓄积的脂肪颗粒,此外人参皂苷Rg1在改善肝功能方面更有优势。
脂肪酸β-氧化是体内脂肪细胞代谢的三大信号通路,一般而言,在氧气足够条件下,经胆囊和肠摄入的脂肪酸在进入肝脏后可经β-氧化分解为功能物质,为身体提供足够的能量,而人们过量的饮食,使得体内β-氧化相关酶类不能及时的代谢这些脂肪酸,就会造成其在肝细胞中聚集,最终造成了NAFLD的发生,而NAFLD的发生又会限制β-氧化相关酶的分泌,最终加快了NAFLD的恶化[12-13]。本研究在用人参皂苷Rg1治疗NAFLD后,采用RT-PCR 与Western blot 2种手段检测了肝细胞中β-氧化关键酶CATI、CoASH1和ACOX1的表达,结果显示,治疗4周后,人参皂苷Rg1 3个治疗组与HFD组相比,CATI、CoASH1和ACOX1表达明显升高(P<0.05),此外研究结果显示人参皂苷中剂量和高剂量治疗(GMD组与GHD组),上述3个酶表达也明显高于PDT组(P<0.05);治疗8周后进一步升高。结合HE染色和肝功能的变化,提示与临床治疗NAFLD常用药物熊去氧胆酸钠相比,人参皂苷Rg1可明显调节大鼠β-氧化。
总之,本研究显示,高脂高糖饮食8周可明显的造成大鼠发生NAFLD病,人参皂苷Rg1则可以通过调节β-氧化3个关键酶CATI、CoASH1和ACOX1改善肝功能,促进肝脏脂肪的排出,或许今后可用于临床治疗NAFLD。
参考文献
[1]Smith BW,Adams LA.Non-alcoholic fatty liver disease[J].Crit Rev Clin Lab Sci,2011,48(3):97-113.
[2]Karrar A,Stepanova M,Alaparthi L,et al.Anti-adipocyte antibody response in patients with non-alcoholic fatty liver disease[J].J Gastroenterol Hepatol,2015,30(5):900-908.
[3]何夏秋,杨蕾.用 HPLC 法测定三七及益尿通胶囊中人参皂苷 Rg1 的水平[J].中国中药杂志,2001,26(1):37-38.
[4]Tushuizen ME,Bunck MC,Pouwels PJ,et al.Incretin mimetics as a novel therapeutic option for hepatic steatosis[J].Liver Int,2006(26):1015-1017.
[5]Zhou SS,Xu JD,Zhu H,et al.Simultaneous determination of original,degraded ginsenosides and aglycones by ultra high performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry for quantitative evaluation of Du-Shen-Tang,the decoction of ginseng[J].Molecules,2014,19(4):4083-4104.
[6]彭璇,黄德斌,严米娅,等.人参皂苷 Rg1 通过调节脂肪代谢改善非酒精性脂肪肝病大鼠的肝功能[J].中国病理生理杂志,2015,31(5):864-870.
[7]武俊紫.艾塞那肽对非酒精性脂肪肝病的治疗作用研究[D].昆明:昆明理工大学,2014.
[8]武俊紫,牛世伟,贾亚敏,等.富硒灵芝对非酒精性脂肪性肝病大鼠酰基辅酶 A 氧化酶水平的影响[J].重庆医学,2014,43(32):4346-4349.
[9]Tok D,Ekiz F,Basar O,et al.Serum endocan levels in patients with chronic liver disease[J].Int J Clin Exp Med,2014,7(7):1802-1807.
[10]Milic S,Lulic D,Stimac D.Non-alcoholic fatty liver disease and obesity:biochemical,metabolic and clinical presentations[J].World J Gastroenterol,2014,20(28):9330-9337.
[11]Ramos AN,de Oliveira Rocha B,de Almeida Rêgo VR,et al.The linkage between psoriasis and non-alcoholic fatty liver disease:a literature review[J].Acta Dermatovenerol Croat,2014,22(2):132-136.
[12]Ghisla S.β-oxidation of fatty acids[J].Euro J Bioch,2004,271(3):459-461.
[13]Samovski D,Sun J,Pietka T,et al.Regulation of AMPK activation by CD36 links fatty acid uptake to β-oxidation[J].Diabetes,2015,64(2):353-359.
(云南省第一人民医院:1.急诊内科;2.干部保健科,昆明 650032)
Study on the improvement effect of Ginsenoside Rg1 on nonalcoholic fatty liver phenotype by regulation of β-oxidation
Liao Wenyun1,Xu Dan2△
(1.Department of Emergency Medicine;2.Department of Preventive Medicine for Cadre,the First People's Hospital of Yunnan Province,Kunming ,Yunnan 650032,China)
[Abstract]ObjectiveTo investigate the role of Ginsenosides Rg1 for non-alcoholic fatty liver disease by β-oxidation.Methods120 SD rats were randomly divided into control group (CON),model group (HFD),Ginsenosides Rg1 low,medium and high dose group (GLD,GMD and GHD),sodium deoxycholate of bear treatment group (PDT),20 rats in each group.After 4 and 8 weeks treatment,the rats were sacrificed,Pathology of hepatic tissue was tested by HE staining,and liver function,lipid levels,hepatic acyl-CoA synthetase (CoASH1),carnitine acyl transferase I(CATI) and acetyl coenzyme A oxidase 1 (ACOX1) mRNA and protein expression were tested.ResultsAfter 4 weeks of treatment,the liver function tested by HE staining only improved in GHD group.After 8 weeks,there's a little fat particles aggregation in PDT and GLD groups,but no infiltration of fat in GMD and GHD groups.After 4 weeks,AST,ALT and AKP,CHOL,TG and LDL-C levels were significantly lower in PDT,GLD,GMD and GHD groups compared with HFD group (P<0.05),which were significant declined 8 weeks later.After 4 weeks,HDL-C level in four groups was significantly increased,then reached the normal level 8 weeks later.After 4 weeks,CoASH1,CATI and ACOX1 expressions in hepatic tissue of four groups were significantly increased,which improved more obviously after eight weeks.ConclusionGinsenoside Rg1 can improves nonalcoholic fatty liver phenotype by regulation of β-oxidation.
[Key words]Ginsenosides Rg1;non-alcoholic fatty liver disease;acyl-CoA synthetase;carnitine acyl transferase I;acetyl coenzyme A oxidase 1
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.09.009
作者简介:廖文云(1966-),学士,副主任医师,主要从事急诊医学方面的工作。△通讯作者,E-mail:dzx6631@163.com。
[中图分类号]R575.5
[文献标识码]A
[文章编号]1671-8348(2016)09-1179-04
(收稿日期:2015-11-08修回日期:2016-01-26)
