血浆纤溶酶原与BDNF在抑郁模型大鼠海马区的表达及相关性研究*
2016-06-15林志雄殷静雯冼君定颜海锋邹晓波
林志雄,殷静雯△,冼君定,颜海锋,邹晓波
(1.广东医学院附属医院精神心理科,广东湛江 524001;2.广东医学院,广东东莞 523808)
血浆纤溶酶原与BDNF在抑郁模型大鼠海马区的表达及相关性研究*
林志雄1,殷静雯1△,冼君定2,颜海锋1,邹晓波1
(1.广东医学院附属医院精神心理科,广东湛江 524001;2.广东医学院,广东东莞 523808)
[摘要]目的探讨血浆纤溶酶原和脑源性神经营养因子(BDNF)与抑郁症的相关性,加深对抑郁症发病分子机制的认识,为抑郁症的诊断和治疗提供新的思路。方法建立慢性轻度不可预见性应激大鼠抑郁模型,检测大鼠快感缺乏,行为活动减少,体质量减轻等抑郁样症状。采用蛋白免疫印迹法分析大鼠海马组织血浆纤溶酶原和BDNF蛋白表达情况。结果血浆纤溶酶原和BDNF在对照组和观察组大鼠海马区表达的差异均有统计学意义(P<0.01)。血浆纤溶酶原与BDNF的变化呈明显正相关(r=0.65,P<0.01),线性回归分析表明二者之间存在明显的依存关系(r2=0.423),回归方程为:YBDNF=0.750X血浆纤溶酶原+0.201。结论应激可影响神经细胞的生长和存活,导致大鼠抑郁样行为的发生。同时检测到血浆纤溶酶原和BDNF的表达下降,BDNF与血浆纤溶酶原的表达呈正相关,提示血浆纤溶酶原和BDNF共同参与抑郁症的发病机制。
[关键词]抑郁症;脑源性神经营养因子;血浆纤溶酶原
抑郁症是临床最常见的精神疾病之一,但是其发病机制尚未明确。近年有学者提出了抑郁症的神经营养假说(neurotrophin hypothesis of depression),认为多种应激(压力)能够降低海马中脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的信号调节作用(降低BDNF的表达),使神经细胞突触数量减少和神经细胞凋亡而引起抑郁;抗抑郁药物能够增强BDNF信号调节的作用(增强BDNF的表达),提高突触的可塑性和促进神经元的生存来发挥治疗抑郁的效果[1],更进一步的研究提示,BDNF 表达又受到血浆纤溶酶原(plasminogen)的调节[2]。故此,推测血浆纤溶酶原可以通过调节BDNF来参与抑郁症的发病与治疗。
1材料与方法
1.1实验动物Sprague-Dawley(SD)大鼠24只,雄性,10周龄,体质量(200±50)g。每笼4只,室温(20±2)℃,光照12 h(6:00 ~18:00)和黑暗12 h(18:00~6:00)环境饲养,适应环境1周。采用区组随机化分组方法,以体质量作为配伍因素,分为对照组和观察组,每组12只。
1.2方法
1.2.1大鼠抑郁模型采用慢性轻度不可预见性应激抑郁模型(chronic unpredictable mild stress,CUMS)。观察组大鼠共接受21 d各种不同的随机安排的应激刺激,包括:冰水游泳、室温游泳、夹尾、整夜光照、潮湿垫料,采用无放回的抽签法安排每周刺激,每天1种。
1.2.2行为学测验以糖水消耗量,体质量和旷场试验作为行为学评分方法。分别在实验处理前1天和造模第21天于隔音、安静的房间施测。糖水消耗量测验要求在训练动物适应1%蔗糖24 h后,测定2 h内糖水消耗量。旷场实验:采用自制50 cm×50 cm×40 cm周边不透明立方体敞箱,底面黑色并用白线划分为25个面积相等的方格(10 cm×10 cm)。均在9:00~10:30进行实验。室内隔音并保持安静,恒定光源,操作者将大鼠放入旷场正中格内,用摄像设备记录大鼠在5 min内行为变化,包括水平运动(穿越格子数)、垂直运动(站立次数)、停留时间,四只爪子均进入一格记录水平运动1次,两前爪腾空或攀附墙壁记录垂直运动1次。

表1 各组大鼠行为学评分
1.2.3标本采集及Western blot检测采用脊椎脱臼法处死大鼠,将大鼠放置于冰上,快速剪毛、开颅,取出两侧海马组织,液氮快速冷冻于-80 ℃冰箱储存。将大鼠海马组织研磨至组织完全裂解。将组织裂解液高速离心(4 ℃,10 000 r/min,15 min);取淡黄清亮的蛋白上清液。BCA法测定蛋白浓度并调平,用移液枪将15 μL蛋白样品液体和mark缓慢加入样品孔中。用60 v进行浓缩胶电泳,30 min后再转成恒压120 v在分离胶中电泳,时间90 min。冰浴下,用恒流300 mA电流转膜50 min,PBS-T浸洗。将膜用密封袋装好,依次加入5%封闭蛋白、一抗封闭液,二抗封闭液,以上每一步后均放入0.5‰PBS-T中,用摇床揺洗5次,每次5 min,速率为90 r/min。全暗房内曝光,将曝光好的胶片放入37 ℃烘箱中烤干。
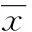
2结果
2.1行为学评分应激前,两组大鼠糖水消耗量、体质量、旷场试验水平运动得分、垂直运动得分和停留时间比较,差异无统计学意义(P>0.05)。试验处理后,两组糖水消耗量比较,差异有统计学意义(P<0.01),对照组体质量增长率显著高于观察组(P<0.05),观察组水平运动得分和垂直运动得分显著低于对照组(P<0.05),观察组停留时间显著长于对照组(P<0.01),见表1。
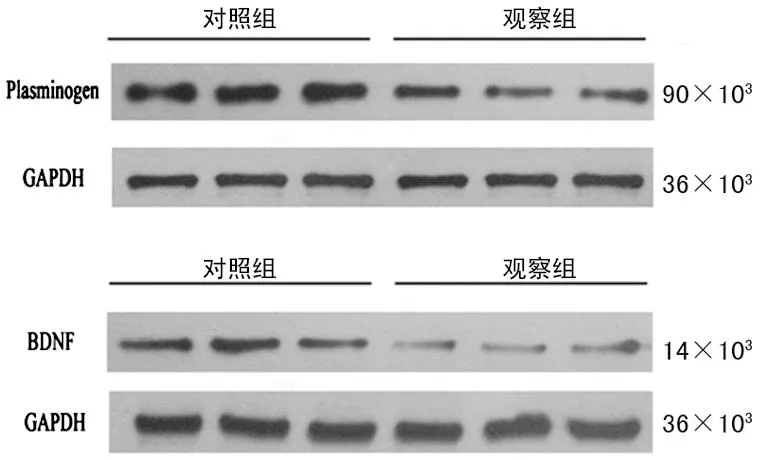
图1 Western blot法检测大鼠海马组织血浆纤溶酶原和BDNF的表达
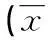
表2 Western blot检测血浆纤溶酶原、BDNF在大鼠海马组织中的表达±s)
2.2Western blot检测血浆纤溶酶原和BDNF的表达对照组和观察组大鼠海马区血浆纤溶酶原和BDNF表达的差异均有统计学意义(P<0.05) ,见表2、图1、2。血浆纤溶酶原和BDNF在大鼠海马区的表达差异无统计学意义(t=0.67,P=0.51)。通过对数据进行相关与回归分析显示,血浆纤溶酶原与BDNF的变化呈明显正相关(r=0.65,P<0.01),它们之间存在明显的依存关系,回归方程为:YBDNF=0.750X血浆纤溶酶原+0.201。

*:P<0.01,与对照组比较。
图2Western blot 检测BDNF、血浆纤溶酶原蛋白在大鼠海马组织中的表达
3讨论
实验结果表明:应激可影响神经细胞的生长和存活并出现快感缺失,行动能力减弱,体质量减轻等一系列与抑郁相关的症状。同时检测到血浆纤溶酶原和BDNF的表达明显下降,且两者的表达呈正相关,提示血浆纤溶酶原和BDNF共同参与抑郁症的发病机制。
3.1BDNF与抑郁症相关评价试验证实抑郁模型已经造模成功后,检测对照组和观察组大鼠海马中BDNF的表达差异有统计学意义(P<0.05),本研究结果支持此结果,小鼠经受21 d慢性轻度不可预见性应激后BDNF表达较对照组明显减少。表明BDNF与抑郁相关,BDNF具有促进突触生长、维持神经元生存的作用。Taliaz等[3]通过RNA干扰技术进行BDNF基因敲除的小鼠研究还发现,海马齿状回部位BDNF表达下降直接减少了神经细胞的生成,小鼠出现了抑郁样行为。尸检发现,抑郁症患者脑内海马区BDNF较健康对照组显著下降[4]。并且,脑内BDNF水平上升可以产生抗抑郁效果。Hoshaw等[5]对两种抑郁症行为(强迫游泳和习得性无助)小鼠的中脑和海马部位直接灌注外源性BDNF,发现其海马部位会迅速且持久地产生类似抗抑郁作用。
BDNF通过维持神经元的生存而防止抑郁症的发生。可能的机制为:BDNF与酪氨酸蛋白激酶B(tyrosine kinase B,TrkB)结合后可激活多条信号传导通路,其中丝裂原活化蛋白激酶/细胞外调节蛋白激酶(mitogen-activated protein kinase/extracellular signal-regulated kinase,MAPK/Erk)通路的级联反应最为重要[6]。首先Erk的激活在突触可塑性调节中起着重要的作用[7];其次,MAPK/Erk通路的级联反应调控使cAMP反应性元件结合蛋白(cAMP response elementbinding protein,CREB)磷酸化,从而增加B淋巴瘤细胞-2 (B-cell lymphoma 2,Bcl-2)的合成,可抑制细胞凋亡[8-9]。
也有学者对BDNF与抑郁症的关系提出质疑。Pawlak等[10]对野生型C57/BL6小鼠连续施加21 d,每次6 h束缚性应激后(用金属丝束缚头部和夹尾),检测到神经元的突触减少,但BDNF的表达较对照组没有显著改变。这提示可能有多重途径调节突触神经元的可塑性和存活。BDNF并不是惟一的调节因子[10]。
3.2血浆纤溶酶原与抑郁症本实验结果显示,抑郁模型造模成功后,血浆纤溶酶原在海马区的表达较对照组显著减少,提示其含量与抑郁症密切相关。Pawlak等[10]认为N-甲基-D-天冬氨酸受体 (N-methyl-D-aspartic acid receptor,NMDA)在神经突触可塑性中起着重要的作用,并且通过检测生长相关蛋白(growth-associated protein,GAP-43)的表达和高尔基染色法观察神经元突触的生长,在对血浆纤溶酶原(-/-)小鼠施加慢性束缚性刺激的实验结果证实了血浆纤溶酶原向广谱蛋白血浆纤溶蛋白酶(plasmin)转换的过程是应激后NMDA受体减少的重要因素。另有学者的研究也证实血浆纤溶酶原可能通过其他分子通路调节抑郁症。
3.3BDNF、血浆纤溶酶原与抑郁症应激可以引起大脑,特别是海马内一系列的生化反应。长期应激引起的大脑结构、功能、分子机制的改变,可导致认知、情绪和行为的改变。本研究发现应激可影响神经细胞的生长和存活并出现快感缺失,行动能力减弱,体质量减轻等一系列与抑郁相关的症状。同时检测到血浆纤溶酶原和BDNF的表达下降,二者的表达呈线性相关,表明血浆纤溶酶原与BDNF的表达均受到应激的影响。血浆纤溶酶原可能作为BDNF的上游调控因子,可能通过对BDNF水解过程的调控,参与抑郁症的发病的生化过程[11]。血浆纤溶酶原的精氨酸561-缬氨酸562之间的肽键可以被t-PA裂解,形成有活性的plasmin[12]。plasmin是一种广谱蛋白酶,在机体的凝血和纤溶反应中发挥着重要作用。plasmin可以水解pro-BDNF,将其转变为成熟的BDNF后,与酪氨酸蛋白激酶B(tyrosine kinase B,TrkB)结合,促进突触的生长、维持神经细胞生存[11]。而另一部分 pro-BDNF与神经生长因子受体p75( p75 neurotrophin receptor,p75NTR)结合后会抑制突触的生长,特别是当形成pro-BDNF/p75NTR/sortilin三聚体时,将会导致神经细胞的凋亡[13-14]。血浆纤溶酶原和BDNF的表达水平决定着神经细胞的生长和凋亡,与抑郁症密切相关。
综上所述,试验运用慢性刺激施加于大鼠,模拟人类抑郁的发病过程建立抑郁模型后,观察组大鼠表现出快感缺乏、行为活动减少、体质量减轻等抑郁症状及海马区发生病变,同时检测到海马内血浆纤溶酶原和BDNF的表达较对照组显著下降。进一步证实血浆纤溶酶原-BDNF通路维持神经细胞的生长这一过程与抑郁症相关。血浆纤溶酶原作为两条通路的共同因子,可能成为研究抑郁症发病机制和治疗抑郁症新的靶点。血浆纤溶酶原和BDNF的调控关系还需要在基因敲除小鼠中进一步验证,同时本实验中没有进行NMDA受体通路的研究,不能排除NMDA受体通路和BDNF通路是否存在相互作用。有研究发现血浆纤溶酶原大量存在于人的血液和组织液中,血液中和脑内血浆纤溶酶原水平的相关性可能成为诊断和治疗抑郁症的重要依据,血浆纤溶酶原将有望成为抑郁症的诊断标记因子。
参考文献
[1]Nestler EJ.Neurobiology of depression[J].Neuron,2002,349(1):13-25.
[2]Isingrini E,Camus V,Le Guisquet AM,et al.Association between repeated unpredictable chronic mild stress(UCMS) procedures with a high fat diet:a model of fluoxetine resistance in mice[J].PLoS One,2010,5(4):1-8.
[3]Taliaz D,Stall N.Knockdown of brain-derived neuro-trophic factor in specific brain sites precipitates behaviors associated with depression and reduces neurogenesis[J].Mol Psychiatry,2010,15(1):80-92.
[4]Lee BH,Kim,H,Park,SH,et al.Decreased plasma BDNF level in depressive patients[J].J Affect Disord,2007,101(13):239-244.
[5]Hoshaw BA,Malberg JE,Lucki I.Central administration of IGF-I and BDNF leads to long-lasting antidepressant-like effects[J].Brain Res,2005,1037(1/2):204-208.
[6]Lee R,Kermani P,Teng KK,et al.Regulation of cell survival by secreted proneurotrophins[J].Science,2001,294(5548):1945-1948.
[7]Bejar R,Yasuda R.Transgenic calmodulin dependent protein kinase Ⅱ activation,dose-dependent effects on synaptic plasticity,learning,and memory[J].Neurosci,2002,22(13):5719-5726.
[8]Mohajerani MH,Sivakumaran S,Zacchi P,et al.Correlated net-work activity enhances synaptic efficacy via BDNF and the ERK pathway at immatureCA3 CA1 connections in the hippocampus[J].Proc Natl Acad Sci U S A,2007,104 (32):13176-13181.
[9]Peng CH,Chiou SH.Neuroprotection by imipra-mine against lipopolysa- ccharide-induced apoptosis in hippocampus-derived neural stem cells mediated by activation of BDNF and the MAPK pathway[J].Eur Neuropsychopharmacol,2008,18(1):128-140.
[10]Pawlak R,Rao BS,Melchor JP,et al.Tissue plasminogen activator and plasminogen mediate stress-induced decline of neuronal and cognitive functions in the mouse hippocampus[J].Proc Natl Acad Sci U S A,2005,102(50):18201-18206.
[11]Rodier M,Prigent-Tessier A,Béjot Y,et al.Exogenous t-PA administration increases hippocampal mature BDNF levels[J].PLoS One,2014,9(3):e92416.
[12] Jane HP.Does plasmin have anticoagulant activity[J].Vasc Health Risk Manag,2010(6):199-205.
[13]Teng HK,Teng KK,Lee R,et al.ProBDNF induces neuronal apoptosis via activation of a receptor complex of p75NTR and sortilin[J].Neurosci,2005,25(22):5455-5463.
[14]Lin P,Wang C.The VGF-derived peptide TLQP62 produces antidepressant-like effects in mice via the BDNF/TrkB/CREB signaling pathway[J].Pharmacol Biochem Behav,2014,120(2):140-148.
Study on plasminogen and BDNF expression in the hippocampus of depression rat mode and its relationship*
Lin Zhixiong1,Yin Jingwen1△,Xian Junding2,Yan Haifeng1,Zou Xiaobo1
(1.Department of Psychiatry,Affiliated Hospital of Guangdong Medical College,Zhanjiang,Guangdong 524001,China; 2.Guangdong Medical College,Dongguan,Guangdong 523808,China)
[Abstract]ObjectiveTo study on the relationship between plasminogen and brain-derived neurotrophic factor(BDNF),and explain the molecular mechanism of depression,then provide new clew for diagnosis and treatment of depression.MethodsThe chronic unpredictable mild depression rat mode was established,then depression symptoms including absence of delight,the decline of actions and activities, and weight reduction of rat were tested.The levels of individual plasminogen and BDNF in hippocampus were determined by Western blot.ResultsThe expression of BDNF and plasminogen in depression rat mode and control group was significantly different(P<0.01),and there was a positive correlation between BDNF and plasminogen(r=0.65,P<0.01).According to the linear-regression analysis ,there was a dependence relationship between them(r2=0.423).The equation of regression was YBDNF=0.750XPlasminogen+0.201.ConclusionStress could affect the growth and survival of nerve cell,which lead to the depression behavior of rats,meanwhile,the decline of plasminogen and BDNF levels,the positive correlation between them illustrate that plasminogen and BDNF take part in the mechanism of depression.
[Key words]depressive disorder;brain-derived neurotrophic factor;plasminogen
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.09.006
* 基金项目:湛江市科技攻关计划项目(2013B01039)。
作者简介:林志雄(1974-),学士,主任医师,主要从事抑郁症的临床与基础研究。△通讯作者,E-mail:amysays@live.cn。
[中图分类号]R749.4+1
[文献标识码]A
[文章编号]1671-8348(2016)09-1170-03
(收稿日期:2015-09-28修回日期:2015-12-22)
