ISCOM型白血病瘤苗对小鼠巨噬细胞作用的研究*
2016-06-15字友梅贺立山
吴 隼,黄 琰,杨 满,字友梅,马 栋,贺立山
(新乡医学院第一附属医院血液科,河南新乡 453100)
ISCOM型白血病瘤苗对小鼠巨噬细胞作用的研究*
吴隼,黄琰,杨满,字友梅,马栋,贺立山
(新乡医学院第一附属医院血液科,河南新乡 453100)
[摘要]目的探讨免疫刺激复合物(ISCOM)型白血病瘤苗对小鼠巨噬细胞的作用。方法将C57BL/6小鼠30只分为模型组、灭活的红白血病细胞(FBL-3)瘤苗组(灭活瘤苗组)和灭活的FBL-3细胞+ISCOM瘤苗组(ISCOM瘤苗组),小鼠注射FBL-3细胞建立白血病荷瘤小鼠模型,治疗4周后,分离小鼠腹腔巨噬细胞,观察不同组别的巨噬细胞吞噬功能、一氧化氮(NO)、白细胞介素(IL)-1、肿瘤坏死因子-α(TNF-α)、巨噬细胞杀伤活性和抗原呈递功能。结果ISCOM瘤苗组小鼠腹腔巨噬细胞数量、巨噬细胞吞噬功能、IL-1、TNF-α、IL-2、T细胞增殖能力和NO高于模型组和灭活瘤苗组(P<0.05),ISCOM瘤苗组巨噬细胞细胞杀伤活性显著高于模型组(P<0.01)。结论ISCOM型瘤苗可以增加巨噬细胞的数量,增强巨噬细胞的吞噬作用及抗原呈递能力。
[关键词]白血病瘤苗;巨噬细胞;ISCOMs
目前血液恶性肿瘤多以化疗为主,但近年来国内外在主动免疫治疗白血病方面研究甚多,肿瘤疫苗可通过激活患者自身免疫系统,增强机体的抗癌能力,阻止肿瘤的生长、扩散和复发[1-2]。本研究在前期的研究中发现免疫刺激复合物(immunostimulating complex,ISCOM)型白血病瘤苗可增强荷瘤小鼠的巨噬细胞(Mφ)活性和细胞毒性T淋巴细胞(CTL)活性,达到改善荷瘤小鼠的非特异性免疫和细胞免疫功能的作用,在此基础上,本文旨在探讨ISCOM型白血病瘤苗对小鼠巨噬细胞的作用。
1材料与方法
1.1材料(1)主要试剂:小鼠IL-1 Elisa试剂盒(华美生物工程公司);小鼠TNF-α Elisa试剂盒(华美生物工程公司);NO检测试剂盒(南京建成公司);小鼠IL-2 Elisa试剂盒(华美生物工程公司);RPMI1640培养基(GIBCO,美国);脂肪酶蛋白(SIGMA,美国);卵磷脂(SIGMA,美国);胆固醇(SIGMA,美国);丝裂霉素C(SIGMA,美国) ;胎牛血清(GIBCO,美国);MTT(SIGMA,美国);皂苷(SIGMA,美国);Mega-10(Amresco,美国);[3H]-TdR(中科院上海原子能研究所,中国)。(2)实验动物和细胞株:C57BL/6小鼠30只,6~8周龄,体质量18.0~22.0 g,雌雄各半,购买于新乡医学院实验动物中心。红白血病细胞(FBL-3)细胞株购买于中山大学实验动物中心。
1.2方法
1.2.1瘤苗的制备ISCOM疫苗的制备[3]:皂苷溶液中加入脂肪酶蛋白(1 mg/mL)使其浓度为0.02 mg/mL,7 ℃反应12 h,随后加入80 μL脂类混合物溶液和5 mL皂苷溶液(1 mg/mL),室温下反应4 h。冰浴超声处理,透析,浓缩,4 ℃保存备用。脂类混合物溶液的配制[4]:将卵磷脂和胆固醇溶解于20%的Mega-10溶液中,调整浓度为10 mg/mL;皂苷溶液的配制:皂苷溶解于PBS溶液中,调整浓度为1 mg/mL。FBL-3细胞内加入丝裂霉素C(100 μg/mL),于37 ℃水浴中放置30 min,灭活。灭活的FBL-3细胞制备:FBL-3细胞内加入丝裂霉素C(100 μg/mL),于37 ℃水浴中放置30 min,PBS液洗3次,使用生理盐水重新调整细胞浓度为1×106/mL。
1.2.2瘤苗免疫动物模型的建立所有小鼠均建立负瘤小鼠模型[5],FBL-3培养于含有10%胎牛血清的RPMI1640培养基,取0.2 mL 1×106/mL细胞注射于鼠左肋皮下于3~7 d可触及肿瘤后[6]。将30只SPF级C57BL/6小鼠分为3组,模型组、灭活的FBL-3瘤苗组(灭活瘤苗组)和灭活的FBL-3细胞+ISCOM瘤苗组(ISCOM瘤苗组),各组均进行荷瘤小鼠动物模型的建立,模型组采用等体积的生理盐水进行治疗,上述各组均每周治疗1次,治疗时在肿瘤部位注射瘤苗0.2 mL,治疗维持4周。
1.2.3小鼠巨噬细胞的吞噬能力、杀伤活性、促炎因子和抗原呈递能力测定小鼠腹腔灌注RPMI1640培养基收集小鼠腹腔巨噬细胞,37 ℃、5%CO2、RPMI1640培养基体外培养。分离巨噬细胞计数考察不同组别中小鼠巨噬细胞数量的改变。吞噬能力:将醛化的鸡红细胞注入小鼠腹腔检测腹腔巨噬细胞的吞噬能力,吞噬指数(%)=吞噬红细胞的巨噬细胞数/巨噬细胞总数×100%[7]。促炎因子:采用一氧化氮(NO)、白细胞介素(IL)-1和肿瘤坏死因子α(TNF-α)检测试剂盒检测巨噬细胞培养液表达水平。杀伤活性:采用MTT测量各组治疗后的巨噬细胞杀伤活性。抗原呈递能力测定:分离不同组别瘤苗免疫小鼠T细胞,将分离巨噬细胞共孵育,采用IL-2检测试剂盒检测培养液中IL-2水平和[3H]-TdR掺入法检测T细胞增殖能力[8]。
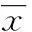
2结果
2.1各组小鼠腹腔巨噬细胞数量比较模型组小鼠腹腔巨噬细胞为(3.82±1.24)×106,灭活瘤苗组为(4.16±1.41)×106,ISCOM瘤苗组为(7.43±2.27)×106;ISCOM瘤苗组小鼠腹腔巨噬细胞数量显著高于模型组、灭活瘤苗组,差异有统计学意义(t=4.37、3.86,P<0.01),见图1。

a:P<0.01,与ISCOM瘤苗组比较。
图1各组小鼠腹腔巨噬细胞数量比较
2.2各组小鼠巨噬细胞吞噬功能比较模型组小鼠巨噬细胞吞噬指数为(29.50±8.20)%,灭活瘤苗组巨噬细胞吞噬指数为(54.80±11.50)%,ISCOM瘤苗组巨噬细胞吞噬指数为(68.30±16.30)%,ISCOM瘤苗组小鼠腹腔巨噬细胞吞噬功能高于模型组(t=6.72,P<0.01)和灭活瘤苗组(t=2.14,P<0.05)。
2.3各组小鼠巨噬细胞分泌IL-1、TNF-α及NO水平比较ISCOM瘤苗组小鼠IL-1高于模型组、灭活瘤苗组(t=7.36、2.45,P<0.05),灭活瘤苗组IL-1高于模型组(t=6.04,P<0.01);ISCOM瘤苗组TNF-α高于模型组、灭活瘤苗组(t=7.13、3.34,P<0.01),灭活瘤苗组TNF-α高于模型组(t=3.92,P<0.01);ISCOM瘤苗组NO高于模型组、灭活瘤苗组(t=9.76、3.71,P<0.01),灭活瘤苗组NO高于模型组(t=6.69,P<0.01),见表1。
2.4各组小鼠巨噬细胞杀伤活性比较模型组小鼠巨噬细胞细胞杀伤活性为(34.23±9.67)%,灭活瘤苗组为(60.32±14.07)%,ISCOM瘤苗组为(69.47±14.79)%,ISCOM瘤苗组、灭活瘤组小鼠巨噬细胞细胞杀伤活性显著高于模型组(t=6.31、4.83,P<0.01);灭活瘤苗组和ISCOM瘤苗组比较差异无统计学意义(P>0.05),见图2。
2.5各组小鼠巨噬细胞抗原提呈能力比较ISCOM瘤苗组IL-2高于模型组、灭活瘤苗组(t=2.34、2.42,P<0.05);ISCOM瘤苗组T细胞增殖能力高于模型组、灭活瘤苗组(t=2.78、2.68,P<0.05),见表2。
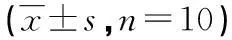
表1 各组小鼠巨噬细胞分泌IL-1、TNF-α及
a:P<0.01,与模型组比较;b:P<0.05,c:P<0.01,与灭活瘤苗组比较。
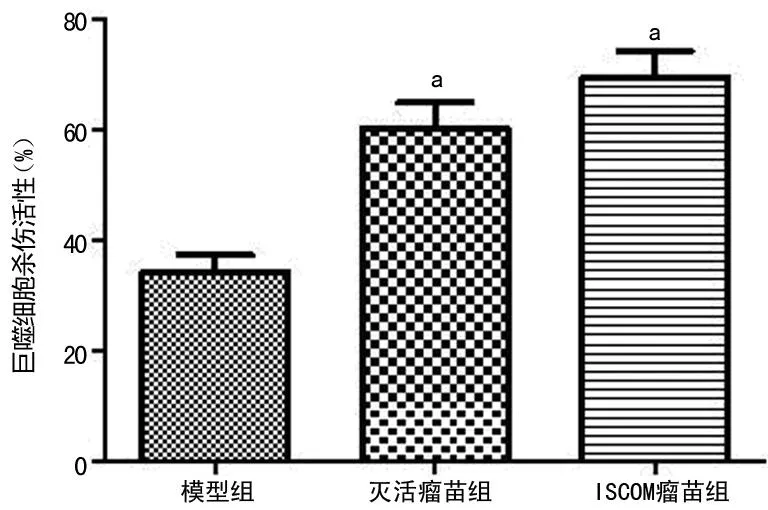
aP<0.01,与模型组比较。
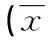
图2 各组小鼠巨噬细胞杀伤活性比较
a:P<0.05,与ISCOM瘤苗组比较。
3讨论
ISCOM是一种全新的抗原提呈系统,具有佐剂和抗原提呈的双重功能,ISCOM是由皂苷、胆固醇、磷脂、蛋白质抗原等构成的直径为30~40 nm的球形笼状颗粒[9]。ISCOM具有增强免疫和抗原递呈的功能,且能同时刺激体液和细胞免疫[10]。用肿瘤疫苗进行主动特异性免疫治疗是一种理想的免疫治疗方法。肿瘤疫苗可以激发全身性细胞免疫,提高免疫细胞杀伤肿瘤的能力,并可诱发长期抗肿瘤免疫功能,防止肿瘤复发及转移[11]。单核-巨噬细胞是体内重要的免疫细胞,广泛分布于网状内皮系统中,可通过主动吞噬、杀伤、消化病原体,清除体内衰老突变的肿瘤细胞,在抑制肿瘤细胞腹腔转移过程中起到重要的免疫作用[12]。因此,本文中观察了ISCOM型瘤苗对荷瘤小鼠巨噬细胞功能的影响,以探究巨噬细胞在ISCOM型瘤苗抗肿瘤作用中扮演的作用。
巨噬细胞可以分泌促炎症因子IL-1、TNF-α和NO,IL-1可促进免疫应答、参与炎症反应、促进伤口愈合及刺激造血功能等[13]。TNF-α参与炎症反应、免疫应答及抗肿瘤等[14],还能够诱导其他细胞因子的释放。巨噬细胞受到刺激活化时,释放的大量NO具有细胞毒作用,可杀伤微生物(细菌、真菌、病毒)、寄生虫和肿瘤细胞等,亦可诱发炎症反应保护机体抵御外界不利因素的侵害[15]。本研究结果显示,ISCOM瘤苗组小鼠腹腔体内的巨噬细胞数量显著高于模型组和灭活瘤苗组,且巨噬细胞吞噬功能、杀伤活性、抗原提呈活性显著增高,IL-1、TNF-α和NO表达水平亦显著优于模型组和灭活瘤苗组,此结果显示ISCOM型瘤苗对荷瘤小鼠免疫后,巨噬细胞数量和活力均得到增强。巨噬细胞作为机体抗原提呈细胞和免疫效应细胞在ISCOM型瘤苗介导抗肿瘤免疫反应中起重要作用。
综上所述,ISCOM型瘤苗可以增加巨噬细胞的数量,增强巨噬细胞的吞噬作用及抗原呈递能力,也意味着提高了荷瘤小鼠的非特异性细胞免疫功能,如免疫监视、抗原递呈等,以便活化T淋巴细胞。白血病作为血液恶性肿瘤,临床中需考虑化疗后或骨髓移植后对残留微小病灶的治疗及预防复发,而ISCOM型瘤苗明显提高荷瘤小鼠的巨噬细胞杀伤功能,为进一步激活T淋巴细胞创造条件。在临床中,白血病患者治疗后采用ISCOM型瘤苗,对消灭残留微小病灶、防止复发意义重大。
参考文献
[1]Morein B,Hu KF,Abusugra I.Current status and potential application of ISCOMs in veterinary medicine[J].Adv Drug Deliv Rev,2004,56(10):1367-1382.
[2]Iino T,Suehiro Y,Hasegawa A,et al.A therapeutic vaccine in adult T-cell leukemia patients with autologous dendritic cells pulsed with peptides corresponding to tax-specific cytotoxic T lymphocyte epitopes[J].Blood,2013,122(21):5130-5130.
[3] Lövgren-Bengtsson K,Morein B.The ISCOMTMtechnology[M].Methods Mlecular MedicineTM,New York,2000:239-258.
[4]Conrad DP,Tsang J,Maclean M,et al.Leukemia cell-rhabdovirus vaccine:personalized immunotherapy for acute lymphoblastic leukemia[J].Clin Cancer Res,2013,19(14):3832-3843.
[5]Subklewe M,Geiger C,Lichtenegger FS,et al.New generation dendritic cell vaccine for immunotherapy of acute myeloid leukemia[J].Cancer Immunol Immunother,2014,63(10):1093-1103.
[6]Camussone CM,Veaute CM,Pujato N,et al.Immune response of heifers against a Staphylococcus aureus CP5 whole cell and lysate vaccine formulated with ISCOM Matrix adjuvant[J].Res Vet Sci,2014,96(1):86-94.
[7]Xiong Q,Wei Y,Feng Z,et al.Protective efficacy of a live attenuated Mycoplasma hyopneumoniae vaccine with an ISCOM-matrix adjuvant in pigs[J].Vet J,2014,199(2):268-274.
[8]Lele SS,Mukhopadhyay BN,Mardikar MM,et al.Impact of catalytic iron on mortality in patients with acute coronary syndrome exposed to iodinated radiocontrast-The Iscom Study[J].Am Heart J,2013,165(5):744-751.
[9]Moore DP,Hodgins DC,Firth MA,et al.Incorporation of antigens from Mannheimia haemolytica culture supernatant,and recombinant bovine C3d into ISCOM matrix using neutravidin-biotin interaction[J].Biotechnol Appl Biochem,2011,58(3):198-202.
[10]Rasool MH.Preparation and evaluation of an experimental iscom-based infectious bursal disease vaccine[J].Indian J Microbiol,2008,48(3):401-404.
[11]McManus M,Frangoul H,McCullers JA,et al.Safety of high dose trivalent inactivated influenza vaccine in pediatric patients with acute lymphoblastic leukemia[J].Pediatr Blood Cancer,2014,61(5):815-820.
[12]尤旭.日本血吸虫尾蚴分泌蛋白SjCa8对小鼠巨噬细胞作用的实验研究[D].广州:中山大学,2010.
[13]熊祺琰,王占伟,甘源,等.免疫刺激复合物基质为佐剂的猪支原体肺炎活疫苗肌肉注射免疫效果评价[J].江苏农业学报,2011,27(6):1310-1315.
[14] Berenjian S,Hu K,Abedi-Valugerdi M,et al.The nanoparticulate Quillaja saponin KGI exerts anti-proliferative effects by down-regulation of cell cycle molecules in U937 and HL-60 human leukemia cells[J].Leuk Lymphoma,2014,55(7):1618-1624.
[15]Ahlberg V,Lvgren Bengtsson K,Wallgren P,et al.Global transcriptional response to ISCOM-Matrix adjuvant at the site of administration and in the draining lymph node early after intramuscular injection in pigs[J].Dev Comp Immunol,2012,38(1):17-26.
Study on effect of ISCOM leukemia vaccine on mouse macrophages﹡
WuSun,HuangYan,YangMan,ZiYoumei,MaDong,HeLishan
(DepartmentofHematology,FirstAffiliatedHospitalofXinxiangMedicalUniversity,Xinxiang,Henan453100,China)
[Abstract]ObjectiveTo investigate the effect of immunostimulatory complex(ISCOM) leukemia vaccine on macrophages of tumor-burdened mice.MethodsA total of 30 C57BL/6 mice were randomly divided into the model group,inactivated erythroleukemia cell FBL-3 vaccine group and inactivated FBL-3 cell plus ISCOM leukemia vaccine group.The FBL-3 cell leukemia tumor-burdened mice model was established by injection of FBL-3 cells.After treatment for 4 weeks,the mouse peritoneal macrophages were separated.Their phagocytosis effect,NO TNF-α and IL-1,killing activity and antigen-presenting function were investigated in various groups.ResultsThe number of mouse abdominal cavity macrophages,macrophage phagocytosis function,IL-1,TNF-α,NO,IL-2 and T cell proliferation ability in the ISCOM leukemia vaccine group were higher than those in the model group and the inactivated FBL-3 tumor vaccines group(P<0.05).The cell killing activity of macrophages in the ISCOM leukemia vaccine group was significantly higher than that in the model group(P<0.01).ConclusionThe ISCOM leukemia vaccine can increase the number of macrophages and enhance the phagocytosis and antigen-presenting ability of macrophages.
[Key words]leukemia vaccine;macrophages;ISCOMs
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.04.007
*基金项目:河南省教育厅基金资助项目(2006320039)。
作者简介:吴隼(1968-),副教授、副主任医师,硕士研究生,主要从事血液病恶性肿瘤的免疫治疗研究。
[中图分类号]R392.5
[文献标识码]A
[文章编号]1671-8348(2016)04-0451-03
(收稿日期:2015-06-18修回日期:2015-10-24)
