表面增强拉曼光谱法快速检测脐橙果肉中三唑磷农药残留
2016-06-15王晓彬吴瑞梅刘木华张庐陵陈金印
王晓彬, 吴瑞梅, 凌 晶, 刘木华, 张庐陵, 蔺 磊, 陈金印
1. 江西农业大学生物光电及应用重点实验室, 江西 南昌 330045
2. 江西出入境检验检疫局技术中心, 江西 南昌 330002
3. 江西农业大学农学院, 江西 南昌 330045
表面增强拉曼光谱法快速检测脐橙果肉中三唑磷农药残留
王晓彬1, 吴瑞梅1, 凌 晶2, 刘木华1, 张庐陵1, 蔺 磊1, 陈金印3*
1. 江西农业大学生物光电及应用重点实验室, 江西 南昌 330045
2. 江西出入境检验检疫局技术中心, 江西 南昌 330002
3. 江西农业大学农学院, 江西 南昌 330045
采用表面增强拉曼光谱技术结合快速溶剂前处理方法检测脐橙果肉中三唑磷农药残留, 应用化学计量学方法建立脐橙果肉中三唑磷农药残留的快速检测模型。 以脐橙果肉提取液为基质, 采用N-丙基乙二胺、 C18和石墨化碳去除果肉中有机酸、 色素等荧光物质, 配制不同浓度的三唑磷农药溶液, 应用不同预处理方法对光谱信号进行预处理, 建立偏最小二乘模型。 结果表明, 以脐橙果肉提取液为基质的三唑磷溶液最低检测浓度低于0.5mg·L-1; 归一化预处理后建立的模型预测性能最好, 模型对预测集样本的均方根误差为1.38 mg·L-1, 相关系数为0.976 6, 相对分析误差为(RPD)4.66。 预测回收率为95.97%~103.18%, 相对误差绝对值在5%以下, 表明模型具有较好的预测效果。 对4个未知浓度样本进行配对t检验, 预测值与真实值无显著差异, 说明所建立的方法准确可靠。
表面增强拉曼光谱; 脐橙果肉; 三唑磷; 快速检测
引 言
三唑磷(triazophos), 化学名称为O,O-二乙基-O-(1-苯基-l,2,4-三唑-3-基)硫代磷酸酯, 是一种中毒广谱有机磷杀虫剂, 具有强烈的触杀和胃毒作用, 渗透性较强, 无内吸作用, 主要用于防治果树、 水稻和棉花上的鳞翅目害虫、 害螨等[1]。 三唑磷随食物进入人体后, 会造成大量乙酰胆碱蓄积在神经效应器接点处, 发生毒蕈碱样、 烟碱样及中枢神经系统症状[2]。 三唑磷在食品和农产品中残留问题逐渐引起关注, 目前三唑磷农药的常规检测方法有气相色谱法[3]、 超高效液相色谱-串联质谱法[4]等, 但这些方法前处理复杂、 成本高、 检测速度慢, 不适于现场实时检测。
表面增强拉曼光谱(surface enhanced Raman spectroscopy, SERS)是指将待测物分子吸附在特殊制备的金属材料(如金、 银等)表面或溶胶中, 激光照射到吸附有金、 银颗粒的待测试样时, 金属表面电场会增强, 使待测物拉曼信号能增强104~1010倍[5-7]。 SERS技术具有样品制备简单、 检测速度快、 灵敏度高等优点, 能实现对微量样品的快速检测, 已逐步应用于食品、 农产品中农药残留的快速检测[8-10]。 刘燕德等[11]利用共焦显微拉曼光谱技术分析了脐橙表皮的乐果农药残留, 建立了脐橙表皮乐果农药残留的预测模型。 Shetan等[12]利用固相萃取技术对橙汁进行前处理, 获取含甲基毒死蜱农药的提取液, 结合SERS技术, 检测最低浓度为50 ppb。 Liu等[13]利用金镀膜作为SERS活性基底, 检测了苹果和番茄表皮的农药残留, 回收率为78%~124%。 Wisiani等[14]应用SERS技术检测苹果果肉、 苹果汁和苹果表皮的啶虫脒农药残留, 果肉、 果汁和果皮的最低检测浓度分别为0.5, 3 μg·mL-1和0.125μg·cm-2。 脐橙中含量丰富的糖类、 有机酸、 矿物质、 纤维素、 蛋白质、 氨基酸和维生素等大分子物质, 这些物质容易对农药的拉曼信号产生干拢, 影响方法的精密度。 上述方法使用表面增强拉曼光谱技术能达到对水果中农药分子信号增强的目的, 但并未去除基质物质的影响, 要实现快速检测其试验方法需进一步完善。
采用SERS技术结合商业化的金纳米增强试剂对脐橙果肉中三唑磷农药残留进行快速检测。 利用快速溶剂提取前处理方法提取果肉的提取液, 采用N-丙基乙二胺、 C18和石墨化碳去除有机酸、 色素等物质的影响, 结合化学计量学方法, 实现了脐橙果肉中三唑磷农药的快速检测。
1 实验部分
1.1 仪器与试剂
RamTracer-200-HS 高灵敏度激光拉曼光谱仪、 纳米增强试剂202和103(苏州欧普图斯光学纳米科技有限公司); Agilent GC/MS 7000B型三重四极杆气相色谱串联质谱仪、 HP-5MS 30 m×0.25 mm×0.25 μm石英毛细管柱(美国安捷伦科技有限公司); JW1024低速离心机(安徽嘉文仪器设备有限公司); BL25C33型搅拌机(佛山美的集团股份有限公司); 涡旋混合器(海门市其林贝尔仪器制造有限公司); FA1004B电子天平型(上海上平仪器有限公司); 0.22 μm有机滤膜(安捷伦科技有限公司)。 三唑磷(Sigma-Aldrich公司, 纯度97.2%); 乙腈(国药集团化学试剂有限公司, 色谱纯); 无水硫酸镁、 氯化钠(国药集团化学试剂有限公司, 分析纯); N-丙基乙二胺, C18(北京迪马科技有限公司); 石墨化碳(天津博纳艾杰尔科技有限公司); 脐橙(赣州大余脐橙基地); 含农药脐橙(江西出入境检验检疫局提供)。
1.2 方法
1.2.1 气相色谱串联质谱试验条件
色谱条件: 进样口温度: 250 ℃; 升温程序: 初始温度为150 ℃, 保持2 min; 以25 ℃·min-1升至280 ℃, 保持2 min; 升至300 ℃, 保持2 min烘干色谱柱后进行下一个样本检测; 载气: 氦气(纯度≥99.999%); 载气流速: 1.2 mL·min-1; 进样量: 1 μL; 进样方式: 不分流进样。
离子源: EI源; 离子源温度: 230 ℃; 四极杆温度: 150 ℃; 碰撞气: 氮气(纯度≥99.999%); 采集模式: 多反应监测模式(MRM)。
1.2.2 样品制备
三唑磷标准溶液配制: 称取10 mg三唑磷标准品, 用适量乙腈溶于100 mL棕色容量瓶中, 超声溶解后, 用乙腈定容至刻度, 得到浓度为100 mg·L-1的三唑磷标准储备液。 用乙腈将标准储备液分别稀释为20, 15 , 12, 10, 8, 6, 4, 2, 1, 0.8, 0.6, 0.5, 0.4和0.3 mg·L-1的标准工作液, 于4 ℃避光环境中保存。
以脐橙果肉提取液为基质的三唑磷溶液配制: (1)采用经气相色谱串联质谱检测无农药残留的新鲜脐橙, 去皮后将其可食用部分切碎, 放入搅拌机捣碎成浆状, 备用。 (2)称取10 g果肉样品于50 mL离心管中, 依次加入10 mL乙腈、 适量无水硫酸镁和氯化钠, 摇匀后以400 r·min-1的转速涡旋混合2 min, 将离心管放入离心机以4 200 r·min-1的速度离心5 min, 上清液为黄色。 (3)取上述黄色上清液4 mL, 放于装有适量无水硫酸镁、 N-丙基乙二胺、 C18和石墨化碳的15 mL离心管中, 摇匀后以400 r·min-1的转速涡旋混合2 min, 去除有机酸、 色素等基质的影响, 此时溶液由黄色变为无色, 将此离心管放入离心机以4 200 r·min-1的速度离心5 min, 得到无色上清液, 上清液过0.22 μm有机滤膜。 (4)用步骤(3)的过滤液为基质, 分别配制不同浓度(20, 15, 12, 10, 8, 6, 4, 2, 1, 0.8, 0.6和0.5 mg·L-1共12个浓度梯度)的三唑磷溶液, 进行拉曼光谱检测。 每个浓度梯度制配6个平行样本, 共72个样本。
1.2.3 光谱数据采集
向2 mL进样瓶中依次加入500 μL OTR202试剂、 20 μL待测样本和100 μL OTR103试剂, 混合均匀后放入样品池中采集拉曼信号。 拉曼光谱采集参数为: 785 nm的激光波长, 激光光源功率为200 mW, 光学分辨率4 cm-1, 拉曼光谱采集范围为400~1 800 cm-1, 积分时间10 s, 积分2次取平均。
1.2.4 数据处理
为了消除随机噪声、 基线偏移和背景的干扰, 采用不同的预处理方法对原始光谱数据进预处理: 归一化(Normalization)、 多元散射校正(multiplicative scatter correction, MSC)、 标准正态变量变换(standard normal variate transformation, SNV), 比较各预处理方法的效果, 建立偏最小二乘(partial least squares, PLS)模型。 以校正集交互验证均方根误差(RMSECV)、 校正集相关系数(Rc)、 预测集均方根误差(RMSEP)、 预测集相关系数(Rp)、 相对分析误差(RPD)对模型进行综合评价。 采用4个未知浓度样本来评价模型准确度, 比较模型预测值与真实值之间的差异, 并进行配对t检验, 来验证模型的准确度。 所有数据分析基于MATAB 7.11(Mathworks, USA)软件平台完成。
2 结果与讨论
2.1 三唑磷的拉曼光谱
图1为三唑磷农药的分子结构图和表面增强拉曼光谱图, 其中, 图1(a)为三唑磷分子结构图, 从图可看出, 三唑磷农药分子结构由苯环、 三唑环、 硫代磷酸酯和乙基组成;
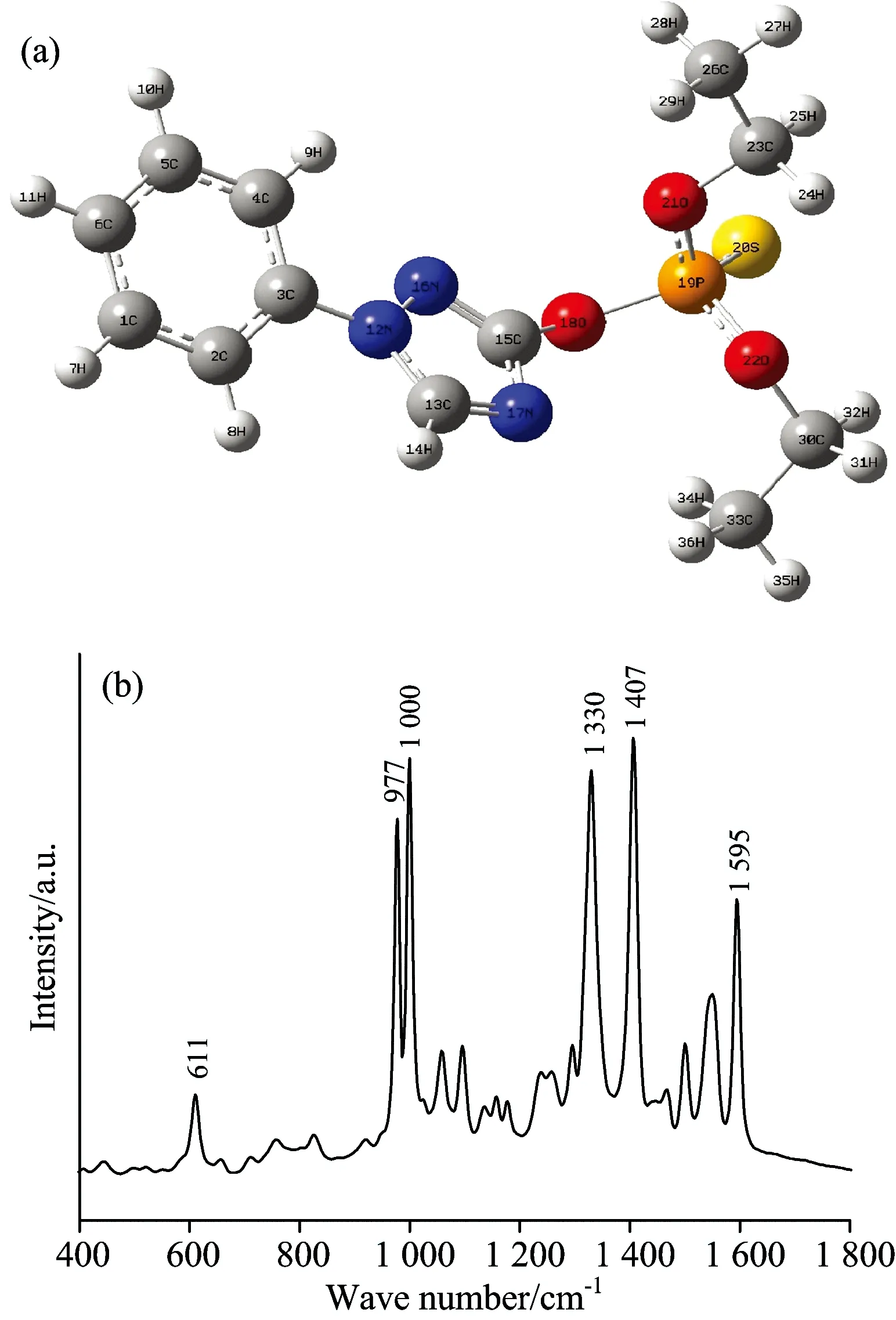
Fig.1 Triazophos (a) molecular structure (b) SERS
2.2 三唑磷标准溶液的表面增强拉曼光谱分析
图2(a)为不同浓度三唑磷标准溶液的表面增强拉曼光谱。 由图可看出, 随着三唑磷标准溶液浓度增加, 其特征峰的强度不断增强, 但各特征峰的峰强度变化幅度不同, 611和977 cm-1处随浓度变化幅度较小, 1 000 cm-1处随浓度变化幅度较小, 这可能是因为三唑磷农药分子中不同基团与纳米增强粒子表面吸附位置以及作用力的大小和方向不同导致[17]。 对标准溶液光谱进行二阶导数处理, 如图2(b)所示, 原始光谱经二阶导数后, 消除了基线漂移的影响, 611, 977, 1 000, 1 330, 1 407, 1 595 cm-1处农药拉曼特征峰明显, 其相对强度随浓度的增大而增强。

Fig.2 (a) SERS spectra of triazophos with different concentrations. (b) Second derivative transformation of SERS spectra of triazophos with different concentrations. Concentration (a~e): 20, 10, 1, 0.5, 0.3 mg·L-1
图3(a)是以果肉提取液为基质的三唑磷溶液表面增强拉曼光谱(浓度为10 mg·L-1), 图3(b)是果肉基质的表面增强拉曼光谱, 图3(c)是乙腈的表面增强拉曼光谱, 图3(d)是纳米增强试剂的拉曼光谱。 由图3可看出, 纳米增强试剂、 乙腈和果肉基质的拉曼峰与三唑磷农药的拉曼特征峰不重合, 说明纳米增强试剂、 乙腈和果肉基质不会对三唑磷的拉曼特征峰产生干扰。
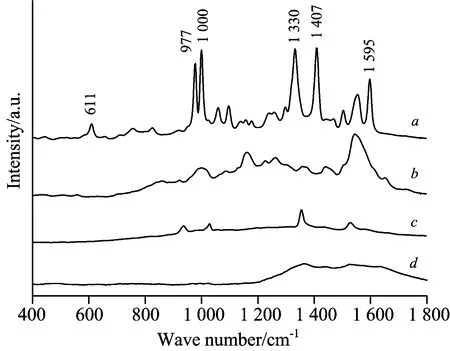
Fig.3 SERS spectra.a: Triazophos solution with flesh extract as the matrix;b: Flesh extract solution;c: Acetonitrile;d: Nano-enhanced reagents
2.3 果肉中三唑磷农药残留检测结果分析
图4(a)是采用N-丙基乙二胺、 C18和石墨化碳对脐橙果肉提取液进行净化前后对比图, 图4(b)为净化后a和未净化b的以果肉提取液为基质三唑磷溶液(浓度为10 mg·L-1)的SERS, 图4(b)c为果肉提取液的SERS。 从图可看出, 未净化脐橙果肉提取液的SERS在900~1 700 cm-1有较大的基线漂移, 这是由于核黄素和胡萝卜素等荧光物质干扰导致的[18]。 在未净化以果肉提取液为基质的三唑磷溶液SERS中, 三唑磷6处拉曼特征峰均可见, 但谱峰强度较低, 这是因为受荧光信号的干扰, 三唑磷农药分子的拉曼信号被掩盖。 采用N-丙基乙二胺、 C18和石墨化碳对脐橙果肉提取液进行净化处理后的SERS图中[见图4(b)a], 三唑磷的6处拉曼特征峰明显且谱峰强度高, 无明显基线漂移, 说明N-丙基乙二胺、 C18和石墨化碳对脐橙果肉提取液有较好的净化效果。

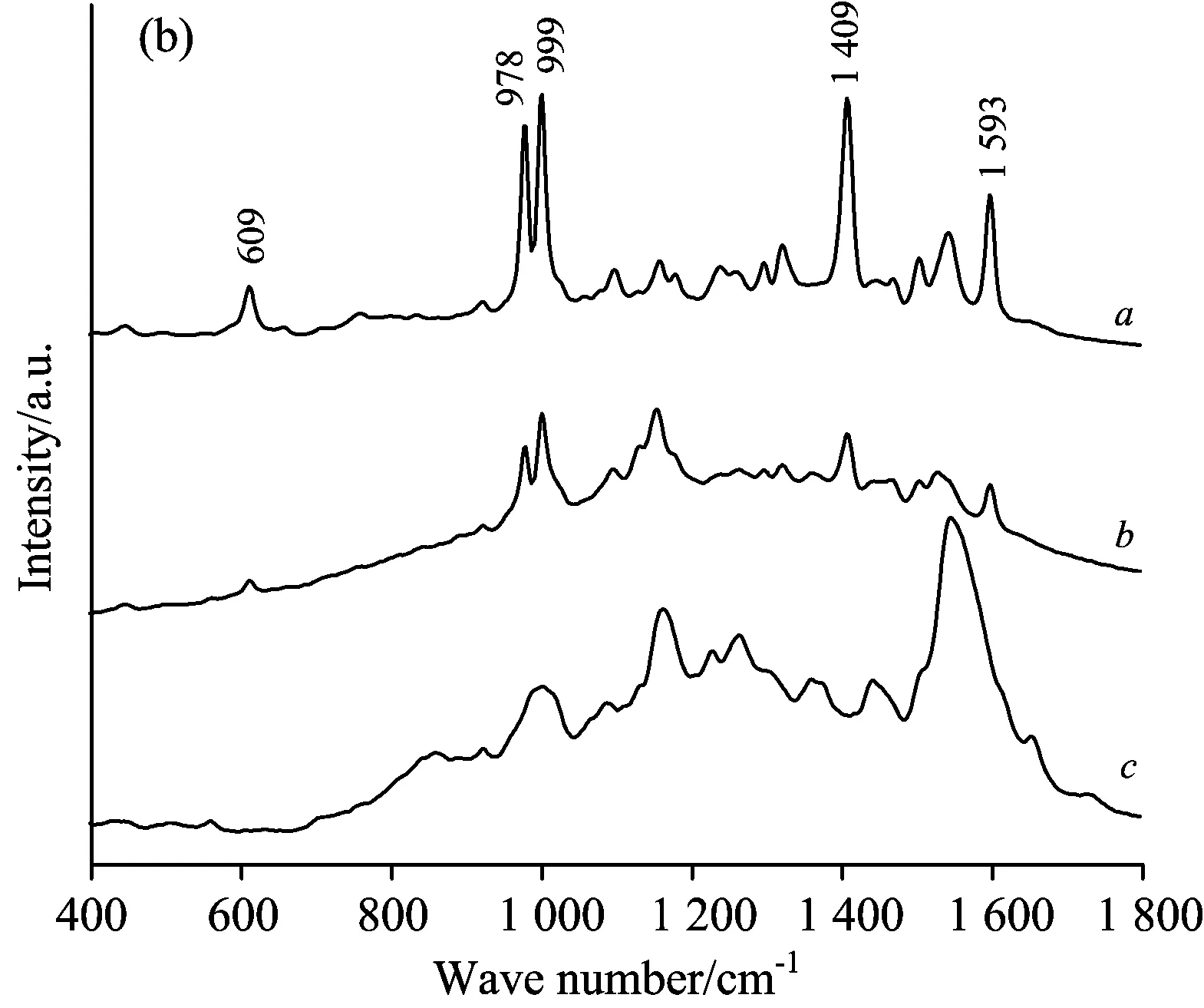
Fig.4aSERS spectrum of triazophos pesticide in flesh of navel orange (10 mg·L-1) with purified,bSERS spectrum of triazophos pesticide in flesh of navel orange (10 mg·L-1),cSERS of extract of fresh
图5(a)为不同浓度以果肉提取液为基质的三唑磷溶液表面增强拉曼光谱。 对比图3, 以脐橙果肉提取液为基质的三唑磷溶液的SERS相对于三唑磷标准溶液SERS发生了偏移, 这是因为果肉提取液成分复杂, 虽然核黄素和胡萝卜素去除后不会对三唑磷农药的拉曼信号产生荧光干扰, 但三唑磷基团振动的频率会受其他成分的影响而发生变化[19]。 图中浓度为20和10 mg·L-1时, 三唑磷的6处特征峰明显, 易识别; 浓度为1 mg·L-1时, 609 cm-1处的特征峰已无法判别, 其他5处的拉曼特征峰的峰强度明显降低, 但依然能识别; 浓度为0.6 mg·L-1时, 978, 999和1 409 cm-1处特征峰可识别, 但1 409 cm-1处峰强度较低; 浓度为0.5 mg·L-1时, 1 409 cm-1处特征峰依然存在, 但峰强十分微弱; 浓度为0.4 mg·L-1时, 其SERS信号与果肉提取液的SERS信号基本一致, 未出现三唑磷农药的拉曼特征峰。 因此, 利用表面增强拉曼光谱方法检测脐橙果肉中三唑磷农药的最低检测浓度低于0.5 mg·L-1。
文献[12]初步采用SERS技术检测橙汁中甲基毒死蜱农药残留, 前处理过程为12 min, 最低检测浓度为0.05 ppm, 但该文献只对橙汁中农药残留检测做了定性判别, 方法的准确性未进一步验证。 由于不同种类农药的拉曼增强效应差异较大, 且不同增强基底对同一种类农药的增强效应也不同[20]。 在今后研究中, 将进一步探讨适合于三唑磷农药的增强基底, 以提高方法的检测限。
对不同浓度以果肉提取液为基质的三唑磷溶液的原始拉曼光谱进行二阶导数处理, 如图5(b)所示, 原始光谱经二阶导数后, 609, 978, 999, 1 409, 1 593 cm-1处拉曼特征峰明显, 其相对强度随浓度的增大而增强。 因此, 可采用化学计量方法建立脐橙果肉中三唑磷农药残留的预测模型, 对三唑磷进行定量分析。

Fig.5 (a) SERS spectra of triazophos inserted-treatment solutions with different concentrations. (b) second derivative transformation of SERS spectra of triazophos inserted-treatment solutions with different concentrations. Concentration (a~f): 20, 10, 1, 0.5, 0.4 mg·L-1, Pulp juice
2.4 脐橙果肉中三唑磷农药残留的定量分析
拉曼光谱采集时, 会受到随机噪声、 基线漂移、 外界杂散光和CCD检测器热稳定噪声等因素影响, 直接影响模型的可靠性和稳健性[21]。 因此, 需要对原始光谱进行预处理, 增强特征信息, 提高模型的预测能力。 采用归一化、 MSC、 SNV预处理方法对原始光谱进行预处理, 由各种预处理方法处理后所建PLS(偏最小二乘回归)模型的预测效果来选择最佳预处理方法。 从72个样本中选取其中的43个组成校正集, 余下的29个组成预测集。 表1为原始光谱经不同预处理方法后所建模型的结果。 由表1可知, 经各种预处理方法后所建模型的预测结果均优于原始光谱, 且归一化预处理方法效果最好。 当主成分数为9时, 所建模型对校正集样本的相关系数(Rc)为0.981 1, 交互验证均方根误差(RMSECV)为1.19 mg·L-1, 对预测集样本的相关系数(Rp)为0.976 6, 预测均方根误差(RMSEP)为1.38 mg·L-1, 相对分析误差(RPD)为4.66, 高于3.0, 说明采用表面增强拉曼光谱方法预测脐橙中三唑磷农药残留是可行的。 图6为经归一化预处理所建模型对校正集和预测集样本的预测值与实际值之间的散点图。

Table 1 Results for each of the pre-processing method
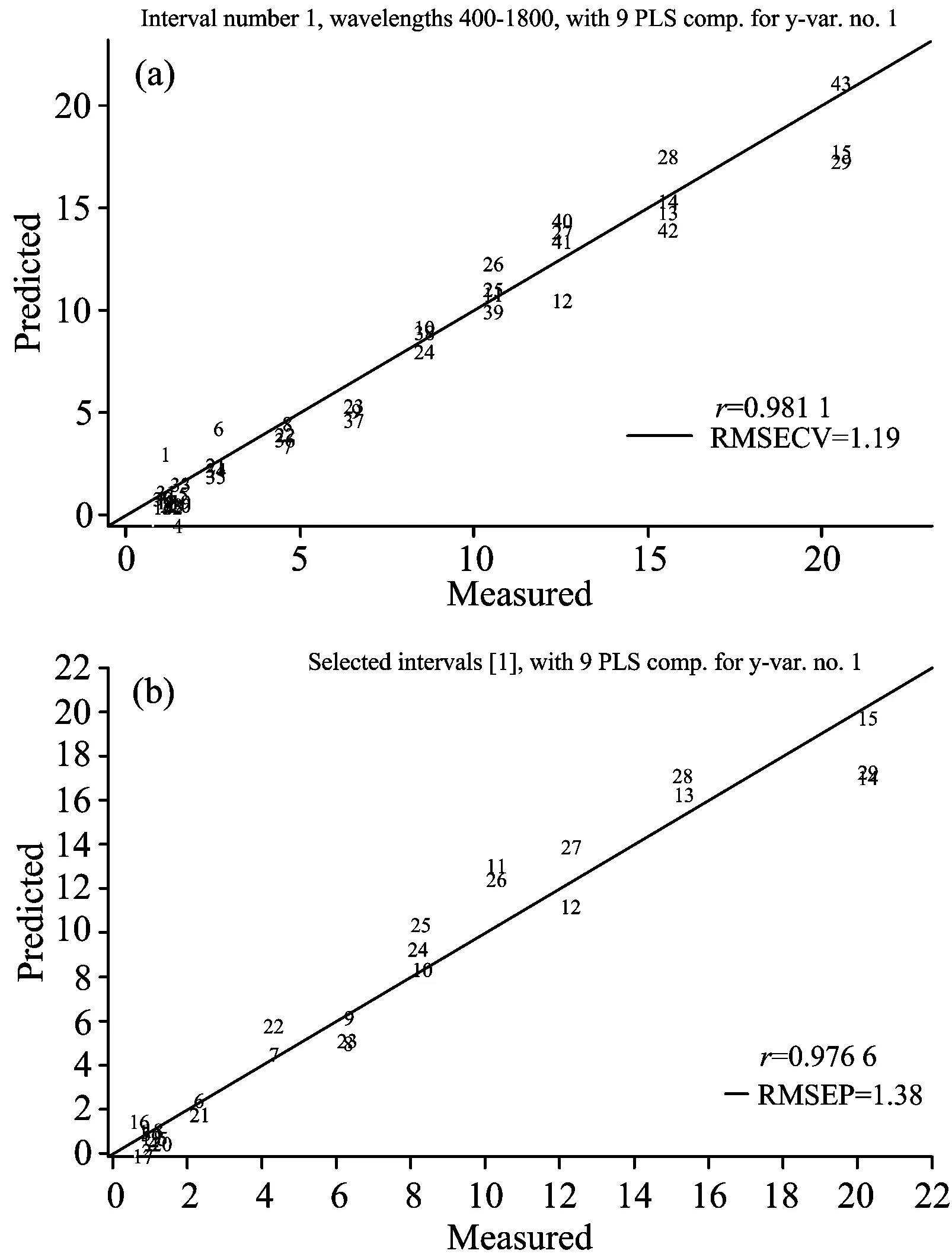
Fig.6 Reference measurement versus NIR prediction in calibration set (a) and prediction set (b)
2.5 预测样本的分析结果和评价
2.5.1 预测回收率
为检验方法的准确性, 采用江西出入境检验检疫局含三唑磷农药的脐橙样本进行检测。 图7(a)为三唑磷标准溶液的色谱图, 图7(b)为含三唑磷农药脐橙果肉样品色谱图, 图7(c)为脐橙果肉阴性基质的色谱图, 由图可看出, 三唑磷农药的保留时间为7.779 min。
对4个含三唑磷农药的脐橙果肉样本进行前处理, 采集6次拉曼信号取平均, 采用标准曲线模型对样本进行预测, 并与标准化学方法测定结果进行比较, 结果见表2。 由表2可知, 本方法的检测结果与标准方法基本一致, 4个脐橙果肉样本中三唑磷农药的预测值与真实值相对误差的绝对值为2.43%~4.20%, 预测回收率为95.97%~103.18%, 说明该方法能初步达到脐橙果肉中三唑磷农药残留快速筛查的目的。
2.5.2 模型对未知浓度样本的t检验
对4个含三唑磷农药的脐橙果肉样本的预测值和真实值进行配对t检验, 结果见表3。t=0.162, 其绝对值小于t0.05, 3= 3.182, 表明预测值和真实值之间无显著差异, 说明采用表面增强拉曼光谱方法应用于脐橙果肉中三唑磷农药残留检测是准确可靠的。

Fig.7 Gas chromatogram
(a): Triazophos pesticide(0.2 mg·L-1); (b): Navel orange flesh containing pesticides; (c): Flesh matrix

Table 2 Predicted value and Measured value of

Table 3 T-test result between the reference
3 结 论
采用快速溶剂提取前处理方法和表面增强拉曼光谱技术快速检测脐橙果肉中三唑磷农药残留, 获得三唑磷农药的6处拉曼特征峰, 这些特征峰可作为三唑磷农药的定性定量判别依据, 该方法对脐橙果肉中三唑磷农药的最低检测浓度低于0.5 mg·L-1。 分别采用归一化、 多元散射校正和标准正态变换对脐橙果肉的原始拉曼光谱进行预处理, 结果表明, 经归一化预处理后所建PLS模型预测性能最好。 用4个含三唑磷农药的脐橙果肉样本对模型的准确性进行验证, 结果显示本方法的检测结果与标准方法基本一致; 配对t检验结果显示样本的预测值与实际测量值之间无显著差异, 说明采用该方法检测脐橙果肉中的三唑磷农药残留是准确可靠的。 研究结果为脐橙中农药残留的现场实时快速检测提供了方法支持, 研究方法和思路能为农产品中其他农药的拉曼光谱快速检测提供参考。
[1] ZHANG Zhi-heng, YUAN Yu-wei, ZHENG Wei-ran, et al(张志恒, 袁玉伟, 郑蔚然, 等). Chinese Journal of Pesticide Science(农药学学报), 2011, 13(5): 485.
[2] WEI Qian-ni, HUANG Kui-ying, LEI Hong-tao, et al(韦倩妮, 黄魁英, 雷红涛, 等). Food Science(食品科学), 2011, 32(1): 154.
[3] QIAO Gui-fang, HU Mei, FU Xiao(乔桂芳, 胡 玫, 付 晓). Modern Agrochemicals(现代农药), 2014, 13(02): 37.
[4] WANG Yu-jian, HUANG Hui-ling, XUAN Kai-zhi, et al(王玉健, 黄惠玲, 禤开智, 等). Chinese Journal of Analysis Laboratory(分析试验室), 2011, 30(05): 77.
[5] TAO Qin, DONG Jian, QIAN Wei-ping(陶 琴, 董 健, 钱卫平). Progress in Chemistry(化学进展), 2013, 06: 1031.
[6] WANG Xiao-bin, WU Rui-mei, LIU Mu-hua, et al(王晓彬, 吴瑞梅, 刘木华, 等). Journal of Nuclear Agricultural Sciences(核农学报), 2014, 28(10): 1874.
[7] MO Bing, LI He-ping, CHEN Juan, et al(莫 冰, 李和平, 陈 娟, 等). The Journal of Light Scattering(光散射学报), 2013, 25(3): 219.
[8] Csilla M, Leontin D, Vasile C, et al. Food Chemistry, 2014, 145: 814.
[9] Li X Z, Zhang S, Yu Z, et al. Applied Spectroscopy, 2014, 68(4): 483.
[10] Li Q Q, Du Y P, Xu P, et al.Chinese Chemical Letters, 2013, 24: 332.
[11] LIU Yan-de, YE Bing(刘燕德, 叶 兵). Journal of Chinese Agricultural Mechanization(中国农机化学报), 2014, 35(1): 88.
[12] Shende C, Inscore F, Sengupta A, et al. Sensing and Instrumentation for Food Quality and Safety, 2010, 4: 101.
[13] Liu B, Zhou P, Liu X, et al. Food and Bioprocess Technology, 2013, 6(3): 710.
[14] Wijaya W, Pang S, Labuza T P, et al. Journal of Food Science, 2014, 79(4): 743.
[15] ZHU Zi-ying, GU Ren-ao, LU Tian-hong(朱自莹, 顾仁敖, 陆天虹). Raman Spectroscopy in Chemistry(拉曼光谱在化学中的应用). Shenyang: Northeastern University Press(沈阳: 东北大学出版社), 1998.
[16] ZHU Zi-ying(朱自莹). Raman Frequencies of Organic Compounds(有机化合物的特征拉曼频率). Beijing: Chinese Chemical Society(北京: 中国化学会), 1980.
[17] ZHAI Fu-li, HUANG Zhi-qun, WANG Xi-chang, et al(翟福丽, 黄轶群, 王锡昌, 等). Chinese Journal of Analytical Chemistry(分析化学), 2012, 40(5): 718.
[18] GUO Lang-hua, PENG Yan-kun, LI Yong-yu, et al(郭浪花, 彭彦昆, 李永玉, 等). Journal of Food Safety & Quality(食品安全质量检测学报), 2014, 5(3): 697.
[19] HUANG Shu-shi, LAI Jun-zhuo, LIANG Yu-fen, et al(黄庶识, 赖钧灼, 梁裕芬, 等). Chinese Journal of Analytical Chemistry(分析化学), 2011, 39(4): 521.
[20] FAN Yu-xia, LAI Ke-qiang, HUANG Yi-qun(樊玉霞, 赖克强, 黄轶群). Spectroscopy and Spectral Analysis(光谱学与光谱分析), 2014, 34(7): 1859.
[21] WENG Shi-zhuang, ZHENG Shou-guo, LI Pan, et al(翁士状, 郑守国, 李 盼, 等). The Journal of Light Scattering(光散射学报), 2012, 24(4): 325.
*Corresponding author
Study on the Rapid Detection of Triazophos Residues in Flesh of Navel Orange by Using Surface-Enhanced Raman Scattering
WANG Xiao-bin1, WU Rui-mei1, LING Jing2, LIU Mu-hua1, ZHANG Lu-ling1, LIN Lei1, CHEN Jin-yin3*
1. Optics-Electrics Application of Biomaterials Lab, Jiangxi Agricultural University, Nanchang 330045, China
2. Jiangxi Entry-Exit Inspection and Quarantine Bureau, Nanchang 330002, China
3. College of Agronomy, Jiangxi Agricultural University, Nanchang 330045, China
Surface enhanced Raman spectroscopy (SERS) and quick pre-treatment technology were used to detect triazophos residues in flesh of navel orange. Quantitative analysis model was developed by partial least squares (PLS) algorithm. SERS of different concentration (0.5 to 20 mg·L-1) triazophos juice solution with flesh extract as the matrix were collected by laser Raman spectrometer. Three preprocessing methods such as normalization, MSC and SNV were used to optimize Raman signals and PLS models were set up. The results showed that minimum detection concentration for triazophos in navel orange below 0.5 mg·L-1. The model built with normalization pre-processing gave the best result; the values of correlation (Rp) and Root mean square error of prediction set (RMSEP) were 1.38 and 0.976 6, respectively. The predict recoveries were 95.97%~103.18% and the absolute values of relative errors were below 5%. T-test (t=-0.018) showed that there was no significant difference between the true values and prediction values. This study demonstrates that this method is accurate and reliable.
Surface-enhanced Raman spectroscopy; Flesh of navel orange; Triazophos; Detection
Oct. 16, 2014; accepted Jan. 20, 2015)
2014-10-16,
2015-01-20
赣鄱英才555工程人选计划(2012-62), 国家自然科学基金项目(31271612)和江西省学术带头人培养计划(20113BCB22001)资助
王晓彬, 1989年生, 江西农业大学生物光电及应用重点实验室硕士研究生 e-mail: tawangxiaobin@126.com *通讯联系人 e-mail: jinyinchen@126.com
O657.3
A
10.3964/j.issn.1000-0593(2016)03-0736-07
猜你喜欢
杂志排行
光谱学与光谱分析的其它文章
- 基于SVM与RF的苹果树冠LAI高光谱估测
- 基于非均匀B样条的拉曼光谱基线校正算法
- 不同硬实率紫花苜蓿种子的近红外光谱分析
- 衰减全反射红外光谱法快速检测沥青性质的研究
- Study on the Comparisons of the Establishment of Two Mathematical Modeling Methods for Soil Organic Matter Content Based on Spectral Reflectance
- A Relative Humidity Pulse Approach to Observe Mass Transfer Processes Controlled by Bulk and Surface for Aerosols
