拉曼光谱法鉴定文物及艺术品中染料的研究进展
2016-06-15何秋菊王丽琴
何秋菊,王丽琴
1. 西北大学文化遗产学院,文化遗产研究与保护技术教育部重点实验室,陕西 西安 710069 2. 首都博物馆文物保护修复中心,北京 100045
拉曼光谱法鉴定文物及艺术品中染料的研究进展
何秋菊1, 2,王丽琴1*
1. 西北大学文化遗产学院,文化遗产研究与保护技术教育部重点实验室,陕西 西安 710069 2. 首都博物馆文物保护修复中心,北京 100045
中国是丝绸之路的发源地,染色历史源远流长。文物及艺术品中的有机染料蕴含着制作年代、原料来源、染色工艺及保存状况等丰富的信息,但因染料成分复杂、含量低、易于降解,其鉴定一直是文物分析领域的难点。拉曼光谱作为一种指纹光谱在文物及艺术品中染料分析方面具有独特的优势。系统阐述了显微拉曼光谱法(MRS/μ-Raman)、近红外傅里叶变换拉曼光谱法(NIR-FT-Raman)、表面增强拉曼光谱法(SERS)、共振拉曼光谱(RRS)法的原理、特点、局限性以及在染料鉴定中的研究进展和发展方向; 分类归纳总结出了黄栀子、姜黄等染料的拉曼光谱特性; 对比分析了紫茜素在采用不同波长激光器激发下的荧光现象; 介绍了以自制的灰绿色银胶颗粒为基底,联合薄层色谱(TLC) 分离技术及SERS鉴定茜草中的色素,表明银溶胶微粒产生的表面增强效应可显著降低拉曼光谱荧光背底。指出拉曼光谱作为一种快速、便捷的结构定性测试手段在文物和艺术品染料分析中应用前景广阔,提出多种拉曼光谱技术相结合、拉曼光谱技术与分离技术相结合以及拉曼光谱技术与远距离传导技术相结合是拉曼光谱技术的发展趋势。
拉曼光谱; 文物; 艺术品; 染料; 鉴定
引 言
古代文物及艺术品的染色是一门伟大的传统技艺,有着悠久的历史。最初的染色是从植物或动物中提取可溶性染料,变成固着在纤维上的稳定性色素。自1856年英国化学家Perkin发明合成染料苯胺紫后,各类合成染料逐渐开始应用于文物和艺术品中[1]。经过染色一部分染料(如茜素、紫胶酸等)可在金属盐类媒染剂的作用下沉淀于纤维,另一部分还原性染料(如靛蓝、泰尔紫等)通过发酵、氧化等过程固着于纤维,还有一部分染料(如藏红花酸、苏木等)可直接上染。通过对古代文物和艺术品中染色材料的鉴定,有助于了解其制作年代、原料来源及染色工艺。此外,由于有机染料易于老化,通过鉴定也有助于了解染料的保存状况,对后期的修复、保护有着重要的指导意义。
然而,由于染料成分复杂、含量低,且在长时间存放过程中某些化学成分发生了变化,因而其鉴定一直是文物分析领域的难点。虽然紫外-可见光谱、三维荧光光谱、红外光谱以及显微拉曼光谱等分子光谱可用于染料样品的分析鉴定[2-3],但紫外-可见光谱和三维荧光光谱不能获取复杂染料的指纹信息; 红外光谱因较低的灵敏度及纤维载体带来的干扰,难以对微量染料进行鉴定。显微拉曼光谱具有操作简便、无需制样、灵敏度高等特点,20世纪80年代中期以来试用于染料的分析鉴定,但报道较少[4-5]。为了克服显微拉曼光谱法存在的强荧光干扰等弊端,傅里叶变换拉曼、表面增强拉曼、共振拉曼等新型拉曼光谱技术开始引入染料的分析中[6-8]。本文系统阐述了几种主要拉曼光谱法的原理、特点、局限性以及在文物及艺术品染料鉴定中的研究进展,指出了拉曼光谱技术在染料鉴定中的发展方向。
1 显微拉曼光谱法(MRS/μ-Raman)
利用拉曼散射光谱特性可以获取物质分子振动、转动能级的相关信息[9]。显微拉曼光谱技术是将拉曼光谱与显微分析技术相结合的一种应用技术,其中激发光的光斑可聚焦至微米量级,实现样品的微区分析,是一种理想的微量、痕量文物染料样品分析技术。以CCD为代表的多通道探测器的应用,使拉曼信号积分累加效果显著增强,其检测限达到mg·L-1或mmol·L-1数量级[10]。
Clark等[11]利用显微拉曼光谱技术对3副16世纪阿拉伯宇宙和地理学家Qazwini的手稿复制品“Wonders of Creation and Oddities of Existence”进行分析时,发现了染料印度黄的存在,由此推断这些手稿来源于印度。Burgio等[12]利用拉曼光谱、X射线能谱和偏光显微分析对比现代埃及沙草纸和大英博物馆藏13世纪沙草纸显色物质的区别时,发现现代沙草纸主要使用的是20世纪早期合成的酞菁蓝、汉萨黄和β-萘酚红等染料,据此推断这幅作品绘制年代晚于1939年; 而在13世纪沙草纸上只发现了雌黄、埃及蓝等矿物颜料,没有现代合成材料。因此,拉曼光谱技术能够实现艺术品的真伪鉴别。在对现有文献数据[5-6, 13-14]总结的基础上,课题组利用MRS技术系统研究了染料黄栀子、姜黄等的拉曼光谱特性,分类归纳见表1,该研究对染色材料的鉴定具有重要指导意义。
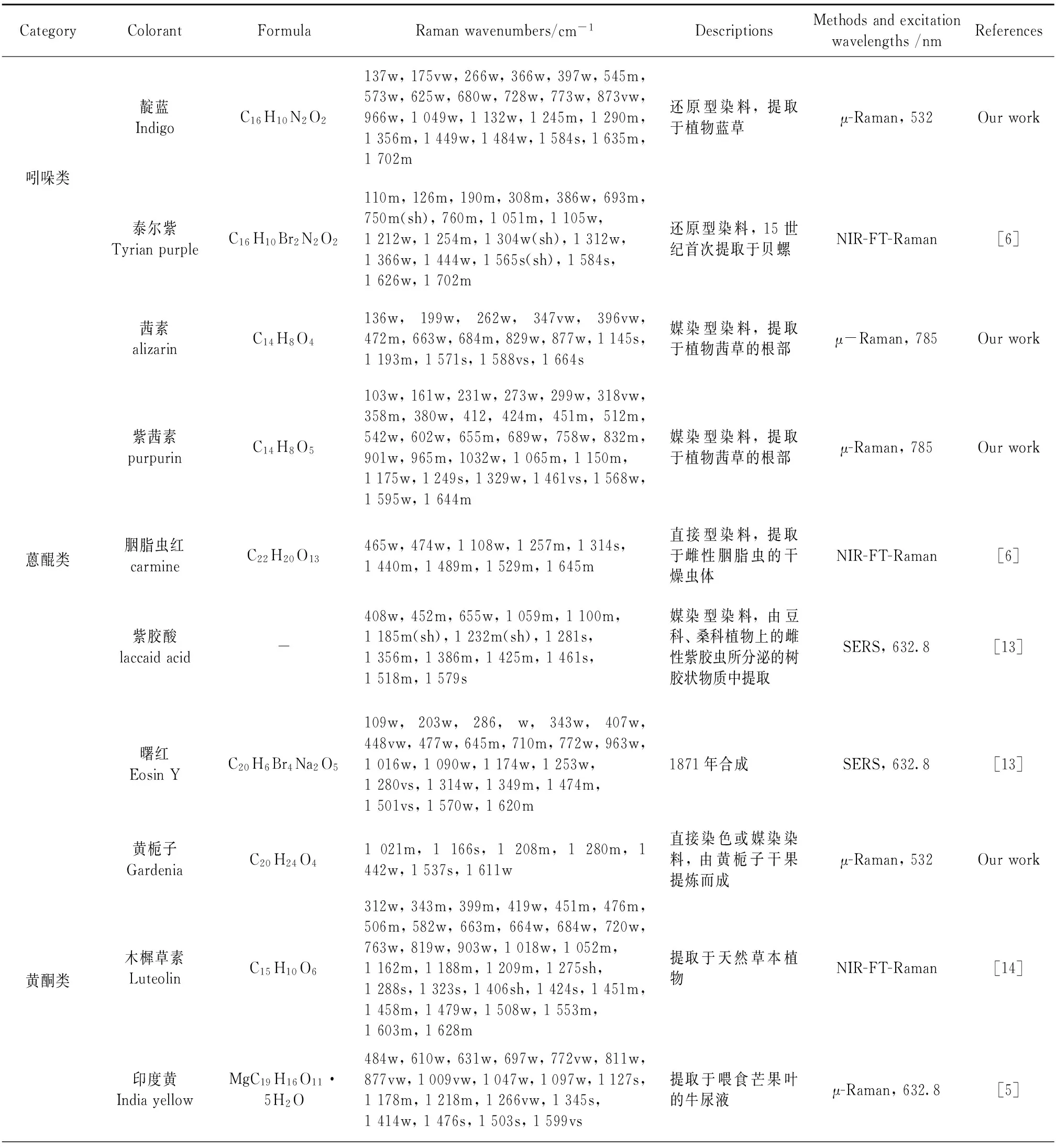
Table 1 Characteristic Raman frequency and intensity of dyestuffs
续表1

双酮类姜黄素curcuminC21H20O6107s,154w,210s,272m,319w,379m,415w,461m,513w,573m,626w,678w,713w,764w,782w,809m,873w,962s,1031vw,1151m,1165m,1184s,1205w,1250m,1318w,1431w,1467vw,1496vw,1532vw,1602vs,1627s直接染色或媒染染料,提取于姜科、天南星科中的一些植物的根茎μ-Raman,785Ourwork类胡萝卜素类红花素SaffronC20H24O41020w,1166m,1210w,1283w,1537s,1613w直接型染料,草本植物红花中提取NIR-FT-Raman[6]二氢吡喃类苏木hematoxylinC16H12O5431w,706w,780w,899m,977w,1054vw,1153w,1270s,1326s,1390s(br),1447m,1560m,1657m,1702s,1760s媒染型染料,提取于苏木心材,μ-Raman,632.8Ourwork生物碱类小檗碱berberine[C20H18NO4]+537m,562w,620w,640w,660w,697w,713w,730w,753w,769w,836w,888m,912w,933w,951w,999w,1027w,1042w,1101vw,1119vw,1145vw,1206m,1236w,1277m,1342w,1366w,1397vs,1425m,1447m,1500s,1520vs,1570m,1624s直接染色或媒染染料,提取于黄连、黄檗等μ-Raman,785Ourwork三萜类藤黄GambogicC38H44O8/C29H36O61224w,1249m,1281w,1333w,1383w,1437m,1594s,1634m直接型染料,提取于树胶脂NIR-FT-Raman[6]偶氮类汉萨黄HansayellowC16H13ClN4O470m,85m(sh),95m,118m,124m,158m,177w,185w,212w,284w,353w,386w,394w,414w,617w,626w,655m,742m,761w,770w,785w,823w,849w,953m,1001m,1068w,1111w,1141s,1181w,1192w,1257m,1306s,1325m,1336m,1360w,1386m,1403w,1451w,1491s,1534w,1561w(sh),1568m,1605s,1619s,1672w1910年合成NIR-FT-Raman[6]萘酚类β萘酚β-naphtholC24H16Cl3N3O275w,99w,149m,247w,298w,347w,386w,431w,442w,454m,463m,528w,619m,681m,725w,731w,746w,813w,968w,989vs,1063w,1099w,1109w,1162m,1205w,1231s,1244w,1261w,1282m,1332w,1359s,1376m,1393m,1449w,1463w,1484m,1552m,1580s,1607w1939年合成NIR-FT-Raman[6]
vw: very weak; w: weak; m: medium; s: strong; vs: very strong; sh: shoulder; br: broad
在进行拉曼光谱分析时,常出现来自染料分子本身、载体材料(如丝线中的蛋白质)或杂质等产生的强荧光干扰,可根据被检测样品性质的不同,针对性地选择可见、紫外或近红外激光光源来消除干扰。例如,Asher等[15]采用244 nm紫外激光器进行激发,成功实现了若丹明染料干扰下低浓度芘的分析,而对于这类存在强荧光干扰的染料来说,很难利用可见光激发来进行拉曼光谱鉴别。本工作系统研究了532,633和785 nm三种波长激光器对古织物常用天然植物染料标准色素紫茜素(purpurin)、靛蓝(indigo)等的拉曼光谱及其荧光特性,发现在不同激发光波长下染料具有不同的荧光现象。以紫茜素为例,染料分子的多个发色团羰基或π电子体系内的非键合电子基团在486 nm左右产生吸收峰(图1),以532或633 nm激发会出现十分强烈的荧光背景(分别见图2a和图2b),而利用785 nm近红外光激发避免了荧光干扰(图2c)。但需要指出的是,使用近红外光激发时,要避免热效应
对染料样品可能带来的伤害[16]; 使用紫外光激发时,因光子能量高,可能会导致样品的降解而带来错误的信息[9]。
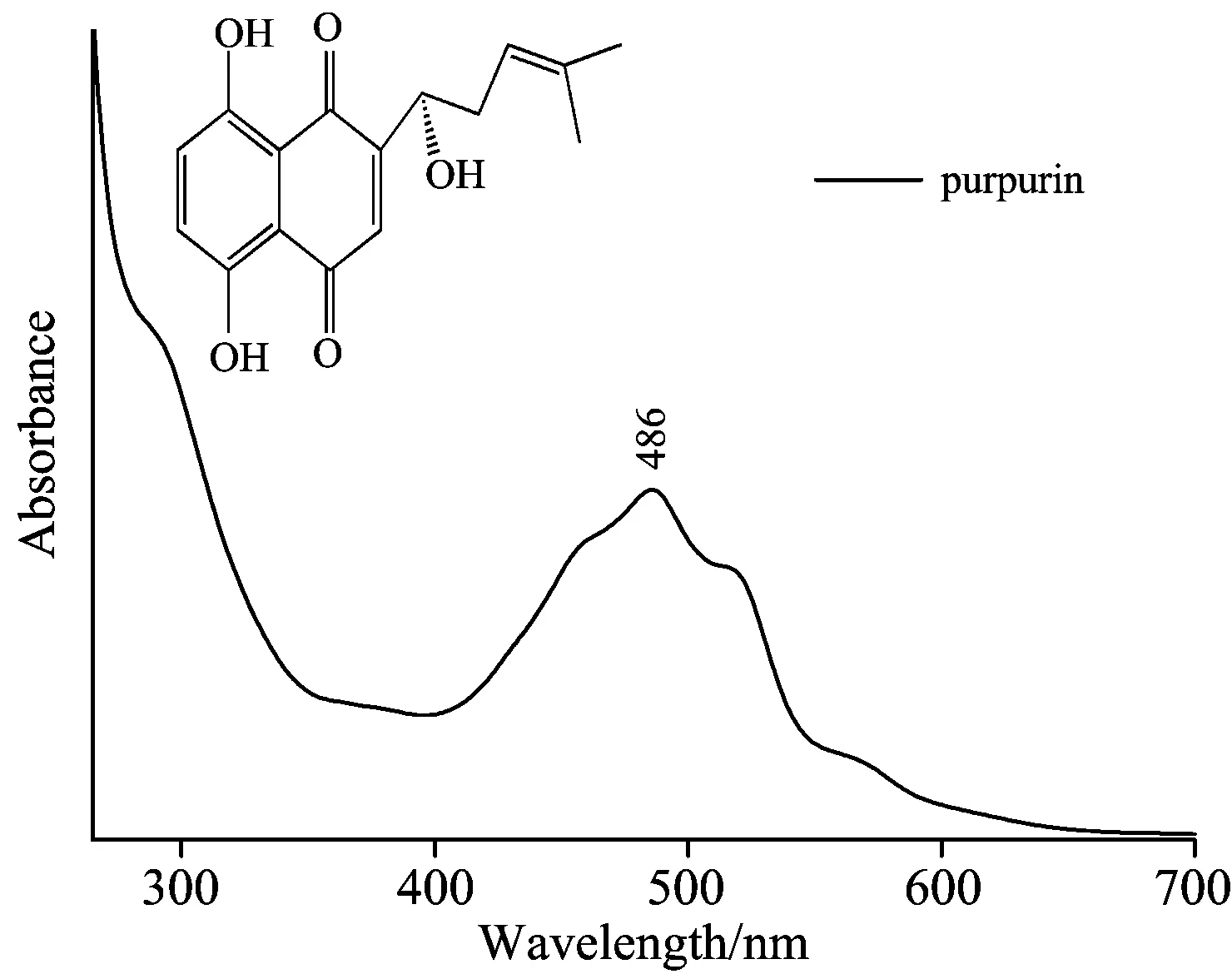
Fig.1 UV-Vis spectra of purpurin in ethanol
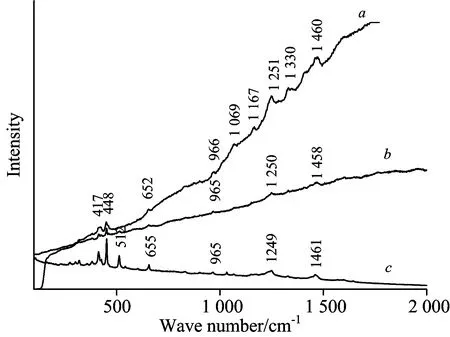
Fig.2 Raman spectra of purpurin with different laser excitationa: λ0=532 nm; b: λ0=633 nm; c: λ0=785 nm
2 近红外傅里叶变换拉曼光谱法(NIR-FT-Raman)
近红外傅里叶变换拉曼光谱法是上个世纪八、九十年代发展起来的新技术。以1 064 nm近红外激光照射样品、采用傅立叶变换技术收集信号,提高了测试的信噪比,解决了MRS分析染料时存在的光化学分解、热效应、荧光效应等问题[17]。因此,NIR-FT-Raman在染料样品的非破坏性分析方面显示出了巨大的生命力。
Schulte等[18]通过NIR-FT-Raman分析了用于20世纪艺术作品的有机染料,能快速地鉴定出混杂在干性油和丙烯酸涂料中的汉萨黄、喹吖啶酮紫等染料。Andreev等[19]检测出2世纪—9世纪纺织品上的蓝色染色材料有靛蓝、玛雅蓝和普鲁士蓝(图3),且各染料使用的年代带有明显的时代烙印: 靛蓝在古埃及就已作为一种还原染料广泛使用; 玛雅蓝在公元前1世纪开始使用; 普鲁士蓝(KFe[Fe(CN)6])出现的年代最晚,合成于1704年。可见,通过染料鉴定可以判断文物及艺术品的制作时代。Céline等[20]在研究18世纪法国一艺术藏品织梭(图4a)的染色成分时,利用NIR-FT-Raman技术减少了染料本身和其他添加材料的荧光干扰。因而尽管该藏品制作工艺复杂(经过了打底、绘制、装饰和髹漆等多道工序,其剖面结构见图4b),使用材料种类多样,但最终鉴定出了茜素、胭脂红等染料的存在,同时发现了MRS难以检测出的胶结材料亚麻籽油(图5)。
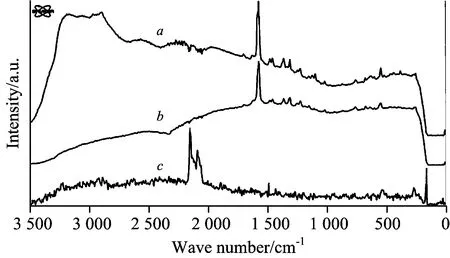
Fig.3 Raman spectra of blue pigments
a: indigo C16H10N2O2;b: Maya blue (Attapulit (Mg,Al)2[OH|Si4O10]·2H2O)+indigo) ;c: Prussian blue, KFe[Fe(CN)6]

Fig.4 Photography of the artifacts

Fig.5 FT-Raman spectra
a: the weaving shuttle pictorial layer;b: alinseed oil reference film;c: a rabbit skin glue reference film;d: a gum Arabic
3 表面增强拉曼光谱法(SERS)
1974年Fleischmann发现了表面增强拉曼效应[21],在物理化学界引起了极大的轰动。当痕量分子吸附于金、银、铜等金属胶粒或粗糙金属的表面,样品拉曼信号强度会增加104~107倍,这种效应称为表面增强拉曼散射效应。表面增强拉曼光谱有效地弥补了拉曼信号灵敏度低的弱点,克服了MRS分析染料时的强荧光干扰。
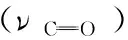
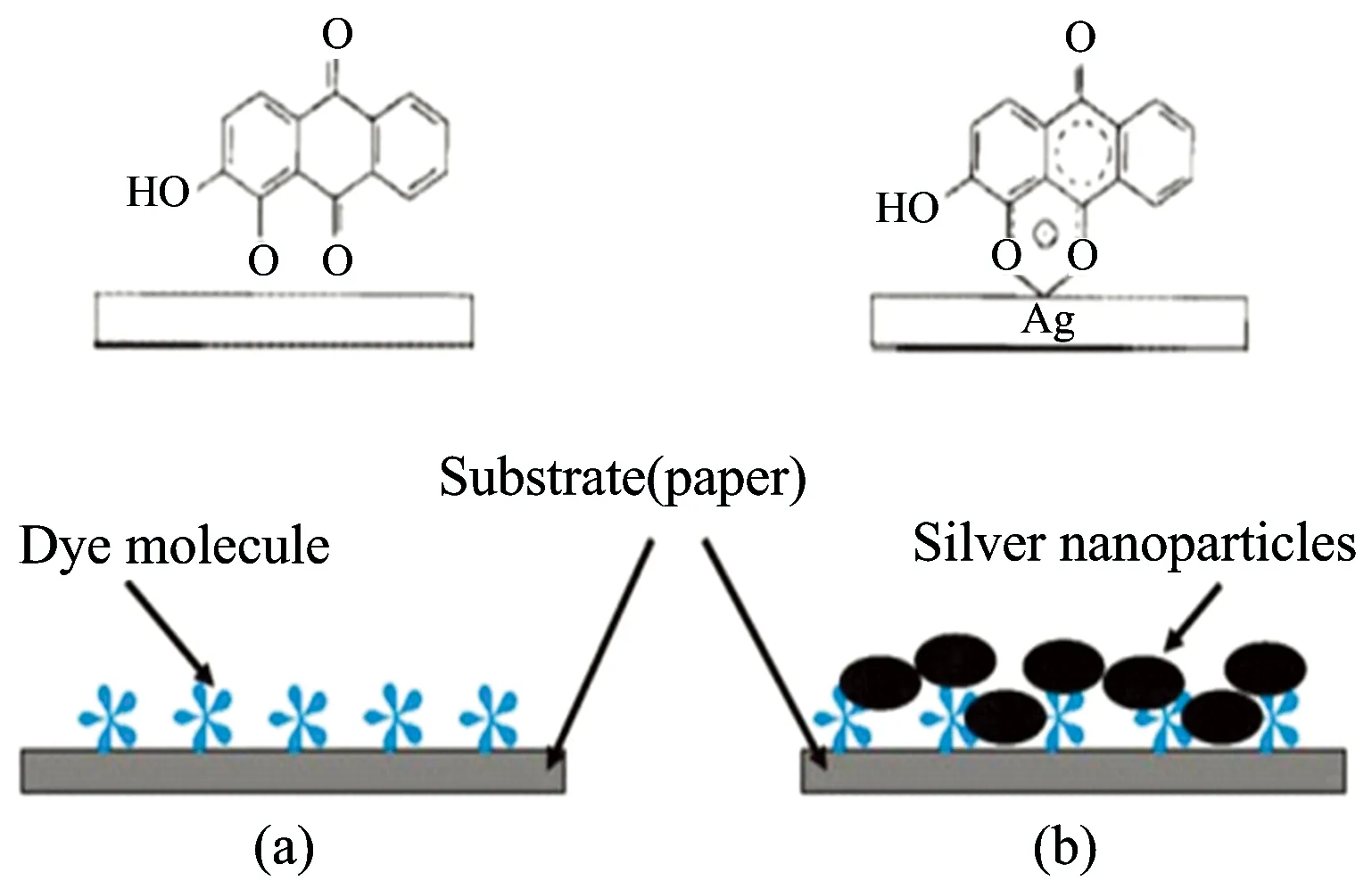
Fig.6 Schematic illustration of a SERS procedure for direct dye analysis on a painting fragment
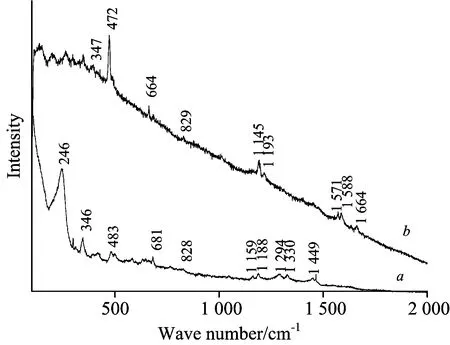
Fig.7 (a) SERS spectra of alizarin and
然而,SERS方法也有一定的局限性。由于该效应固有的SERS非弹性散射背底的升高及银表面对激光的强烈散射等因素,在低波数区易产生干扰。同时,制备具有增强能力强、稳定性高、重复性好、使用方便的SERS活性基底还时常面临着许多技术难题。
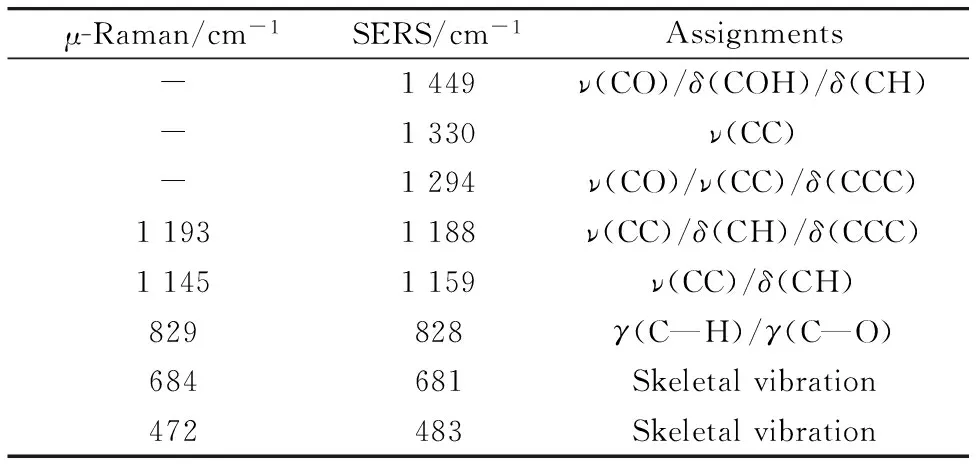
Table 2 Main vibrations of μ-Raman and SERS of alizarin
ν: stretching;δ: in-plane bending;γ: out-of-plane stretching
4 共振拉曼光谱法(RRS)
实验发现当采用紫外、可见以至红外激发光源激发时,激光频率与待测分子的某个电子吸收峰接近或重合时,则样品的拉曼信号可共振增强104~106倍[29],此特性有助于检测少量至痕量的具有共振拉曼活性生色团的大分子多环芳香化合物。与MRS相比,共振拉曼光谱灵敏度高。结合表面增强技术,其灵敏度甚至可达到单分子检测[30]。
Rosi等[31]首次利用RRS技术无损鉴定出9世纪的圣经和16世纪法国奥弗涅地区的羊皮纸地图残片中的地衣紫(lichen purple),该染料是昂贵的泰尔紫的替代品。地衣紫的最大吸收波长(λmax)范围为500~600 nm[32],利用532 nm激光激发可显著增强样品信号。另一个RRS技术鉴定染料的例子是小檗碱的检测。小檗碱的λmax为342 nm(图8),Bell等[33-34]利用363.8 nm激光器产生的共振增强效应、结合差减转换法成功地消除了荧光干扰,鉴定出大英图书馆藏的中国古代《金刚经》上的黄色染料为小檗碱。
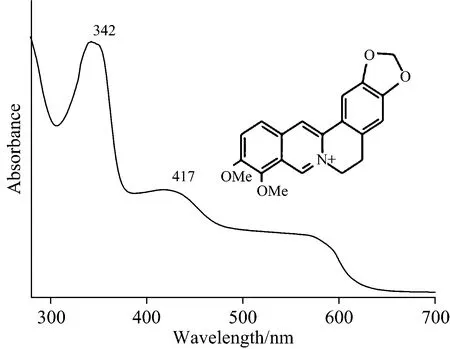
Fig.8 UV-Vis spectra of berberine in ethanol
RRS技术的主要缺点是要求所检测的物质是多环芳香类物质,分子必须具有共扼π电子体系。同时,针对不同的电子生色团, 要求使用不同的激发光源。因此,对分析仪器限制较大。但随着紫外、可见、红外和近红外激光光源的相继出现,各种高性能拉曼光谱仪器的大力发展, 将会使共振拉曼光谱技术逐步得到推广。
5 结 论
拉曼光谱作为一种快速、便捷的结构定性测试手段在文物和艺术品染料分析中具有独特的优势,应用前景广阔。激光技术的出现推动了拉曼技术的发展,MRS技术实现了样品的微区分析; NIR-FT-Raman技术克服了激光对样品的热分解和荧光等问题; SERS技术的出现大幅度提高了拉曼光谱的灵敏度、增强了拉曼信号,使其应用范围大大拓宽; RRS技术鉴定含有共扼π电子体系的生色团具有独特的优势。
目前,拉曼光谱技术出现以下发展趋势: (1)多种拉曼光谱技术相结合,以最大程度发挥各自的优势: 例如,将FT-Raman与SERS结合起来的SERS-FT-Raman技术[35],不仅可以完全避免红外区的荧光干扰,还可以避免可见光区强烈的SERS非弹性散射背底的干扰,可在低波数区获得更清晰的拉曼信号。(2)拉曼光谱技术与分离技术相结合,可同时分离并鉴别混合染料中的复杂组分: 各类拉曼光谱结构定性测试手段与色谱、毛细管电泳等分离技术联用,应运而生了TLC-Raman,CE-Raman,TCL-SERRS,TLC-FT-SERS和HPLC-SERS等联合技术[36-38]。(3)拉曼光谱技术与远距离传导技术相结合,实现远距离或大型文物及艺术品的实时、原位无损检测: 例如,利用光纤技术将SERS材料组装到光纤上所制成的高灵敏检测传感器[39-40],实现了低浓度(10-9mol·L-1)物质的分析。
[1] Degano I,Ribechini E,Modugno F,et al. Applied Spectroscopy Reviews,2009,44(5): 363.
[2] Liu Jian,Guo Danhua,Zhou Yang,et al. Journal of Archaeological Science,2011,38: 1763.
[3] Gulmini M,Idone A,Diana E,et al. Dyes and Pigments,2013,98: 136.
[4] Vandenabeele P,Moens L,Edwards H,et al. Journal of Raman Spectroscopy,2000,31: 509.
[5] Bell I M,Clark R J H,Gibbs P J,et al. Spectrochimica Acta A,1997,53: 2159.
[6] Burgio L,Clark R J H. Spectrochimica Acta A,2001,57: 1491.
[7] Chen Kui,Marco Leona,Tuan VoDinh. Sensor Review,2007,27(2): 109.
[8] Efremov E V,Ariese F,Gooijer C. Analytica Chimica Acta, 2008, 606: 119.
[9] Smith G G D,Clark R J H. Journal of Archaeological Science,2004,31: 1137.
[10] Lenain B P. Analusis,2000,28: 11.
[11] Clark R J H,Gibbs P J. Journal of Archaeological Science,1998,25: 621.
[12] Burgio L,Clark R J H. Journal of Raman Spectroscopy,2000,31: 395.
[13] Whitney A,Duyne R,Casadio F. Journal of Raman Spectroscopy,2006,37: 993.
[14] Leona M,Stenger J,Ferloni E. Journal of Raman Spectroscopy,2006,37: 981.
[15] Asher S A,Munro C H,Chi Z. Laser Focus World,1997: 99.
[16] Harvey S D,Peters T J,Wright B W,et al. Applied Spectroscopy,2003 (57): 580.
[17] Paris C,Coupry C. Journal of Raman Spectroscopy,2005,36: 77.
[18] Schulte F,Brzezinka K,Lutzenberger K,et al. Journal of Raman Spectroscopy,2008,39: 1455.
[19] Andreev G N,Schulz H,Fuchs R,et al. Journal of Analytical Chemistry,2001,371: 1009.
[20] Daher C,Drieu L,Bellot-Gurlet L,et al. Journal of Raman Spectroscopy,2014,45: 1207.
[21] Fleischmann M,Hendra P J,Mcquillan A J. Chemical Physics Letters,1974,26(2): 163.
[23] Whitney A V,Duyne R,Casadio F J. Journal of Raman Spectroscopy,2006,37: 993.
[24] Chen Kui,Vo-Dinh Kim-Chi,Yan Fei,et al. Analytica Chimica Acta,2006,569: 234.
[25] Chen Kui,Leona M,Vo-Dinh Kim-Chi,et al. Journal of Raman Spectroscopy,2006,37: 520.
[26] Leona M,Lombardi J R. Journal of Raman Spectroscopy,2007,38: 853.
[27] Doherty B,Brunetti B G,Sgamellotti A,et al. Journal of Raman Spectroscopy,2011,42: 1932.
[29] Robert B. Photosynthesis Research,2009,101: 147.
[30] Shadi I T,Chowdhry B Z,Snowden M J,et al. Journal of Raman Spectroscopy,2004,35: 800.
[31] Rosi F,Clementi C,Paolantoni M,et al. Journal of Raman Spectroscopy,2013,44: 1451.
[32] Clementi C, Miliani C, Romani A,et al. Spectrochim. Acta Part A,2006,64: 906.
[33] Bell S,Bourguignon E,Grady A,et al. Spectroscopy Europe,2002,14(6): 17.
[34] Bell S,Edwards H,Chalmers J,et al. Royal Society for Chemistry, Cambridge,2005,292.
[35] Zaffino C,Bruni S,Guglielmi V. Journal of Raman Spectroscopy,2014,45: 211.
[36] GONG Yan,LU Yong-kai,LIN Su-jun,et al(龚,卢永凯,林素君,等). Chemistry(化学通报),2010,(8): 689.
[37] Chen Jing,Abell J,Huang Yaowen. Lab on a Chip,2012,12: 3096.
[39] XU Wei-qing,XU Shu-ping,HU Bing,et al(徐蔚青,徐抒平,胡 冰,等). Chemical Journal of Chinese Universities(高等学校化学学报),2004,25(1) : 144.
[40] Stokes D L,VoDinh T. Sensors and Actuators B: Chemical,2000,69 (1): 28.
*Corresponding author
Research Progress of Raman Spectroscopy on Dyestuff Identification of Ancient Relics and Artifacts
HE Qiu-ju1, 2,WANG Li-qin1*
1. College of Cultural Heritage,Key Laboratory of Culture Heritage Research and Conservation (Northwest University),Ministry of Education,Xi’an 710069,China 2. Centre for the Conservation and Restoration of Cultural Heritage,Capital Museum,Beijing 100045,China
As the birthplace of Silk Road, China has a long dyeing history. The valuable information about the production time,the source of dyeing material,dyeing process and preservation status were existed in organic dyestuff deriving from cultural relics and artifacts. However,because of the low contents,complex compositions and easily degraded of dyestuff,it is always a challenging task to identify the dyestuff in relics analyzing field. As a finger-print spectrum,Raman spectroscopy owns unique superiorities in dyestuff identification. Thus,the principle,characteristic,limitation,progress and development direction of micro-Raman spectroscopy (MRS/μ-Raman),near infrared reflection and Fourier transform Raman spectroscopy (NIR-FT-Raman), surface-enhanced Raman spectroscopy (SERS) and resonance raman spectroscopy (RRS) have been introduced in this paper. Furthermore, the features of Raman spectra of gardenia,curcumin and other natural dyestuffs were classified by MRS technology, and then the fluorescence phenomena of purpurin excitated with different wavelength laser was compared and analyzed. At last, gray green silver colloidal particles were made as the base,then the colorant of madder was identified combining with thin layer chromatography (TLC) separation technology and SERS,the result showed that the surface enhancement effect of silver colloidal particles could significantly reduce fluorescence background of the Raman spectra. It is pointed out that Raman spectroscopy is a rapid and convenient molecular structure qualitative methodology,which has broad application prospect in dyestuff analysis of cultural relics and artifacts. We propose that the combination of multi-Raman spectroscopy, separation technology and long distance transmission technology are the development trends of Raman spectroscopy.
Raman spectroscopy; Relics; Artifact; Dyestuff; Identification
Jan. 3, 2015; accepted Apr. 25, 2015)
2015-01-03,
2015-04-25
国家自然科学基金项目(21175104)资助
何秋菊,女,1982年生,西北大学文化遗产学院博士研究生 e-mail: keke8862@163.com *通讯联系人 e-mail: wangliqin@nwn.edu.cn
O657.3; K854.2
A
10.3964/j.issn.1000-0593(2016)02-0401-07
