糖尿病肾病患者高密度脂蛋白抗炎能力的分析
2016-06-15郑健宇
郑健宇
糖尿病肾病患者高密度脂蛋白抗炎能力的分析
郑健宇
目的 探讨糖尿病肾病患者相对于正常人高密度脂蛋白抗炎能力是否降低。方法 将正常人和糖尿病肾病高密度脂蛋白分别处理THP-1细胞,通过ELISA检测TNF-α、IL-6的含量,Western blot检测NF-KB的活化。结果 在LPS刺激下,糖尿病肾病HDL相比于正常人HDL抑制THP-1细胞释放TNF-α、IL-6和NF-KB活化的能力显著下降。结论 糖尿病肾病相对于正常人高密度脂蛋白抗炎能力显著下降,部分解释糖尿病肾病动脉粥样硬化风险升高。
高密度脂蛋白;炎症因子;慢性肾脏病;动脉粥样硬化
肾脏对维持机体正常运转、从血液中过滤代谢产物及排出水分发挥着重要的功能。慢性肾脏疾病家族史、糖尿病、高血压的患者更是慢性肾脏疾病的高危人群。近来的研究表明,慢性肾脏疾病增加了心血管疾病的风险[1]。大部分慢性肾脏病患者在疾病发展的不同阶段都有罹患各种心脑血管疾病的可能。欧洲血脂异常管理指南明确提出中重度CKD患者具有极高的心血管总体风险,需要针对所有危险因素进行积极的干预治疗[2]。高密度脂蛋白(HDL)是一种有益的脂蛋白,具有抗炎、抗氧化、抗动脉粥样硬化、降低血糖等一系列的机体保护作用。HDL能够抑制ox-LDL诱导的单核细胞与内皮细胞、平滑肌细胞的相互作用以及单核细胞与内皮细胞的粘附[3]。研究认为,正常HDL能够抑制细胞因子诱导的VCAM-1、ICAM-1和E-selectin的表达以及炎症因子TNF-α,IL-1β的释放[4-5]。但是在慢性肾脏病患者中HDL的抗炎功能是否发生改变还未有相关研究。糖尿病肾病是一类由糖尿病导致的慢性肾脏疾病命,发病率较高。故本研究选用糖尿病肾病患者作为慢性肾病的研究对象,现将研究结果报道如下。
1 资料与方法
1.1 一般资料 2013年8月~2014年8月在郑州大学第二附属医院住院的慢性肾脏病患者18例(CKD组),以目前早期慢性肾脏病诊断,以持续出现尿微量蛋白,尿蛋白/肌酐比≥30mg/g并≤300mg/g且出现糖尿病视网膜病变作为标准;正常对照12人(对照组),行75g无水葡萄糖耐量及糖化血红蛋白检查排除糖尿病,身体健康无肾病等其它病史。排除伴有高血压、慢性肝病、其他原因导致的肾病、吸烟、家族性高胆固醇血症、早发冠心病家族史者。慢性肾脏病患者相对于正常人尿素氮(BUN)、肌酸(Creatine)、总胆固醇(TC)、总甘油三酯(TG)、低密度脂蛋白(LDL)含量均明显升高,肾小球滤过率(GFR)和高密度脂蛋白(HDL)含量明显降低,差异均有统计学意义(P<0.05)。见表1。
1.2 HDL提取 将正常人血浆加入KBr,调整密度至1.3g/mL,在4度超速离心250000g离心150min,从上部到试管底部依次将血浆分层:橘红色的VLDL和LDL,淡黄色的HDL(淡黄色)和无脂血浆。分别用长针头吸取出LDL,HDL放入透析袋然后用0.01M PBS避光透析48h。培养基中TNF-α和IL-1β含量使用达科为酶联免疫试剂盒检测。通过蛋白印迹(western blot)检测NF-kappa B中P65的磷酸化和GAPDH的含量,灰度分析采用Image J进行分析,以GAPDH灰度值进行校正。
1.3 统计学方法 采用SPSS统计软件20.0进行分析,计量资料采用“x±s”表示,2组均数间比较采用双尾Student’s t检验,P<0.05为差异有统计学意义,P<0.001表示差异具有极显著统计学意义。图中,*表示P<0.05;**表示P<0.01;***表示P<0.001。
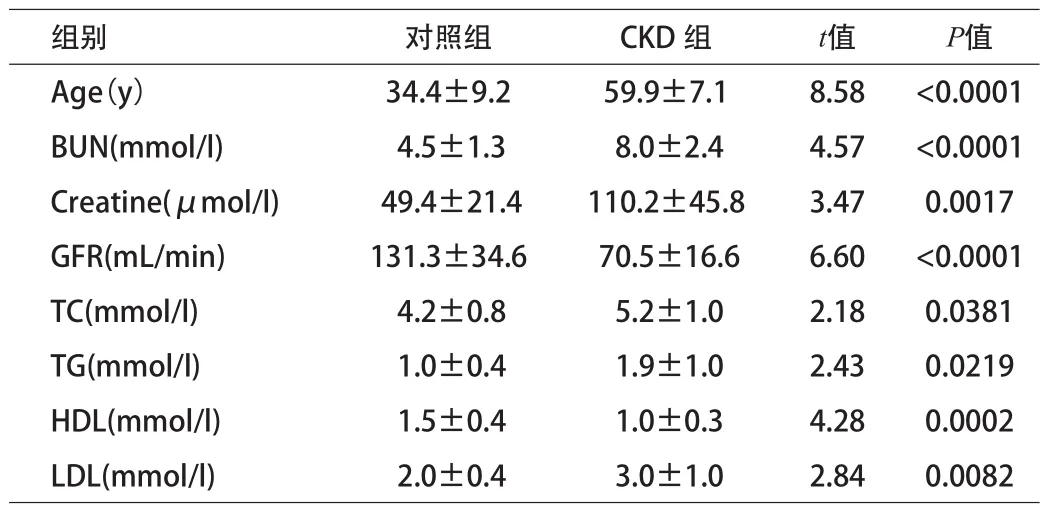
表1 2组一般临床资料比较(x±s)
2 结果
2.1 慢性肾脏病HDL对内皮细胞炎症因子的表达 分别用正常人和慢性肾脏病患者HDL预处理THP-1细胞2.5h,然后LPS预处理2.5h,使用ELISA试剂盒检测培养基中TNF-α和IL-1β的含量。结果发现慢性肾脏病患者相对于正常人HDL抑制LPS介导的TNF-α和IL-1β的释放能力显著降低。见图1。
2.2 HDL通过NF-kappa B调节验证因子的表达 由于NF-kappa B在调节细胞因子(如IL-1、IL-6、TNF-α)、黏附分子(如ICAM-1、VCAM-1)的表达中发挥重要作用,因此检测了2组HDL处理THP-1后NF-kappa B中P65亚基的磷酸化水平,发现慢性肾脏病HDL抑制P65磷酸化的能力降低。见图2。

图1 THP-1分别用LPS刺激,检测加入CKD-HDL和N-HDL后4组中TNF-α和IL-1β的含量
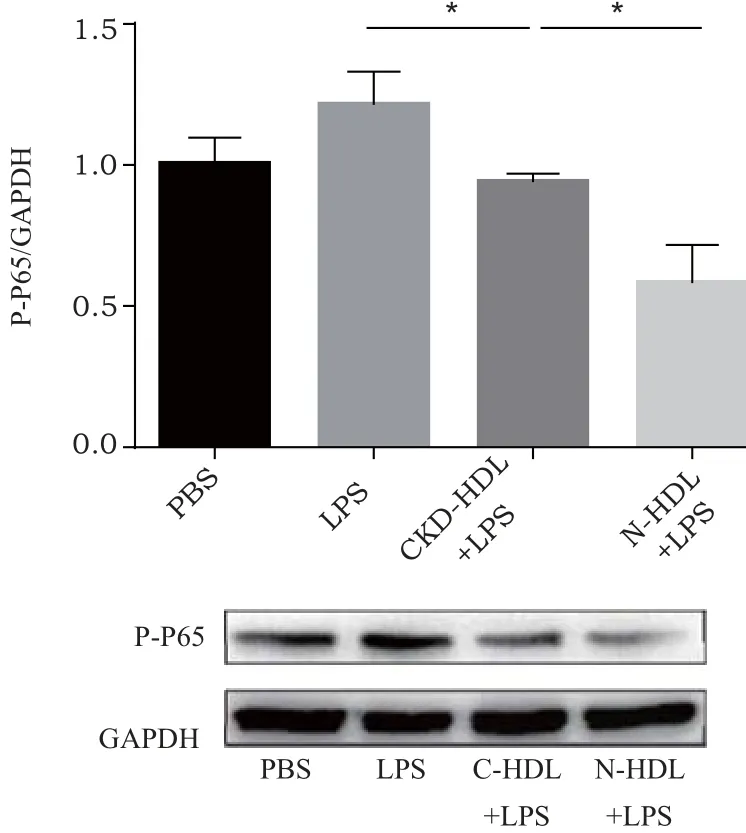
图2 采用western blot检测不同HDL处理后THP-1中NF-kappa B P65亚基的磷酸化水平
3 讨论
在慢性肾脏疾病中常伴有脂质代谢异常,表现为载脂蛋白和血脂水平改变。实验和临床研究提示,慢性肾脏病发展和血脂紊乱有一定关系,慢性肾功能不全患者早期表现为血TG水平升高,LDL浓度正常,而胆固醇浓度通常正常,甚至降低[6]。HDL水平降低。本实验验证相比于正常人、慢性肾脏病患者LDL水平升高,HDL水平降低。
血管炎症反应主要是由于促炎因子与抗炎因子之间的不平衡所导致的[7]。HDL具有动脉保护性效应,HDL的抗炎功能是以多种方式发挥的,在内皮细胞中,正常人的HDL能够抑制细胞粘附分子包括ICAM-1、VCAM-1以及E-selectin,抑制IL-8和MCP-1以及诱导抗炎性的TGF-β。白细胞与内皮细胞的粘附和白细胞与平滑肌细胞之间的相互作用在动脉粥样硬化性斑块的发生发展中起着非常重要的作用。白细胞与内皮细胞的相互作用是由定位在这些细胞表面的粘附分子包括血管细胞粘附分子(VCAM-1)、细胞间粘附分子(ICAM-1)和E-选择素(E-selectin)介导下发生的。肿瘤坏死因子α(TNF-α)和白介素1β(IL-1β)作为炎症反应中的重要介质,它主要是由单核巨噬细胞受到各种因素的刺激被激活后合成和分泌的,可以促进炎性介质的释放,巨噬细胞的浸润,以及激活巨噬细胞,推动斑块的形成以及不稳定性的发展。TNF-α和IL-1β还可激活内皮细胞上的黏附分子(VCAM-1、ICAM-1),使其表达活性增加[8]。这些粘附分子吸引单核白细胞吸附在内皮组织上并且进一步往内膜方向迁移,使炎症反应进而在血管壁上启动[9]。TNF-α和
IL-1β除可作用于巨噬细胞并将其激活外,还促进平滑肌细胞增生、游走,并且能作用于血管内皮细胞,使内皮细胞活化、受损,进一步导致血管受损和血栓形成[10-11]。本实验发现相比于正常
HDL,慢性肾脏病HDL抑制LPS导致的TNF-α、IL-1β能力降低,因此结果可以部分解释慢性肾脏病动脉粥样硬化疾病发生风险升高。
NF-kappa B是一种能调节多种炎性和免疫基因表达的重要转录因子。正常情况下,NF-kappa B与其抑制蛋白结合形成无活性的三聚体复合物,存在于胞浆内。在促炎症细胞因子的作用下,NF-kappa B P65亚基磷酸化并移位至细胞核,其核定位序列与靶基因的启动子或增强子发生特异性结合,启动转录表达。同时由于NF-kappa B对动脉粥样硬化中多种炎性介质(TNF-α、IL-1β)的表达起着关键性的调控作用,所以动脉粥样硬化中NF-kappa B的含量和活性升高可增强多种炎症因子的转录和生成增多,引起持续的炎症反应,通过对靶基因的作用,NF-kappa B能促进单核细胞的粘附迁移、泡沫细胞的形成及积聚、平滑肌细胞的从中膜到内膜的迁移增殖。这些作用促进粥样斑块的形成和发展,使内膜增厚、管腔狭窄,加重病变程度[12]。文献表明正常状态下HDL与apoA-I可以通过作用于TLR4受体阻断NF-kappa B的活化[13],抑制多种炎症因子的表达,减轻炎症反应和级联瀑布效应。我们通过细胞免疫印迹发现慢性肾脏病HDL处理后THP-1中NF-kappa B P65亚基的磷酸化水平相比于正常HDL明显增高。因此,对于慢性肾脏病患者,其HDL抑制NF-kappa B P65亚基磷酸化能力降低,炎性介质(TNF-α、IL-1β)的表达增加,进一步使大量炎性细胞积聚浸润于炎症部位,导致持续或放大的炎症反应。这些炎症反应促进粥样斑块的形成和发展,使内膜增厚、管腔狭窄,加重病变程度。
[1] Afkarian M,Katz R,Bansal N,et al.Diabetes,Kidney Disease,and Cardiovascular Outcomes in the Jackson Heart Study[J].Clin J Am Soc Nephrol,2016,6:23.
[2] 王锦溪,李虹伟,赵树梅.他汀在慢性肾功能不全患者中的应用[J].心血管病学进展,2013,34(1):66-68.
[3] Riwanto M,Landmesser U.High density lipoproteins and endothelial functions:mechanistic insights and alterations in cardiovascular disease[J]. Journal of lipid research,2013,54(12):3227-3243.
[4] Seetharam D,Mineo C,Gormley AK,et al.High-density lipoprotein promotes endothelial cell migration and reendothelialization via scavengerreceptor-B type I[J].Circ Res,2006,98(1):63-72.
[5] Liu D,Ji L,Zhang D,et al.Nonenzymatic glycation of high-density lipoprotein impairs its anti-inflammatory effects in innate immunity[J]. Diabetes Metab Res Rev,2012,28(2):186-195.
[6] Shroff R,Speer T,Colin S,et al.HDL in children with CKD promotes endothelial dysfunction and an abnormal vascular phenotype[J].Journal of the American Society of Nephrology,2014,25(11):2658-2568.
[7] 李瑞雪,张玲.慢性肾脏疾病脂代谢紊乱发生机制研究进展[J].重庆医学,2008,37(15):1742-1744.
[8] Hopkins PN.Molecularbiology of atherosclerosis[J].Physiol Rev,2013,93(3):1317-1542.
[9] Libby P.Inflammation in atherosclerosis[J].Arteriosclerosis Thrombosis & Vascular Biology,2000,48(2):265-266.
[10] Buckley ML,Ramji DP.The influence of dysfunctional signaling and lipid homeostasis in mediating the inflammatory responses during atherosclerosis[J].Biochim Biophys Acta,2015,129(7):1498-1510.
[11] Pateras I,Giaginis C,Tsigris C,et al.Theocharis S (2014) NF-kappaB signaling at the crossroads of inflammation and atherogenesis:searching for new therapeutic links[J].Expert Opin Ther Targets,2014,18(9):1089-1101.
[12] Hansson GK,Robertson AK,Soderberg-Naucler C.Inflammation and atherosclerosis,Annu[J].Annual Review of Pathology Mechanisms of Disease,2006,1(1):297-329.
[13] Cheng AM,Handa P,Tateya S,et al.Apolipoprotein A-I Attenuates Palmitate-Mediated NF-κB Activation by Reducing Toll-Like Receptor-4 Recruitment into Lipid Rafts[J].PLoS One,2012,7(3):e33917.
Objective To investigate whether the anti-inflammatory effects of HDL is impaired in chronic kidney disease. Methods THP-1 cells were treated with N-HDL (normal),CKD-HDL (chronic kidney disease).TNF-α,IL-1β content was detected with ELISA kit and NF-kappa B phosphorylation were analyzed by western blot.Results CKD-HDL was less effective than N-HDL in TNF-αand IL-6 release inhibition (P<0.05). NF-kappa B phosphorylation were reduced in CKD-HDL in comparison with N-HDL.Conclusion We found that HDL from chronic kidney disease has a lower anti-inflammatory effects which partially explains why CKD patients have a higher risk of cardiovascular disease.
High density lipoprotein; Inflammatory factors; Chronic kidney disease; Atherosclerosis
10.3969/j.issn.1009-4393.2016.21.001
河南 475000 河南省开封市中心医院输血科 (郑健宇)
