低温胁迫对枇杷幼果抗氧化酶系统和组织结构的影响
2016-06-15龚荣高廖明安汪志辉梁国鲁
杨 伟,龚荣高,,廖明安,汪志辉,梁国鲁
(1 四川农业大学 园艺学院,四川 雅安625014;2 成都龙泉驿区农村发展局,四川 成都610100;3 西南大学 园艺园林学院,重庆400700)
低温胁迫对枇杷幼果抗氧化酶系统和组织结构的影响
杨伟1,2,龚荣高1,2,3,廖明安1,汪志辉1,梁国鲁3
(1 四川农业大学 园艺学院,四川 雅安625014;2 成都龙泉驿区农村发展局,四川 成都610100;3 西南大学 园艺园林学院,重庆400700)
[摘要]【目的】 研究低温胁迫下枇杷幼果果肉和种子的生理指标及组织结构的变化规律,探索幼果低温伤害的机制。【方法】 以“大五星”枇杷最易受冻的幼果为试材,经不同低温胁迫(12,6,3,0,-3,-6 ℃)处理不同时间(12,24,36,48 h),测定幼果果肉和种子的丙二醛(MDA)含量、相对电导率(REC)、抗氧化酶活性,并研究低温胁迫对其组织结构和低温半致死温度(LT50)的影响。【结果】 枇杷幼果果肉、种子的LT50分别是-6.1和-4.9 ℃。果肉、种子分别在0和3 ℃以上的轻度低温胁迫下,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性上升,MDA含量和REC均较低;但果肉、种子分别在-3和0 ℃以下重度低温胁迫下,保护酶活性逐渐降低,REC和MDA含量上升。0 ℃时幼果外果皮细胞出现明显破裂和自溶现象,-3 ℃时中果皮(果肉)细胞破裂,果实受低温伤害严重。而种子在3 ℃时种皮细胞出现破裂,0 ℃时种皮与种胚开始分离,种胚细胞自溶明显,低温伤害较重。【结论】 轻度低温胁迫时,过氧化酶系统协同作用可有效清除枇杷幼果果肉和种子细胞内的活性氧;重度胁迫时,酶失去保护功能;枇杷幼果中种子耐低温能力最差,3 ℃时即出现低温伤害,其次为外果皮,而果肉耐低温能力则最强。
[关键词]低温胁迫;枇杷幼果;抗氧化酶;组织结构
枇杷为蔷薇科(Rosaceae)枇杷属(EriobotryajaponicaLindl.)植物,是原产于我国南方的亚热带常绿果树,果实春末夏初成熟,是调节市场淡季的重要水果,已成为我国枇杷产区的重要支柱产业。但枇杷于秋冬季开花坐果时正值一年中气温最低的时期,低温伤害严重影响四川枇杷产业的健康发展[1]。相对枇杷叶片而言,幼果更易受冻,常表现为种子受冻致死[2],特别是直径为1 cm左右的幼果更易受低温伤害[1]。郑国华等[3]研究发现,“解放钟”枇杷幼果在0 ℃以下的低温常有冻害发生,在-3 ℃时严重受冻,果肉的原生质膜和细胞器均破裂,结构受损。温度降到0 ℃时,“早钟6号”枇杷幼果果肉的叶绿体和线粒体等细胞器结构遭到破坏[4]。低温胁迫常引起植物膜脂过氧化,丙二醛(MDA)含量增加,引起植物低温伤害[5-6]。黄志明等[7]发现,施用水杨酸(SA)增强枇杷幼果抗寒力的原因是提高了幼果的抗氧化性。抗氧化酶系统是植物体内主要的活性氧清除剂,能有效降低膜脂过氧化,它主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)[5,8]。前人在枇杷叶片上的研究表明,抗氧化酶活性在低温轻度胁迫时上升,但随着胁迫时间的延长和温度的降低,酶活性受到严重抑制,MDA含量大幅增加[9]。吴锦程等[10]认为,外源NO是通过提高枇杷果肉的SOD、CAT和POD活性来降低膜脂过氧化程度的。当前,针对枇杷抗寒性的研究多集中在叶片和果肉上[1-3,7,9-10],尚未见有关枇杷幼果果肉和种子半致死温度、低温胁迫下过氧化酶系统和组织结构变化方面的研究报道。然而在实际观察中发现,枇杷幼果受低温伤害表现为种子最先受冻褐变,进而引起幼果受冻致死[2]。为此,本试验系统研究了枇杷幼果果肉和种子在低温胁迫下主要生理生化指标及组织结构的变化规律,旨在探索幼果低温伤害的机理,为枇杷引种、生态区划和优质高产栽培提供相关的理论和实践依据。
1材料与方法
1.1试验材料
在四川省成都市龙泉驿区园艺场,选取10~15年生树势健壮、常规栽培管理并且生长相对一致的5株“大五星”枇杷(E.japonicaLindl.cv.Dawuxing)作为试验代表性植株,砧木为“解放钟”(E.japonicaLindl.cv.Jiefangzhong),盛花后开始挂牌,并在幼果易受冻害的花后75 d(75 days after full bloom,75 DAFB)(正常发育果直径1 cm左右),在树冠外围中部随机取带有大小相对一致的幼果果枝,将其培养在装有营养液的锥形瓶中,营养液采用改良霍格兰配方。
1.2试验方法
1.2.1枇杷幼果果肉与种子的相对电导率和低温半致死温度的测定将用于相对电导率(REC)测定的材料分别置于6,3,0,-3,-6 ℃条件下处理12,24,36,48 h(相对湿度为70%,光照时间9 h/d,光照强度3 000 lx)。0 ℃及0 ℃以上处理的材料置于人工气候箱中,-3和-6 ℃处理的材料置于改装冰柜(加装精确度为±0.2 ℃的数显温控和补光灯)中,以室温12 ℃为对照。每处理5个幼果果枝,重复3次。REC测定参照李合生等[11]的方法。
低温半致死温度(LT50)测定的材料分别放入8,6,4,2,0,-2,-4和-6 ℃条件下处理12 h(相对湿度约70%,光照时间为9 h/d,光照强度3 000 lx),0 ℃及0 ℃以上处理在人工气候箱中进行,0 ℃以下处理在改装的冰柜(加装精确度为±0.2 ℃的数显温控和补光灯)中进行,经室温恢复约12 h后测定REC。将REC与Logistic方程配合,计算果肉与种子的LT50[12],每处理5个幼果果枝,重复3次。
计算半致死温度(LT50)的Logistic方程回归模型为:Y=k/(1+ae-bt),其中Y代表相对电导率,t代表处理温度,k为细胞伤害率的饱和容量,a和b为方程参数。通过直线回归方法求得a和b值及相关系数r,曲线的拐点(X=ln(a/b)即为半致死温度[12]。本试验采用改进的数学分析方法(k=100)求得拐点温度。
1.2.2低温胁迫对枇杷幼果MDA含量和抗氧化酶活性的影响用于抗氧化酶活性测定的材料处理方法同REC测定。MDA含量测定采用硫代巴比妥酸法[11],SOD活性测定采用抑制光化还原法[1],CAT活性测定采用高锰酸钾滴定法[1],POD活性测定采用愈创木酚法[1]。
1.2.3低温胁迫对幼果组织结构的影响该项试验温度设置同REC测定,处理时间为12 h。每处理5个幼果果枝,重复3次。石蜡切片制作参照于晶等[13]的方法,其中,枇杷果肉切成长×宽=(2~3) mm×(1~2) mm块状,枇杷幼果种子大小为(2~3) mm×(1~2) mm椭圆状,直接取样,并进行纵向切片。
2结果与分析
2.1低温胁迫下枇杷幼果果肉和种子的相对电导率变化与半致死温度
图1和图2显示,枇杷幼果果肉和种子的REC随低温胁迫的加剧不断上升,特别是当温度降到-3 ℃以下时,REC快速上升,经低温处理后的REC均显著或极显著高于室温对照(CK)。-3 ℃低温胁迫下,枇杷果肉的REC除处理48 h外,其他3个处理与0 ℃以上低温处理差异不显著,而种子的REC却显著高于其他0 ℃以上低温处理,说明种子在-3 ℃低温胁迫下细胞膜受害比果肉严重。在-6 ℃低温胁迫下,果肉和种子的REC均极显著高于其他处理。

图 1低温胁迫下枇杷幼果果肉相对电导率(REC)的变化
Fig.1Changes of REC in pulp of young loquat fruit under low-temperature stress
图 2低温胁迫下枇杷幼果种子相对电导率(REC)的变化
Fig.2Changes of REC in seeds of young loquat fruit under low-temperature stress
从表1可知,枇杷幼果果肉和种子的LT50分别为-6.1和-4.9 ℃,表明枇杷幼果果肉的耐低温能力强于种子。

表 1 枇杷幼果果肉与种子在低温胁迫下的LT50及Logistic方程参数
2.2低温胁迫下枇杷幼果果肉和种子抗氧化指标的变化
由图3可见,枇杷幼果果肉的MDA含量在0 ℃及以上低温胁迫下变化较小,与对照差异不显著;而在-3 ℃及以下低温胁迫下,MDA含量快速上升,与对照差异显著或极显著,说明-3 ℃及以下低温胁迫使果肉膜脂过氧化程度加剧。枇杷幼果种子的MDA含量则随低温胁迫加剧而不断上升(图4),在3 ℃及以上低温胁迫下与对照差异不显著,但在0 ℃及以下低温胁迫下与对照差异显著或极显著,说明种子在0 ℃时细胞膜脂过氧化即开始加剧。
由图5和图6可见,枇杷幼果果肉和种子在低温胁迫下SOD活性变化趋势均表现为前期活性升高,但温度下降到一定程度后SOD活性则快速下降,而且低温胁迫时间越长,其活性下降越多;3和0 ℃胁迫下各时间处理SOD活性差异不显著,但均显著高于对照。在-3 ℃低温下处理12和24 h,果肉SOD活性与0 ℃下各时间处理的SOD活性均显著高于对照,而-3 ℃下处理36 h以上SOD活性却极显著低于0 ℃下各时间处理,但与对照差异不显著;枇杷幼果种子SOD活性在-3 ℃处理24 h以上极显著低于0 ℃下各时间处理,并显著低于对照。这说明从-3 ℃开始,种子SOD活性下降幅度总体上较果肉大。

图 3 低温胁迫下枇杷幼果果肉MDA含量的变化

图 5 低温胁迫下枇杷幼果果肉SOD活性的变化
从图7和图8可见,枇杷幼果果肉和种子CAT活性在0 ℃及以上低温胁迫时,总体呈上升趋势,而在0 ℃以下低温胁迫时,CAT活性快速下降,胁迫时间越长,活性下降越明显。

图 7 低温胁迫下枇杷幼果果肉CAT活性的变化
从图9和图10可见,枇杷幼果果肉和种子的POD活性均表现为低温胁迫较轻时上升,随着低温胁迫加重而下降,但在-3 ℃以下低温胁迫时,其活性又快速上升。枇杷幼果果肉的POD活性在0 ℃及以上低温胁迫下均上升,随后快速下降;而种子的POD活性在6 ℃及以下低温胁迫时便开始逐渐下降。
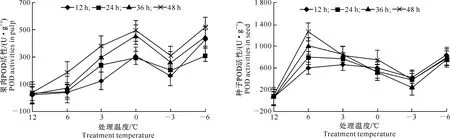
图 9低温胁迫下枇杷幼果果肉POD活性的变化
Fig.9Changes of POD activity in pulp of young loquat fruit under low-temperature stress
图 10低温胁迫下枇杷幼果种子POD活性的变化
Fig.10Changes of POD activity in seeds of young loquat fruit under low-temperature stress
2.3低温胁迫对枇杷幼果组织结构的影响
2.3.1枇杷幼果种皮和果肉枇杷幼果在12 ℃(对照)下果实外果皮平整,中果皮(果肉)细胞完整(图11-A);在6 ℃低温胁迫时,外果皮轻微凹陷,但果肉细胞仍完整(图11-B);在3 ℃低温胁迫时,外果皮细胞出现破裂现象,而果肉细胞完好(图11-C);在0 ℃低温胁迫时,果实外果皮细胞明显破裂,并出现自溶现象,而果肉细胞无明显变化(图11-D);在-3 ℃低温胁迫时,外果皮细胞破裂和自溶均严重,而且果肉细胞开始出现破裂,但其细胞自溶不明显(图11-E);在-6 ℃低温胁迫时,外果皮严重扭曲,外果皮及果肉细胞破裂和自溶现象均明显(图11-F)。这说明外果皮细胞比果肉细胞更易受低温伤害。
图 11不同低温胁迫下枇杷幼果外果皮和果肉的显微结构观察(20×)
A.12 ℃(对照);B.6 ℃,箭头部位是外果皮;C.3 ℃,箭头部位是外果皮;D.0 ℃,箭头部位是外果皮;E.-3 ℃,箭头部位分别是外果皮和中果皮;F.-6 ℃,箭头部位分别是外果皮和中果皮;EX.外果皮;ME.中果皮
Fig.11Microstructure of exocarp and pulp of young loquat fruit under low-temperature stress (20×)
A.12 ℃(control);B.6 ℃,arrow marks exocarp;C.3 ℃,arrows mark exocarp;D.0 ℃,arrow marks exocarp;E.-3 ℃,arrow marks exocarp and mesocarp;F.-6 ℃,arrows mark exocarp and mesocarp;EX.Exocarp;ME.Mesocarp
2.3.2枇杷幼果种子枇杷幼果在12 ℃(对照)下,其种子种皮和种胚的细胞完整(图12-A);在6 ℃低温胁迫时,种皮轻微凹陷,但种胚仍完整(图12-B);在3 ℃低温胁迫时,种皮与种胚连接紧密,但种胚细胞出现破裂和细胞自溶现象(图12-C);在0 ℃低温胁迫时,种皮与种胚开始出现分离现象,种胚细胞自溶现象明显(图12-D);在-3 ℃低温胁迫时,种皮与种胚分离明显,细胞破裂和自溶均严重(图12-E);在-6 ℃低温胁迫时,种皮与种胚基本完全分离,细胞自溶现象加剧(图12-F)。
图 12不同低温胁迫下枇杷幼果种子的显微结构观察(20×)
A.12 ℃(对照);B.6 ℃,箭头部位是种皮;C.3 ℃,箭头部位是种胚;D.0 ℃,箭头部位分别是种皮与种胚;E.-3 ℃,箭头部位分别是种皮和种胚;F.-6 ℃,箭头部位分别是种皮和种胚;TE.种皮;EM.种胚
Fig.12Seed microstructure of young loquat fruit under low-temperature stress (20×)
A.12 ℃(control);B.6 ℃,arrow marks testa;C.3 ℃,arrow marks embryo;D.0 ℃,arrows mark testa and embryo;E.-3 ℃,arrows mark testa and embryo;F.-6 ℃,arrows mark testa and embryo;TE.Testa;EM.Embryo
3讨论
LT50是反映植物抗寒性及低温耐受力的重要生理生态指标[14-15]。本试验发现,枇杷幼果果肉和种子的LT50分别为-6.1和-4.9 ℃,说明果肉的耐低温能力强于种子,这与陈桂枝等[2]提出的“幼果最易受冻,常表现为种子先受冻致死”的结论相一致。
SOD可清除活性氧,POD和CAT可分解H2O2,抗氧化酶系统的协同作用能清除活性氧自由基,防止膜脂过氧化[16-17]。本试验结果表明,当枇杷幼果果肉和种子在低温胁迫较轻(果肉、种子温度分别在0 ℃以上和3 ℃以上时)时,幼果内SOD、CAT和POD活性均上升,抗氧化酶系统的协同作用防止膜脂过氧化,相对电导率和MDA含量均相对较低。当果肉和种子分别经-3 ℃、0 ℃低温胁迫处理12 h和24 h,虽然SOD活性较高,催化活性氧形成H2O2,但此时CAT和POD的活性快速降低,H2O2无法被分解,造成H2O2积累而产生毒害,抗氧化酶系统失去保护功能。这也进一步表明,果肉耐低温能力强于种子。
此外本试验还发现,在-3 ℃以下的低温胁迫后枇杷幼果果肉和种子POD活性出现快速回升现象。这可能与幼果低温伤害后细胞木栓化有关,因为POD不仅是活性代谢中活性氧清除系统的一种重要酶类[16],同时它还是木质素生物合成中的关键酶,POD在H2O2参与下催化木质素单体聚合成木质素,提高组织木质化程度[18]。但其内在原因尚有待于进一步研究。
低温胁迫下,果实表皮细胞和果肉细胞发生明显变化,低温伤害较轻时表皮蜡质层出现凹凸不平和褶皱,随着胁迫加重,果肉细胞自溶,细胞结构和功能被破坏[3-4,9,19]。本研究发现,枇杷幼果在6 ℃低温胁迫下,外果皮和种皮出现轻微凹陷;在3 ℃低温胁迫下,外果皮和种皮细胞破裂,果肉细胞完整,但种胚细胞开始自溶;0 ℃低温胁迫时外果皮细胞开始自溶,果肉细胞则在-3 ℃低温胁迫时才出现自溶。以上结果表明,枇杷幼果外果皮、种皮和种胚在3 ℃时开始受低温伤害,中果皮(果肉)在-3 ℃时才开始受低温伤害;枇杷幼果果肉耐低温能力最强,其次为外果皮,而种子则最弱。这与陈桂枝等[2]的观点“幼果受冻常表现为种子先受冻致死”一致。
4结论
枇杷幼果果肉和种子的低温半致死温度分别是-6.1和-4.9 ℃。果肉、种子分别在0和3 ℃以上的轻度低温胁迫时,SOD、CAT和POD活性均上升,MDA含量均较低;但果肉、种子分别在-3 ℃和0 ℃以下重度低温胁迫时,3种酶活性降低,相对电导率及MDA含量上升。枇杷幼果外果皮、种皮和种胚在3 ℃时开始受低温伤害,中果皮(果肉)在-3 ℃时才开始受低温伤害。幼果果肉耐低温能力最强,其次为外果皮,而种子则最弱。
[参考文献]
[1]李靖,孙淑霞,谢红江,等.枇杷花果冻害与若干生理生化指标的关系 [J].果树学报,2011,28(3):453-457.
Li J,Sun S X,Xie H J,et al.The relationship between freezing injury and physiological indexes of loquat(Eriobotryajaponica) flowers and fruits [J].Journal of Fruit Science,2011,28(3):453-457.(in Chinese)
[2]陈桂枝,胡波.枇杷的冻害生理和防冻措施 [J].柑桔与亚热带果树信息,2001(9):26-27.
Chen G Z,Hu B.Physiology of loquat frost and freezing measures [J].News of Citrus and Subtropical Fruit,2001(9):26-27.(in Chinese)
[3]郑国华,张贺英.低温胁迫对枇杷幼果细胞超微结构及膜透性和保护酶活性的影响 [J].热带作物学报,2008,29(6):730-735.
Zheng G H,Zhang H Y.Effects of chilling stress on cell ultrastructure and membrane permeability and protective enzyme activity in young loquat fruits [J].Chinese Journal of Tropical Crops,2008,29(6):730-735.(in Chinese)
[4]郑国华,张贺英.不同低温胁迫下早钟6号枇杷幼果细胞超微结构的变化 [J].福建农林大学学报:自然科学版,2008,37(5):474-476.
Zheng G H,Zhang H Y.Changes in ultrastructure of loquat young fruits under different lower temperature stress [J].Journal of Fujian Agriculture and Forestry University:Natural Science Edition,2008,37(5):474-476.(in Chinese)
[5]李晶,阎秀峰,祖元刚.低温胁迫下红松幼苗活性氧的产生及保护酶的变化 [J].植物学报,2000,42(2):148-152.
Li J,Yan X F,Zu Y G.Generation of activated oxygen and change of cell defense enzyme activity in leaves of korean pine seedling under low temperature [J].Chinese Bulletin of Botany,2000,42(2):148-152.(in Chinese)
[6]吴能表,吴峻岩,朱利泉,等.低温对甘蓝逆境生理指标和蛋白质磷酸化的影响 [J].园艺学报,2003,30(5):530-534.
Wu N B,Wu J Y,Zhu L Q,et al.Effects of low temperature stress on physiological index and protein phosphorylation inBrassicaoleraceaL. [J].Acta Horticulturae Sinica,2003,30(5):530-534.(in Chinese)
[7]黄志明,吴锦程,陈伟健,等.SA对低温胁迫后枇杷幼果AsA-GSH循环酶系统的影响 [J].林业科学,2011,47(9):36-42.
Huang Z M,Wu J C,Chen W J,et al.Effects of SA on enzymes of ascorbate-glutathione cycle in young loquat fruits after low temperature stress [J].Scientia Silvae Sinicae,2011,47(9):36-42.(in Chinese)
[8]刘零怡,赵丹莹,郑杨,等.植物在低温胁迫下的过氧化氢代谢及信号转导 [J].园艺学报,2009,36(11):1701-1708.
Liu L Y,Zhao D Y,Zheng Y,et al.Hydrogen peroxide metabolism and signal transduction under cold stress in plants [J].Acta Horticulturae Sinica,2009,36(11):1701-1708.(in Chinese)
[9]郑国华,张贺英,钟秀容.低温胁迫下枇杷叶片细胞超微结构及膜透性和保护酶活性的变化 [J].中国生态农业学报,2009,17(4):739-745.
Zheng G H,Zhang H Y,Zhong X R.Changes in cell ultra-structure,membrane permeability and protective enzyme activity inEriobotryajaponicaLindl.leaves under cold stress [J].Chinese Journal of Eco-Agriculture,2009,17(4):739-745.(in Chinese)
[10]吴锦程,陈伟建,蔡丽琴,等.外源NO对低温胁迫下枇杷幼果抗氧化能力的影响 [J].林业科学,2010,46(9):73-78.
Wu J C,Chen W J,Cai L Q,et al.Effects of exogenous nitric oxide on anti-oxidation capacities in young loquat fruits under low temperature stress [J].Scientia Silvae Sinicae,2010,46(9):73-78.(in Chinese)
[11]李合生,孙群,赵世杰.植物生理生化实验原理和技术 [M].北京:高等教育出版社,2000:167-169,195,258-263.
Li H S,Sun Q,Zhao S J.Principle and technology of plant physiological and biochemical experiments [M].Beijing:Higher Education Press,2000:167-169,195,258-263.(in Chinese)
[12]朱根海,刘祖祺,朱培仁.应用Logistic方程确定植物组织低温半致死温度的研究 [J].南京农业大学学报,1986(3):12-16.
Zhu G H,Liu Z Q,Zhu P R.A study on determination of lethal temperature with Logistic function [J].Journal of Nanjing Agricultural University,1986(3):12-16.(in Chinese)
[13]于晶,周子珊,牟永潮,等.低温下不同抗寒性冬小麦叶片组织结构比较 [J].东北农业大学学报,2010,41(4):7-11.
Yu J,Zhou Z S,Mu Y C,et al.Comparison of leaf tissue structure of different cold hardiness winter wheat varieties under low temperature [J].Journal of Northeast Agricultural University,2010,41(4):7-11.(in Chinese)
[14]苏维埃,宓容钦,王文美,等.植物抗性指标的数量化研究 [J].中国科学:B辑,1987(10):1058-1067.
Su W A,Mi R Q,Wang W M,et al.The study on the quantification of plant resistance [J].Science in China:Ser B, 1987(10):1058-1067.(in Chinese)
[15]严寒静,谈锋.自然降温过程中栀子叶片膜保护系统的变化与低温半致死温度的关系 [J].植物生态学报,2000,24(1):91-95.
Yan H J,Tan F.The relation between the membrane protective system and semilethal temperature of gardenia jasminoides ellis leaves as temperature fell [J].Acta Phytoecologica Sinica,2000,24(1):91-95.(in Chinese)
[16]杨盛昌,谢潮添,张平,等.低温胁迫下弓葵幼苗膜脂过氧化及保护酶活性的变化 [J].园艺学报,2003,30(1):104-106.
Yang S C,Xie C T,Zhang P,et al.Changes in membrane lipid peroxidation and activities of cell defense enzyme in leaves ofButiacapitatabecc seedling under low temperature stress [J].Acta Horticulturae Sinica,2003,30(1):104-106.(in Chinese)
[17]Fu J M,Huang B R.Involvement of antioxidants and lipid per-oxidation in the adaptation of two cool-season grasses to localized drought stress [J].Environmental and Experimental Botany,2001,45:105-114.
[18]Wang Y S,Tian S P,Xu Y.Effects of high oxygen concentration on por-and anti-oxidant enzymes in peach fruits during postharvest periods [J].Food Chemistry,2005(91):99-104.
[19]陈旭微,杨玲,章艺.低温下的绿豆下胚轴细胞超微结构变化 [J].植物生理学通讯,2006,42(6):1099-1102.
Chen X W,Yang L,Zhang Y.Changes in ultrastructure of hypocotyl cells inPhaseolusradiatusLinn under low temperature condition [J].Plant Physiology Communications,2006,42(6):1099-1102.(in Chinese)
Effects of low temperature stress on antioxidant enzyme system and microstructure of young loquat fruit
YANG Wei1,2,GONG Rong-gao1,2,3,LIAO Ming-an1,WANG Zhi-hui1,LIANG Guo-lu3
(1CollegeofHorticulture,SichuanAgriculturalUniversity,Ya’an,Sichuan625014,China;2RuralDevelopmentBureauofChengduLongquanyiDistrict,Chengdu,Sichuan610100,China;3CollegeofHorticultureandLandscapeArchitecture,SouthwestUniversity,Chongqing400700,China)
Abstract:【Objective】 The antioxidant enzyme system and microstructure in pulp and seed of young loquat fruit under low temperature stress were investigated to explore the physiology response mechanism of fruit to chilling injury.【Method】 ‘Dawuxing’ cultivar was treated by different low temperature stresses (12,6,3,0,-3,and -6 ℃) and processing times (12,24,36,and 48 h).Semi-lethal temperatures (LT50),MDA contents,REC,antioxidant enzyme activities and microstructure in pulp and seed of young loquat fruits were measured and analyzed.【Result】 The semi-lethal temperatures of pulp and seed were -6.1 and -4.9 ℃,respectively.The activities of SOD,CAT and POD in pulp and seed increased at temperatures of 3 and 0 ℃,while the relative electric conductivity (REC) and MDA content were at low levels.But the activities of SOD,CAT and POD decreased gradually at temperatures of -3 and <0 ℃,while REC and MDA increased.Microstructure diagram showed that the loquat exocarp of young fruits broken at 0 ℃,mesocarp (pulp) broken at -3 ℃ and the fruit had remarkable freeze injury.The seed of young fruit was firstly destroyed at 3 ℃,testa and embryo began to separate at 0 ℃,embryo cell autolyzed clearly,and chilling injury was heavy.【Conclusion】 The antioxidant enzyme activities increased at moderate low temperature stress,whereas they declined significantly at certain critical temperature stress.Mesocarp of young loquat fruit showed the highest cold resistance,followed by exocarp and seed.
Key words:low temperature stress;young loquat fruit;antioxidant enzyme;microstructure
DOI:网络出版时间:2016-03-1408:4510.13207/j.cnki.jnwafu.2016.04.026
[收稿日期]2014-08-21
[基金项目]国家农业科技成果转化项目(2010GB2F000408)
[作者简介]杨伟(1975-),男,四川成都人,在读博士,主要从事园艺生理生态及高品质化栽培研究。[通信作者]廖明安(1957-),男,四川仁寿人,教授,博士,博士生导师,主要从事果树栽培研究。E-mail:63830947@qq.com
[中图分类号]S667.3
[文献标志码]A
[文章编号]1671-9387(2016)04-0195-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160314.0845.052.html
