分离自高寒牧草根际溶磷菌的溶磷动态
2016-06-14张英芦光新刘育红李淑娟谢永丽徐
张英+芦光新+刘育红+李淑娟+谢永丽+徐志伟


摘要:溶磷菌能增加土壤中磷元素的有效性,提高植物对磷素的利用率。本研究采用蒙金娜有机磷和PKO无机磷固体培养基,对高寒牧草燕麦(Avena sterilis)、披碱草(Elymus dahuricus)根际分离的14株溶磷菌进行平板培养,在观察菌落形态特征的基础上,采用溶磷圈对菌株的溶磷能力进行了动态测定。结果表明,供试菌株大部分颜色为灰白色和淡黄色,菌落中间突起,表面湿润圆滑,生长速度中等。培养期间,供试菌株对有机磷的溶磷能力随着培养天数的增加呈现出先增加后减少再增加的变化趋势,供试菌株对无机磷的溶解能力随着培养天数的增加逐渐增加。其中,菌株PYXP4、PYXP5、PYXP16、PYXP21、PYXY1具有较强的溶解有机磷的能力,菌株PWXP3、PWXP9、PWXP18具有较强的溶解无机磷的能力,这些菌株具有开发溶磷菌肥的潜力,其他特性有待进一步研究。
关键词:高寒牧草;根际;溶磷菌;溶磷能力;有机磷;无机磷;动态测定
中图分类号:S154.39
文献标志码: A
文章编号:1002-1302(2016)04-0490-03
磷是植物生长发育不可缺少的营养元素之一,也是植物的重要组成成分。植物所需的磷素主要来源于土壤中的有效磷,而磷元素主要以难溶态磷的形式存在于土壤中[1],土壤中95% 以上的磷为无效磷[2]。在农业生产活动中,施入土壤的磷肥80%~95%会被土壤吸附固定,通过物理吸附、化学吸附、阴阳离子交换、表面沉淀、独立固相沉淀等途径转化为无机态磷,植物难以吸收利用[3-5]。故世界上绝大部分农业土壤缺磷( 总磷不缺,缺少活性磷),我国土壤缺磷的面积较大,74% 的耕地土壤缺磷,施入的磷肥当季利用率为5%~25%,据估计约占总耕地面积的2/3[6]。所以,如何提高磷肥的使用效率,有效利用土壤中被固定的无效态磷,对减少农牧业生产中磷肥的使用和磷矿资源的消耗有着重要的意义。以往的研究表明,土壤中有许多微生物具有不同程度的将难溶磷转化为有效磷的能力,这类微生物被称为溶磷菌,它们能够依靠自身的代谢产物或与其他生物协同溶解土壤中的难溶性磷素,提高土壤中磷素的利用效率,是解决土壤磷素缺乏的重要途径之一[7]。目前,很多研究者筛选到多种溶磷细菌和真菌,但菌株的活性差异较大,了解溶磷菌溶磷能力的动态变化对溶磷菌的筛选和溶磷机理的研究有着重要的意义[8],目前还未见到该方面的研究报道。本研究就分离自高寒牧草根际的溶磷菌为研究对象,在观察菌株生物学特性的同时,主要对菌株的溶磷动态进行测定,掌握溶磷菌的溶磷能力随时间的变化特征,对溶磷菌株的筛选、开发及研制生物菌肥提供理论依据和菌株资源。
1 材料与方法
1.1 供试菌株
供试菌株分离自西藏阿里高寒地区优良牧草燕麦(Avena sterilis)、披碱草(Elymus dahuricus)根际的14株生长快、功能优良的溶磷菌(表1)。
1.2 培养基
培养基为Pikovaskaias(PKO)无机磷培养基[9],蒙金娜有机磷培养基[10],LB固体培养基[11]。(1)PKO无机磷培养基:Ca3(PO4)2 3.0 g, 蔗糖 10.0 g,NaCl 0.5g,(NH4)2SO4 0.1 g,MgSO4·7H2O 0.1 g, KCl 0.2 g,MnSO4 trace(stock=0.004 g/L), Agar 15.0 g,蒸馏水1 000 mL,酵母膏0.5 g,FeSO4 trace(stock=0.004 g/L),pH值7.0;(2)蒙金娜有机磷培养基:葡萄糖10.0 g, (NH4)2SO4 0.5 g,NaCl 0.3 g, KCl 0.3 g,FeSO4·7H2O 0.03 g, MnSO4·4H2O 0.03 g,卵磷脂 0.2 g, CaCO3 5.0 g,酵母膏04 g, 琼脂 20.0 g,蒸馏水 1 000 mL,pH值7.0;(3)LB(Luria-Bertani)培养基:牛肉膏10 g,蛋白胨 5 g,NaCl 5 g,琼脂 20 g,总体积1 000 mL(蒸馏水补足),pH值7.0。
1.3 测定方法
将LB斜面培养基中保存的菌株在LB培养基上进行活化后点接于PKO无机磷及蒙金娜有机磷平板上,在28 ℃恒温培养箱中进行培养,培养至6 d时观察待测菌株的形态特征,同时分别于培养3、 5、7、9、11 d时测量菌落直径(d)和其形成的溶磷圈直径(D),根据菌株相应的D值和d值的比值初步确定该菌株溶磷能力。
1.4 数据处理
采用SPSS 17.0 软件进行数据的统计、分析。
2 结果与分析
2.1 菌株活化及形态特征的观察
将保存在LB斜面培养基上的供试溶磷菌株在LB平板培养基上进行活化,并在PKO无机磷和蒙金娜有机磷固体培养基培养6 d,观察并记录菌落形态特征(表2)。结果表明,供试菌株大部分颜色为灰白色和淡黄色,菌落中间突起,表面湿润圆滑,生长速度中等。
2.2 菌株溶磷能力的动态测定
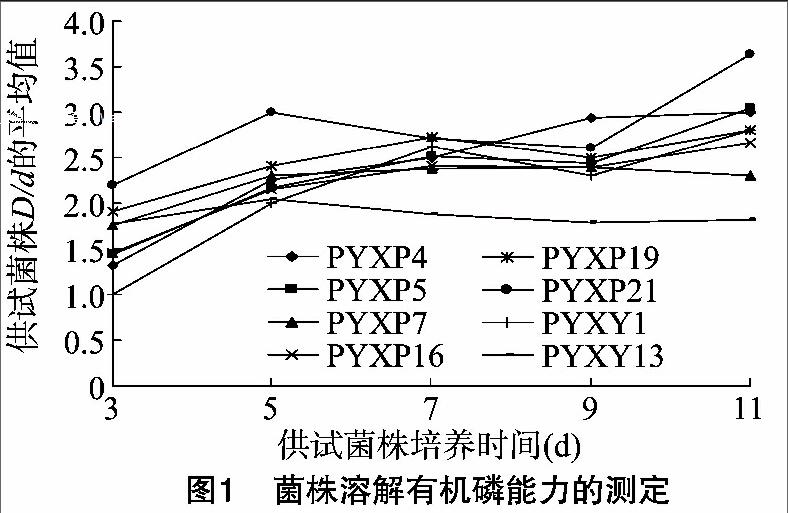
2.2.1 有机磷培养基上溶磷能力的动态测定 对溶磷菌株经蒙金娜有机磷固体培养基培养3、5、7、9、11 d 时分别测定相应的菌落直径(d)和溶磷圈直径(D)(图1)。结果表明,供试菌株在蒙金娜有机磷固体培养基上培养期间,除了PYXP7和PYXY13菌株外,大部分菌株随着培养天数的增加溶磷能力呈现出先增加后减少再增加的变化趋势。其中,PYXP21在培养期间,除了培养9 d之外均表现出最强的溶磷能力。在培养3 d时溶磷能力较强的PYXY13菌株,到5 d以后溶磷能力一直最小。培养3 d时菌株PYXP7和PYXY13溶磷能力显著高于PYXY1菌株,而PYXY1菌株在培养11 d时的溶磷能力却显著高于PYXP7和PYXY13菌株。所以,溶磷菌在蒙金娜有机磷培养基培养的不同时间所表现的溶磷能力不同,并且差异显著。
2.2.2 无机磷培养基上溶磷能力的动态测定 对溶磷菌株经PKO无机磷固体培养基培养3、5、7、9、11 d时分别测定相应的菌落直径(d)和溶磷圈直径(D)(图2)。结果表明,供试菌株在PKO无机磷固体培养基上随着培养天数的增加溶磷能力逐渐增加,到11 d时,PWXP18表现出最强的溶磷能力,PWXP25的溶磷能力最低。在培养期间,菌株PWXP9和PWXP18的溶磷能力变化幅度最大,显著超过了培养初期时溶磷能力较强的各菌株,在培养9 d以后溶磷能力又各不相同,菌株PWXP18溶磷能力继续增大,而PWXP9溶磷能力表现出下降趋势。溶磷菌在PKO无机磷培养基培养的不同时间所表现的溶磷能力的动态变化特征也不同,并且差异也比较显著。
3 讨论
自Staltrom等发现并报道溶磷菌[12]以来,很多的学者对溶磷菌进行了广泛的研究,取得了很多成果。Sachett等从土壤中筛选到36株能形成肉眼可见溶磷圈的细菌[13]。Kelly等研究了硝化细菌对磷酸三钙的溶解能力[14]。陈廷伟等从小麦根际土壤中分离到产酸杆菌(Bacillus sp.),经测定具有较强的溶解磷酸三钙的能力[15]。姚拓等从小麦、燕麦、三叶草、苜蓿、垂穗披碱草、青稞等根际分离获得了高效溶磷菌株(Azotobacter、Azospirillus、Pseudomonas、Zoogloea)等,对各菌株的溶磷能力、培养特性、菌株分泌IAA、菌株的抗病特性等方面做了大量的研究工作,各菌株不但具有溶解无机磷能力,同时还具有分泌植物生长素、固氮特性和良好的促生效能,不同菌株的溶磷能力存在差异[16-23]。孙珊等研究发现,溶磷菌株GJT-1能溶磷磷酸三钙、磷酸铁和磷酸铝,对开阳磷矿粉和宜昌磷矿粉的溶磷量为194.25 mg/L和120.59 mg/L[24]。辛桢凯等研究了溶磷菌的溶磷能力,菌株XH1和XH2溶解磷酸钙的能力很强,液培 7 d 时溶磷量为267.08 mg/L和 415.69 mg/L[25]。本研究结果表明,不同菌株的溶磷能力不同,差异显著,与以往各位学者的研究结果相一致。但本研究结果也表明,不同菌株在培养的不同时间所表现的溶磷能力及变化趋势和变化幅度也各不相同,而且差异比较显著。在菌株培养的不同时间,筛选溶磷能力强的菌株结果可能不同,这可能会影响优良菌株的筛选。目前,很多学者采用溶磷圈法筛选功能优良的溶磷菌株,培养的时间也各不相同,培养的时间对优良菌株的筛选有着重要的影响,所以,如何去确定菌株筛选时的培养时间还须开展进一步研究。
4 结论
本研究供试的14株溶磷菌株在PKO无机磷培养基和蒙金娜有机磷培养基培养6 d,颜色为灰白色和淡黄色,大部分菌落中间突起,表面湿润圆滑,生长速度中等。从培养的动态变化过程分析,菌株PYXP4、PYXP5、PYXP16、PYXP21、PYXY1具有较强的溶解有机磷的能力,菌株PWXP3、PWXP9、PWXP18具有较强的溶解无机磷的能力,这些菌株具有开发溶磷菌肥的潜力,其他特性有待进一步研究。不同菌株在培养的不同时间所表现的溶磷能力及变化趋势和变化幅度也各不相同,而且差异比较显著,为了筛选优良的溶磷菌株,如何去确定菌株筛选时的培养时间还须开展进一步研究。
参考文献:
[1]Abd-Alla M H. Phosphatases and the utilization of organic phosphorus by Rhizobium leguminosarum biovar viceae[J]. Letters in Applied Microbiology, 1994, 18(5): 294-296.
[2]冯 欣,刁治民,曹玲珍,等. PGPR作为微生物肥料的研究进展[J]. 安徽农学通报,2005,11(6):85-87, 77.
[3]林 葆,李家康,黄照愿. 中国肥料[M]. 上海:上海科学技术出版社,1994:13-32.
[4]Wang H,Appan A,Gulliver J S. Modeling of phosphorus dynamics in aquatic sediments: Ⅱ. examination of model performance[J]. Water Research, 2003, 37(16): 3939-3953.
[5]徐俊兵. 扬州市土壤有机质和速效磷钾的分布研究[J]. 土壤,2004,36(1):99-103.
[6]葛 诚. 微生物的生产应用及其发展[M]. 北京:中国农业科技出版社,1996.
[7]冯月红,姚 拓,龙瑞军.土壤解磷菌研究进展[J]. 草原与草坪,2003(1):3-7.
[8]黄晓东,季尚宁,Glick B,等. 植物促生菌及其促生机理[J]. 现代化农业,2002,7(6):7-7.
[9]Hafeez F Y,Malik K A. Manual on biofertilizer technology[M]. Pakistan: National Institute for Biotechnology and Genetic Engineering,2000.
[10]朱 颖,姚 拓,李玉娥,等. 红三叶根际溶磷菌分离及其溶磷机制初探[J]. 草地学报,2009,17(2):259-263.
[11]李凤霞,张德罡,姚 拓.高寒地区燕麦根际高效PGPR菌培养条件研究[J]. 甘肃农业大学学报,2004,39(3):316-320.
[12]Staltrom V A. Boitrag Zur kennturs der Ein-wisking sterilerunder Garung bofindlicher organischer strofffe auf dilloslickeit der phosphorsen des tricalcium phosphate[J]. Zel Bskt, 1908, 11: 724-732.
[13]Sachett W G,Patto A J,Bromn C W. The solvent action of soil bacteria upon the insoluble phosphates of raw bone meal and natural rock phosphate[J]. Central Bacterial, 1908, 20: 668-703.
[14]Kelly W D O. On the incidence of bovine and human viruses in human tuberculosis in Ireland[J]. Transaction of the Royal Academy of Medicine in Ireland, 1918, 36(1): 26-46.
[15]陈廷伟. 钾细菌[M]. 北京:农业出版社,1959.
[16]姚 拓,龙瑞军,王 刚,等. 兰州地区盐碱地小麦根际联合固氮菌分离及部分特性研究[J]. 土壤学报,2004,41(3):444-448.
[17]李凤霞,梁锦绣,周 涛.宁夏产枸杞根际溶磷菌分离及溶磷能力分析[J]. 植物资源与环境学报,2006,15(2):29-32.
[18]汤春梅,陈秀蓉,姚 拓,等. 九种根际促生菌最适培养条件初探[J]. 草原与草坪,2005(3):27-30.
[19]冯瑞章,姚 拓,周万海,等. 溶磷菌和固氮菌溶解磷矿粉时的互作效应[J]. 生态学报,2006,26(8):2764-2769.
[20]朱 颖. 三叶草根际溶磷菌特性及其促生效果研究[D]. 兰州:甘肃农业大学,2009.
[21]刘青海. 六株溶磷菌与四株固氮菌互作效应及其菌剂对苜蓿促生效果研究[D]. 兰州:甘肃农业大学,2011.
[22]张 英,姚 拓,朱 颖.复合接种剂对三叶草生长特性和品质的影响[J]. 植物营养与肥料学报,2012,18(5):1277-1285.
[23]张 英,朱 颖,姚 拓,等. 分离自牧草根际四株促生菌株(PGPR)互作效应研究[J]. 草业学报,2013,22(1):29-37.
[24]孙 珊,黄 星,范宁杰,等. 一株溶磷细菌的分离、鉴定及其溶磷特性研究[J]. 土壤,2010,42(1):117-122.
[25]辛桢凯,龚文琪,胡 纯,等. 溶磷微生物的选育及除磷研究[J]. 武汉理工大学学报,2011(1):121-124.杜威漩,吕 瑜,袁俊林. 政府投资的小型农田水利项目建设中的委托代理博弈[J]. 江苏农业科学,2016,44(4):493-496.
