河南省小麦新品种对茎基腐病的抗性鉴定与评价
2016-06-14陆宁海吴利民郎剑锋杨蕊李营营周
陆宁海+吴利民+郎剑锋+杨蕊+李营营+周文敏+秦琦

摘要:近年来,随着耕作制度的改变和品种的变化,茎基腐病成为河南省麦区生产上的新问题,对小麦生产威胁很大,且呈现不断加重的趋势。通过室内盆栽接种试验和田间试验,对河南省19个小麦新品种抗茎基腐病性能进行鉴定和评价。结果表明,品种间存在明显的抗性差异,但整体抗性较差,无免疫和高抗品种。室内苗期鉴定表明:中抗品种只有1份,是华育198,占总数的5.0%;中感品种有3份,占总数的15.0%,包括开麦18、百农207和平安8号;高感品种有16份,占总数的80.0%。田间成株期抗病性鉴定表明:中抗品种有5份,占总数的25.0%,包括华育198、开麦18、百农207、平安8号和偃展410;中感品种有4份,占总数的20.0%,包括洛麦24、许科718、豫农416、怀川916;高感品种有11份,占总数的55.0%。
关键词:河南省;小麦;新品种;茎基腐病;抗病性;鉴定
中图分类号:S435.121.4
文献标志码: A
文章编号:1002-1302(2016)04-0190-03
小麦茎基腐病(crown rot,CR)是由多种病菌引起的一种世界性土传病害。在澳大利亚,茎基腐病每年造成减产所导致的直接经济损失约为7 900万澳元,间接损失大约为4.34亿澳元 [1-2]。近年来,茎基腐病在南非、意大利、埃及、土耳其、叙利亚、摩洛哥和阿根廷等麦类作物种植区也呈现越来越严重的趋势,受到各国科研工作者的广泛关注[3-6]。由于常年实施秸秆还田,造成土壤中菌源积累,加上品种抗性较差、水浇田面积扩大等因素,该病害在我国黄淮小麦主产区的河南、河北、山东、安徽等省份普遍发生,特别是河南省焦作市、许昌市、商丘市、新乡市等部分麦田发生严重,而且呈现不断加重和蔓延趋势[7]。2014年新乡市小麦茎基腐病发病严重,一般田发病率为10%~15%,个别田块白穗率高达20%~30%,成为小麦减产最主要的因素。茎基腐病是一种典型的土传病害,化学药剂防治效果逐渐下降,而且大规模使用化学药剂对生态环境造成危害,对农业的可持续发展产生影响。筛选茎基腐病抗源,选育和使用抗茎基腐病小麦新品种无疑是解决这一问题最有效、最经济的途径。本研究对河南省主要的20个小麦新品种进行茎基腐病抗性鉴定和分析,旨在了解目前河南省小麦品种的抗病现状,从而为全省小麦抗病育种和品种的合理利用及病害控制提供科学依据。
1 材料与方法
1.1 供试小麦品种
供试品种有20个,分别为华育198、开麦18、百农207、平安8号、偃展410、洛麦24、许科718、豫农416、开麦21、怀川916、豫教5号、兰考198、花培8号、漯麦18、先麦10号、中育9398、焦麦266、中麦78、新麦26和良星66,对照品种周麦18,由河南科技学院小麦研究中心提供。
1.2 供试病原菌
小麦茎基腐菌为镰刀菌群,由河南科技学院植物病理实验室分离、鉴定、保存。
1.3 接种体的准备
取清水浸泡2 d后的小麦粒置于250 mL三角瓶中,每瓶 50 g,高压灭菌(121 ℃,1 h),接入在PDA 培养基上培养4 d的病菌菌株,25 ℃静置培养10 d,每天振摇三角瓶以打碎结块的麦粒[8]。
1.4 室内苗期抗性鉴定方法
将供试小麦的种子表面消毒(1%次氯酸钠溶液),后播于塑料盆钵中(口径为10 cm),每盆20粒,盖上灭菌土,每个品种种植3盆,正常栽培管理,待小麦长到1叶1心期接入带菌病麦粒,35 d后调查病情。病害严重度分级标准为:0级,无症状;1级,第1叶鞘褐枯小于叶鞘长度50%,第1张叶褪绿黄化不明显;2级,第1叶鞘褐枯大于叶鞘长度50%,第1张叶明显褪绿黄化,但没有完全枯死;3级,第1张叶完全枯死,第2叶鞘有明显褐枯,第2张叶叶尖开始褪绿黄化枯死;4级,第2张叶有明显褐枯,枯死斑占叶片长度的50%以下;5级,第2张叶有明显褐枯,枯死斑占叶片长度的50%以上;6级,第2张叶完全枯死,第3张叶叶尖开始褪绿黄化枯死;7级,第3张叶有明显褐枯,枯死斑占叶片长度的50%以下;8级,第3张叶有明显褐枯,枯死斑占叶片长度的50%以上;根据下列公式计算病情指数:
病情指数=∑(各病级株数×各病级代表值)/(总株数×最高级代表值)×100。
1.5 田间抗病性鉴定方法
试验于2013—2014年在河南省新乡市洪门镇桥谢村进行,该区常年种植小麦,茎基腐病发生严重。品种随机排列,分20个小区,每小区面积为10~15 m2,于2013年10月8日种植,田间管理同当地大田。小麦灌浆期采用5点取样法调查病情,病害严重度分级标准为:0级,无症状;1级,第1茎节变为褐色;2级,第2茎节变为褐色;3级,第3茎节变为褐色,但没有形成白穗;4级,穗部的50%以下形成了白穗;5级,穗部50%~100%形成了白穗;6级,茎基部腐烂,整株死亡。
1.6 抗性评价
采用相对抗病指数(I)对不同小麦品种抗病性进行评价[9]。采用相对抗病性方法评价品种的抗病程度,抗病类型分为免疫(I)、高抗(HR)、中抗(MR)、中感(MS)、高感(HS)5类。
I=1.00时为免疫;0.80≤I<1.00时为高抗;0.60≤I<0.80 时为中抗;0.40≤I<0.60时为中感;I≤0.40时为高感。相对抗病指数(I)=1-所测品种病情指数/发病最重品种病情指数。
2 结果与分析
2.1 小麦品种对茎基腐病在苗期的抗性评价
由表1可知,供试小麦品种中没有免疫和高抗品种,0.60≤I<0.80的中抗品种只有1份,是华育198,占总数的5.0%;0.40≤I<0.60的中感品种有3份,占总数的15.0%,包括开麦18、百农207和平安8号;I≤0.40的高感品种有16份,占总数的80.0%,包括偃展410、洛麦24、许科718、豫农416、怀川916、豫教5号、兰考198、花培8号、漯麦18、先麦10号、中育9398、焦麦266、新麦26、中麦78、良星66和周麦18。
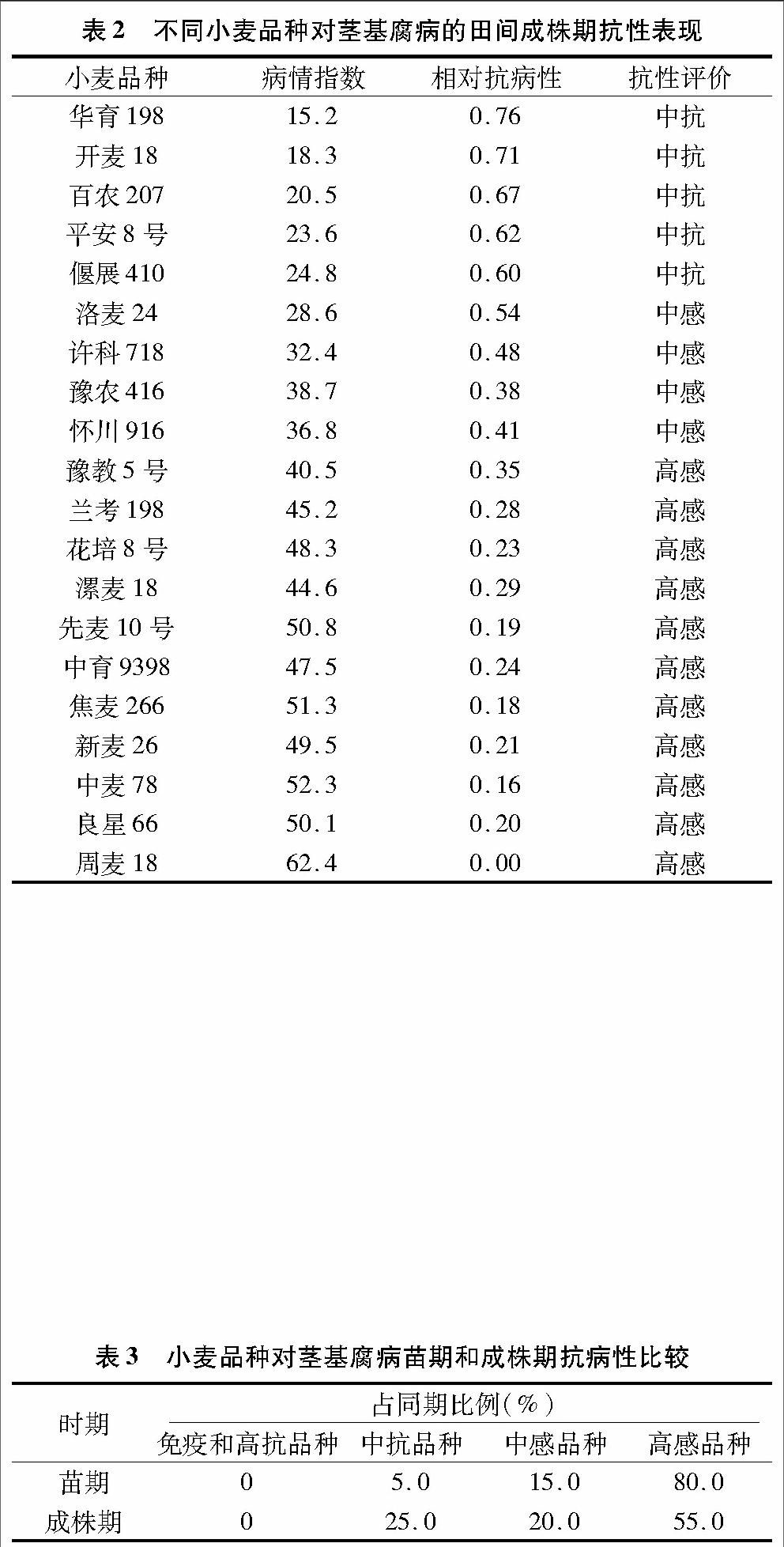
2.2 小麦品种对茎基腐病在田间成株期的抗性评价
由表2可知,供试小麦品种中没有免疫和高抗品种,0.60≤I<0.80的中抗品种有5份,占总数的25.0%,包括华育198、开麦18、百农207、平安8号和偃展410;0.40≤I<0.60 的中感品种有4份,占总数的20.0%,包括洛麦24、许科718、豫农416、怀川916;I≤0.40的高感品种有11份,占总数的55.0%,包括豫教5号、兰考198、花培8号、漯麦18、先麦10号、中育9398、焦麦266、新麦26、中麦78、良星66和周麦18。
2.3 小麦品种对茎基腐病在苗期和成株期的抗病性比较
由表3可知,小麦品种对茎基腐病在苗期和成株期抗病性有一定的相关性,但也有一定的差异,苗期和成株期鉴定都没有发现免疫或高抗品种,成株期中抗品种比例明显上升,而高感品种明显减少,中感品种比例差异不明显。苗期鉴定只有1个中抗品种,比例为5.0%,而成株期鉴定有4个中抗品种,比例为25.0%;高感品种在成株期占比明显减少,苗期鉴定有20个高感品种,比例为80.0%,而成株期鉴定有11个高感品种,比例为55.0%。
3 结论与讨论
本研究鉴定了河南省主要小麦新品种对茎基腐病的抗性,没有发现免疫和高抗品种。室内盆栽试验表明,各供试小麦品种间的确存在抗病性差异,5.0%的品种表现为中抗,15.0% 的品种表现为中感,80.0%的品种表现为高感。田间成株期鉴定有4个中抗品种,比例为25.0%;中感品种有4个,占总数的20.0%;有11个高感品种,比例为55.0%。因此,河南省目前生产上大面积种植的品种大部分表现为感病,这也是小麦茎基腐病近几年普遍发生的主要原因之一。在没有免疫和高抗品种的背景下,在茎基腐病发生严重的地区种植中抗品种,在病害发生较轻的地区种植中感品种,并结合药剂拌种或包衣,合理管理水肥是目前防治小麦茎基腐病的关键措施。
对同一种品种来说,室内苗期比田间成株期发病严重,病情指数高,造成这种差异的原因很多,一方面室内苗期鉴定的病原菌数量比较充足,温度相对稳定,湿度较高,有利于病害发生;而田间是自然发病,土壤中初侵染病菌数量有限,病菌侵染还要受到外界气候条件的影响,特别是温湿度的影响显著;另外,田间土壤性质、类型、施肥、种植方式和微生物数量也可能影响到茎基腐病的发生和流行。在田间没有进行苗期茎基腐的抗病性调查,主要是因为病害苗期症状首先表现为叶尖发黄,叶片黄化褪绿,逐渐枯死,这些症状特点也有可能是病毒病、缺微量元素或其他原因导致,后期茎基部叶鞘和茎秆变褐,有时可引起根部变褐腐烂,严重时麦苗发黄死亡,可能是小麦普通根腐病(Bipolaris sorokiniana)或小麦纹枯病(Rhizoctonia cerealia)导致的,也可能是这些病害混合发生。因此,仅根据田间苗期的症状特点无法确定是否为茎基腐病。
国外试验表明,小麦茎基腐病苗期鉴定结果与田间鉴定结果具有较高的相关性[10-11]。虽然苗期鉴定茎基腐病是有效的方法而且相对易于控制,但苗期抗性鉴定与评价结果还需要通过田间试验验证,抗性评价可能存在有误差。本研究也证明了小麦品种与茎基腐病苗期和成株期抗病性有一定的相关性,但也有一定的差异,成株期中抗品种比例明显上升,而高感品种明显减少。因为田间发病受到多种因素影响,为了客观评价小麦品种对茎基腐病的抗性,在苗期抗病性鉴定的基础上,田间应进行多年抗性鉴定。但是田间鉴定受到气候条件的影响,1年只能进行1次,如果要快速多次鉴定筛选抗源材料和鉴定品种抗病性,苗期抗病性也是一种有效的方法。
小麦茎基腐病是由多种土传真菌引起的一种小麦病害,国外研究表明,黄色镰刀菌(F.culmorum)、燕麦镰刀菌(F.avenaceum)、禾谷镰刀菌(F.graminearum)也能引起小麦茎基腐病,其中以禾谷镰刀菌致病性最强[12]。在我国,李伟等报道小麦茎基褐腐病的危害,但其病原以小麦根腐离蠕孢(Bipolari sorokiniana)和镰刀菌(Fusarium spp.)为主[8]。张向向等报道我国小麦茎基腐病的镰刀菌主要由F.asiaticum和F.graminearum组成,且以F.asiaticum种群分布为主[13]。Li等报道了引起我国茎基腐病的镰刀菌除了禾谷镰刀菌外,还有假禾谷镰刀菌(F.pseudograminearum)[14]。国内外学者研究病菌的致病性和品种抗性时,多数以禾谷镰刀菌为靶标[15-16],但本研究采用镰刀菌群为靶标鉴定品种的抗性,因为小麦茎基腐病就是由多种病菌复合侵染,以多种镰刀菌为主。因此,研究品种的抗性或抗源的筛选,以镰刀菌群为靶标,更接近实际情况。
参考文献:
[1]Chakraborty S,Liu C J,Mitter V,et al. Pathogen population structure and epidemiology are a key to wheat crown rot and Fusarium head blight management[J]. Australasian Plant Pathology,2006,35(6):643-655.
[2]Mitter V,Francl L J,Ali S,et al.Ascosporic and conidial inoculum of Gibberella zeae play different roles in Fusarium head blight and crown rot of wheat in Australia and the USA[J]. Australasian Plant Pathology,2006,35(4):441-452.
[3]Dyer A T,Johnston R H,Hogg A C,et al.Comparison of pathogenicity of the Fusarium crown rot(FCR) complex(F.culmorum,F.pseudograminearum and F.graminearum) on hard red spring and durum wheat[J]. European Journal of Plant Pathology,2009,125(3):387-395.
[4]Williams K J,Dennis J I,Smy I C,et al. The application of species-specific assays based on the polymerase chain reaction to analyse Fusarium crown rot of durum wheat[J]. Australasian Plant Pathology,2002,31:119-127.
[5]Bentley A R,Cromey M G,Farrokhi-Nlejad R,et al.Fusarium crown and root rot pathogens associated with wheat and grass stem bases on the South Island of New Zealand[J]. Australasian Plant Pathology,2006,35(5):495-502.
[6]Sukumar C,Friday O,Rhyannyn W,et al.Wheat crown rot pathogens Fusarium graminearum and F.pseudograminearum lack specialization[J]. Phytopathology,2010,100(10):1057-1065.
[7]周海峰,杨 云,牛亚娟,等. 小麦茎基腐病的发生动态与防治技术[J]. 河南农业科学,2014,43(5):114-117.
[8]李 伟,陈 莹,张晓祥,等. 小麦茎基褐腐病病原菌组成及其致病力研究[J]. 麦类作物学报,2011,31(1):170-175.
[9]孙 虎,李洪连,袁虹霞,等. 不同小麦品种(系)对全蚀病的抗性鉴定和评价[J]. 河南农业科学,2004(8):52-54.
[10]Wallwork H,Bunutt M,Cheong J P E,et al. Resistance to crown rot in wheat identified through an improved method for screening adult plants[J]. Australasian Plant Pathology,2004,33(1):1-7.
[11]Wildemuth G B,Mc Namara R B.Testing wheat seedlings for resistance to crown rot caused by Fusarium graminearum group 1 [J]. Plant Disease,1994,78(10):949-953.
[12]Akinsanmi O A,Mitter V,Sinpfendorfer S,et al. Identity and pathogenicity of Fusarium spp. isolated from wheat fields in Queensland and Northern New South Wales[J]. Crop & Pasture Science,2004,55(1):97-107.
[13]张向向,孙海燕,李 伟,等. 我国冬小麦主产省小麦茎基腐镰孢菌的组成及其致病力[J]. 麦类作物学报,2014,34(2):272-278.
[14]Li H L,Yuan H X,Fu B,et al.First report of Fusarium pseudograminearum causing crown rot of wheat in Henan,China[J]. Plant Disease,2012,96(7):1065.
[15]张 鹏,霍 燕,周淼平,等. 小麦禾谷镰孢菌茎基腐病抗源的筛选与评价[J]. 植物遗传资源学报2009,10(3):431-435.
[16]Wildemuth G B,Mc Namata R B,Quick J S.Crown depth and susceptibility to crown rot in wheat [J]. Euphytica,2001,122(2):397-405. 严 萍,郭斐斐,宋雪飞,等. 京尼平苷对青菜光合反应及生理指标的影响[J]. 江苏农业科学,2016,44(4):193-195,526.
