巨线粒体DNAND6基因克隆及多态性分析
2016-06-14牛宝珍杜民刘艳红白莉艾家灵
牛宝珍+杜民+刘艳红+白莉+艾家灵
摘要:利用GenBank数据库中科鱼线粒体ND6基因序列保守区设计引物,采用PCR技术克隆并测序,共得到12尾巨ND6基因全序列。用DNAMAN 5.0软件比对序列,MEGA 5.0软件分析科不同鱼类的进化关系,结果表明:巨ND6基因序列全长为516 bp,碱基含量分别为14.20%、34.50%、40.20%、11.00%,其中“A+T”含量(54.40%)高于“G+C”含量 (45.50%),存在4个单倍型,发生3次颠换;12个个体4个单倍型间的平均相对遗传距离为0.003;将巨与其他14种鱼类的ND6基因用Neighbore-Joining(NJ)法构建系统发育树,发现巨单独聚为1支。研究将为今后鱼类线粒体基因组的研究提供科学依据。
关键词:巨;线粒体;ND6基因;多态性;系统进化
中图分类号: S917.4
文献标志码: A
文章编号:1002-1302(2016)04-0062-04
巨(Bagarius yarrelli Sykes)是云南省特有鱼类,主要分布于元江、澜沧江、怒江流域,属于鲇形目(Siluriforme)科(Sisoridae)属(Bagarius)。巨个体很大,体质量约 50 kg,全身无鳞,皮肤表面布满细密的微小颗粒物,使其皮肤极为粗糙,此外其体表无黏液,身体背面颜色为灰黄色,腹面为白色,肌肉为黄色,所以又称“黄鱼”[1]。巨为底栖肉食性鱼类,具有口宽、上下颌都有齿带、牙齿呈锥形且排列紧密、鳃耙粗短、胃大、肠短等特点,主要食物为鱼类、虾、泥鳅、水生昆虫[2]。田树魁等通过比较巨、叉尾鲇、斑点叉尾3种鱼肌肉中常规营养成分和氨基酸含量,发现巨肌肉中蛋白质、粗脂肪和必需氨基酸的含量比常规鱼类高,是一种具有较高营养价值的有待驯养开发的野生鱼类[3]。杜民等研究表明,野生巨具有较高的遗传多样性[4]。但是由于地理环境的改变和人为因素的影响,野生可利用的巨资源越来越少。为了保护该鱼类,薛晨江等开展了巨的人工驯养,并取得初步成功[5]。
鱼类线粒体DNA(mitochondrial DNA,mtDNA)是细胞核外(细胞质中)具有转录、自主复制和翻译能力的共价闭合环状双链DNA[6]。鱼类的mtDNA主要包括37个基因(22个tRNA编码基因、13个疏水蛋白基因、2个rRNA基因);其中13个疏水蛋白基因编码的多肽中包含了7个氢化辅酶 Ⅰ (nicotinamide adenine diuncleotide hydrogen,NADH)脱氢酶的亚单位(ND1、ND2、ND3、ND4、ND4L、ND5、ND6)。ND6蛋白编码基因位于L链上,处于细胞色素b与ND4之间的连续区域,是线粒体内膜呼吸链的重要组成成分[7]。在氢化辅酶中,由于ND6基因序列不易发生变异,进化速度一般,且基因片段不长,因此常用来研究物种的遗传多样性、种群之间的亲缘关系以及系统进化关系[8]。方月琴等用复合扩增体系,选择线粒体ND6基因进行种属鉴定,结果表明,该方法可以将13种不同的动物区分开来[9]。也有研究表明,ND6基因与人类疾病帕金森氏症等发生有关[10],ND6基因还被用于研究鸟类的亲缘关系[11],但是大多应用于鱼类群体和亚种间的遗传变异研究[12-13]。对巨的线粒体ND6基因全序列进行检测分析,进而分析巨遗传结构、变异及与其他物种之间的同源差异,可为今后巨鱼种研究提供一定的试验数据与理论依据。
1 材料与方法
1.1 试验材料
本研究采用的12尾巨采自云南省河口县。剪取肌肉组织放于1.5 mL EP管中,贴上对应标签,再加入无水乙醇,于4 ℃保存备用。
1.2 试验方法
1.2.1 基因组DNA的提取及多态性引物筛选 DNA的提取参考Sambrook等的酚/氯仿抽提法[14]。用凝胶成像系统观察、照相记录后,将提取的DNA贮存在-20 ℃冰箱中备用。
根据GenBank数据库中已公布的科巨鱼线粒体基因组ND6基因序列(登录号:NC_021606,JQ026260),用Primer Premier 5软件设计简并引物:上游引物:5′-GCACCTCAGAAKGATATTTGWCCYC-3′;下游引物:3′-TYTAAACAGCCCGAAGCGC MC-5′,在PCR扩增仪上进行扩增,反应体系见表1。
PCR反应条件:94 ℃ 4 min;94 ℃ 30 s,54 ℃ 50 s,72 ℃ 90 s,30个循环;72 ℃延伸6 min;4 ℃保存。PCR产物用1%琼脂糖凝胶在120 V电压下电泳35 min,最后通过凝胶成像系统得到PCR产物条带并照相。
检测后的PCR产物用1.5%琼脂糖凝胶电泳,在紫外分析仪下切下目的片段,用DNA凝胶回收试剂盒(天根生物科技有限公司)进行回收纯化,具体步骤参照回收试剂盒说明书进行。
1.2.2 目的DNA片段的连接与转化 用pMD18-T载体与目的DNA进行连接、转化,具体步骤参照载体连接试剂盒说明书进行,用LB培养基进行扩大养后用M13进行阳性克隆筛选,送交南京金斯瑞科技生物公司测序。
1.3 数据分析
利用DNAMAN 5.0软件将测得的巨线粒体ND6基因部分序列与参照物种ND6基因部分序列进行比对。利用MEGA 5.0软件中的Kimura2-parameter方法计算遗传距离,采用邻接法(Neighbore-Joining,NJ)中的Maximum Composite Likelihood法构建系统发育树,通过自举检验(Bootstrap)获得系统分支的置信度(重复1 000次)。
2 结果与分析
2.1 DNA提取
从巨鱼鳍条或肌肉提取DNA,结果见图1。可以看出,DNA条带清晰。
2.2 引物退火温度的优化
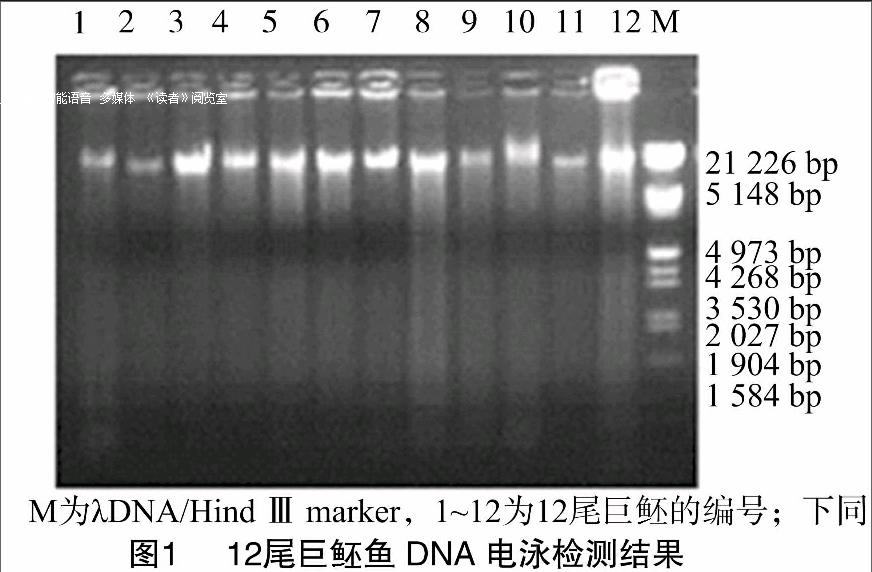
用设计的Bayam18引物退火温度的±10 ℃范围进行梯度PCR(图2),所用marker为BM2000,Bayam18引物的退火温度梯度见表2。由图2可知,Bayam18号引物能扩增出条带的温度为55、55.6、56.4、57.5、59.2、60.7、61.9 ℃,根据条带明亮度,初步确定Bayam18引物最适的退火温度。
2.3 扩增产物与DNA回收
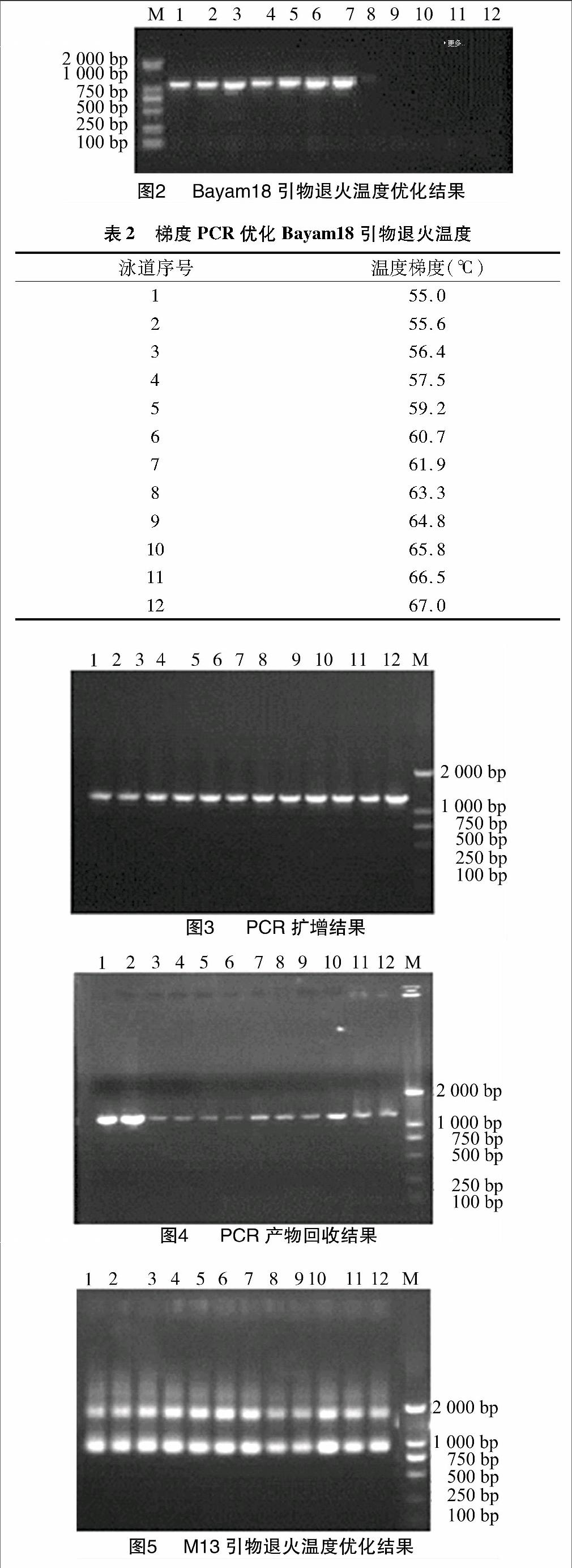
利用凝胶回收试剂盒对PCR产物(图3)进行回收,回收产物(图4)于-20 ℃保存。
2.4 菌液退火温度优化
通过梯度PCR优化M13通用引物的退火温度(图5)。M13通用引物序列见表3,退火温度梯度见表4。由图5可知,M13通用引物在每个泳道都扩增出了明亮条带。
2.5 巨鱼ND6基因序列的碱基含量
本试验中,利用下载序列通过DNAMAN 5.0软件对比排位,得到ND6基因片段长度516 bp,12条序列中发现4个单倍型,其中6号、7号、11号个体序列相同,为1#单倍型;1号、3号、4号、5号、8号、9号、12号个体序列相同,为2#单倍型;10号个体为3#单倍型;2号个体为4#单倍型。采用 MEGA 5.0软件计算它们的碱基组成(表5),可以得出T、C、A、G 4种碱基含量分别为14.10%、34.80%、40.10%、11.00%,其中“A+T”含量( 54.20%)高于“G+C”含量(45.80%)。
2.6 巨鱼ND6基因12个个体的相对遗传距离
用MEGA 5.0软件中的双参数法,通过转换加颠换、转换比颠换分别计算12个个体之间的相对遗传距离[15],详见表6。由表6可知,12个个体的4个单倍型之间的差异(转换加颠换)为0.002~0.004。
2.7 基于ND6基因构建系统发育树
将巨鱼ND6基因与其他14物种(表7)进行比对,用MEGA5.0软件构建系统发育树[16-17],从图6可以看出,系统发育树分为两大支,巨单独聚为1支。
3 讨论与分析
本试验通过从GenBank数据库中查询已公布的科巨线粒体基因组中ND6基因序列保守区设计引物,采用PCR反应扩增、克隆及测序巨ND6基因,共得到12条ND6基因全序列。对巨线粒体ND6基因序列进行研究,得到ND6基因全序列长516 bp。
利用MEGA 5.0软件分析对巨鱼线粒体ND6基因12个个体进行分析,得到T、C、A、G这4种碱基含量分别为14.10%、34.80%、40.10%、11.00%,其中“A+T”含量(54.20%)高于“G+C”含量(45.80%),说明ND6基因序列中富含碱基A、T。共发现4个单倍型,3个变异位点,都为单突变位点,表明ND6基因序列多态性贫乏,序列之间差异不大,这与赖瑞芳等比较鲂属鱼类线粒体基因组,研究鲂属鱼类系统发育的结果[18]是一致的。ND6基因序列共发生3次颠换,表明本研究的4个单倍型的ND6基因核苷酸变异类型以
颠换为主。12个个体的4个单倍型之间平均相对遗传距离为0.003,转换和颠换的比值为0.667,表明这12个个体之间亲缘性近,ND6基因序列变异并不显著,这与于美玲等对科鱼类系统发育关系的研究结果[19]一致。
此外,由系统发育树可知,系统发育树分为两大支,其中巨单独聚成1支,置信值为100%,表明与其他14种科鱼亲缘性远。另一支又分为2支,分别是细尾、长丝黑先聚为1支,黄石爬、黑斑原先聚为1支后,这4个种类进而聚为一个大的分支后与本研究的4个巨聚在一起。大鳍异齿和中华先聚为1支,二者与三线纹胸聚在一起后与中华纹胸聚为1支,再与藏聚在一起,然后与黄斑褶聚为较大的分支。巨单独聚成1支,这与形态学分类结果与基于细胞色素b(Cytochrome b)、rpS7基因研究的遗传进化是一致的[20-21]。本研究通过研究巨鱼ND6基因序列多态性,可为以后研究巨与其他鱼类的亲缘性、系统进化等研究提供科学依据。
参考文献:
[1]田树魁,薛晨江,冷 云,等. 巨的生物学特性初步研究[J]. 水生态学杂志,2009,30(3):115-117.
[2]冷 云,田树魁,刘跃天,等. 巨食性初步研究[J]. 现代农业科技,2011,37(19):329-330.
[3]田树魁,易 勇,薛晨江,等. 野生巨肌肉营养成分测定和分析[J]. 淡水渔业,2009,39(3):73-76.
[4]杜 民,牛宝珍,罗彩艳,等. 巨野生群体遗传多样性的RAPD分析[J]. 淡水渔业,2015,45(1):15-19,24.
[5]薛晨江,张正雄,马建颜,等. 巨人工繁殖初报与胚胎发育观察[J]. 水生态学杂志,2012,33(5):54-56.
[6]吕国庆,李思发. 鱼类线粒体 DNA 多态研究和应用进展[J]. 中国水产科学,1998,5(3):95-104.
[7]陈四海,区又君,李加儿. 鱼类线粒体DNA及其研究进展[J]. 生物技术通报,2011,27(3):13-20.
[8]海 汀,柴志欣,张成福,等. 西藏牦牛mtDNA ND6遗传多样性及系统进化分析[J]. 家畜生态学报,2014,35(11):11-17.
[9]方月琴,顾 准,侯一平. 线粒体基因种属鉴定复合扩增体系[J]. 盐城工学院学报:自然科学版,2012,25(1):19-24.
[10]Piccoli C,Ripoli M,Quarato G,et al. Coexistence of mutations in PINK1 and mitochondrial DNA in early onset Parkinsonism[J]. Journal of Medical Genetics,2008,45(9):596-602.
[11]陈晓芳,王 翔,袁晓东,等. 鸻形目15种鸟类线粒体ND6基因序列差异及其系统进化关系[J]. 动物学报,2003,49(1):61-66.
[12]袁 娟,张其中,罗 芬. 鱼类线粒体DNA及其在分子群体遗传研究中的应用[J]. 生态科学,2008,27(4):272-276.
[13]郭新红,刘少军,刘 巧. 鱼类线粒体DNA研究新进展[J]. 遗传学报,2004,31(9):983-1000.
[14]Sambroo J,Fitch E,Maniatis T. Molecular cloning:a laboratory manual[M]. 2nd ed. New York:Cold Spring Harbor Laboratory Press,1989:1024-1031.
[15]Tamura K,Nei M,Kumar S. Prospects for inferring very large phylogenies by using the neighbor-joining method[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(30):11030-11035.
[16]Saitou N,Nei M. The neighbor-joining method:a new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution,1987,4(4):406-425.
[17]Dopazo J. Estimating errors and confidence intervals for branch lengths in phylogenetic trees by a bootstrap approach[J]. Journal of Molecular Evolution,1994,38(3):300-304.
[18]赖瑞芳,张秀杰,李艳和,等. 鲂属鱼类线粒体基因组的比较及其系统发育分析[J]. 水产学报,2014,38(1):1-14.
[19]于美玲,何舜平.科鱼类系统发育关系分析及其分歧时间估算[J]. 中国科学:生命科学,2012,42(4):277-285.
[20]周 伟,李 旭,杨 颖.中国科群系统发育与地理分布格局研究进展[J]. 动物学研究,2005,26(6):673-679.
[21]李 旭. 中国鲇形目科群鱼类的系统发育及生物地理学分析[D]. 昆明:西南林业大学,2006.徐佳杰,姜 波,朱建一,等. 红毛菜28S rDNA和IGS序列分析及系统发育[J]. 江苏农业科学,2016,44(4):66-69.
