牛血清白蛋白聚集体的分解动力学
2016-06-13李昊一李冬敏马刚商艳丽孙英
李昊一,李冬敏,马刚,商艳丽,孙英
( 河北大学化学与环境科学学院 药物化学与分子诊断教育部重点实验室,河北保定 071002)
牛血清白蛋白聚集体的分解动力学
李昊一,李冬敏,马刚,商艳丽,孙英
( 河北大学化学与环境科学学院 药物化学与分子诊断教育部重点实验室,河北保定071002)
摘要:以牛血清白蛋白(BSA)作为模型蛋白,通过浊度法研究BSA形成的无序蛋白聚集体的分解动力学并揭示其复杂结构细节.实验发现,BSA无序聚集体在碱性条件下分解过程有4个动力学阶段,包括1个快速的分解阶段,2个相对较慢的分解阶段和1个动力学惰性阶段.由此推测BSA聚集体中至少含有4种不同的BSA单体形态.
关键词:蛋白聚集体;牛血清白蛋白;浊度法;动力学
蛋白质聚集是所有蛋白的一种固有性质,在合适的条件下,可以说所有的蛋白都可以发生聚集.在生物制药业,这种聚集对蛋白药物的生产提出巨大的挑战[1-5].它几乎影响到所有的生产步骤的质量控制,如发酵阶段[6]、摇动阶段[7]、冷冻干燥阶段[8]、成型阶段[1]和储藏阶段[9-10].蛋白药物的聚集会降低生产效率,缩短药物保存期,使药物的释放变得复杂[2],更严重的是,这种聚集很可能会使病人产生免疫反应,成为生物制药业最严重的安全隐患[11-13].此外,在生物体内,蛋白聚集还和40多种神经退行性疾病、全身性疾病和非全身性疾病相关[14-15].这些淀粉样疾病包括阿尔茨海默病[16]、帕金森症[17]和Ⅱ型糖尿病[18],它们都和某种特定类型蛋白的聚集相关.
蛋白聚集是一个非常复杂的蛋白自我结合过程,包含多步动力学机制[19].这些步骤包括:1)蛋白单体的解折叠;2)可逆寡聚物的形成;3)成核过程;4)可溶的大分子量的中间态聚集体的形成;5)成熟纤维状或无序聚集体的形成[19].蛋白聚集过程受很多因素影响,如温度、pH、离子强度、震荡和剪切力、冻融和冻干、干燥、有机溶剂、金属离子、压力、疏水表面以及浓度等.不同的外界条件和聚集方式可以诱导形成形貌各异的各种类型聚集体.
虽然蛋白聚集体的形貌各异、大小不同,仍可以大致把它们分为2类:有序蛋白聚集体和无序蛋白聚集体.有序蛋白聚集体主要是淀粉样纤维聚集体,它与如前所述的许多影响人类健康的重大疾病相关[14].有序结构使得这些淀粉样纤维相对而言容易进行结构表征,因此,到目前为止人们已经对它们的结构细节有了很多了解.目前已知,在此类有序蛋白聚集体中,每条纤维都是由多个沿纤维轴纵向延展的β片层构成,β片层中的多肽链和纤维轴垂直,而组成纤维的片层则与纤维轴平行[20].这样的超分子结构在X线衍射分析中约4.8 ×10-10m和 8×10-10~11×10-10m位置上会有特征的衍射峰,它们分别对应于肽链间距离和片层间距离[20-21].相对而言,对于在生物制药过程中经常出现的无序聚集体,人们对它们的结构细节了解甚少.实际上,即便采用先进的固态核磁技术,这种无序聚集体仍是难以表征.
本研究中,笔者拟应用浊度法对无序蛋白聚集体的结构细节进行研究.浊度法是蛋白药物生产过程中为数不多的有效的质量控制技术之一[13],易于表征蛋白聚集体的存在.但是,据笔者所知,浊度法尚没有被用于蛋白聚集体复杂结构的研究.笔者采用浊度法研究牛血清白蛋白(BSA)无序聚集体的分解动力学,并通过动力学分析探讨无序蛋白聚集体中的BSA分子是单一结构还是具有多种不同类型.对于无序聚集体,一般人们会认为在聚集体中所有的BSA分子混乱无序,共同形成一个整体.这种观点看似合理,但是笔者的研究将给出不同的结果.
1材料与方法
1.1材料与仪器
质量分数98%的牛血清蛋白(BSA)从瑞士罗氏公司购得;质量分数99%的氯化钠(NaCl)从美国Sigma-Aldrich公司购得;高纯水通过美国密理博纯水机制备;氢氧化钠(NaOH)购自天津市光复科技发展有限公司,为分析纯;盐酸(HCl)购自北京化工厂,为优级纯;活性炭购自天津市进丰化工有限公司,为分析纯,使用前活化.
德国Implen Nanophotometer紫外可见分光光度计;俄罗斯NT-MDT Solver P47扫描探针显微镜;美国Beckman Coulter DelsaTMNano C粒度分析仪.
1.2BSA的提纯
市售BSA通常含有一定量的脂肪酸杂质,虽然含量各不相同,但是会阻碍BSA聚集,因此必须除去.笔者采取的方法如下[22]:称量BSA 300 mg,加高纯水15 mL,搅拌使其完全溶解后,用0.2 mol/L的HCl调节pH至1.5左右,加入活性炭300 mg吸收杂质,置于冰水浴中磁力搅拌1 h.然后用15 000 r/min速度离心3次,每次10 min.取上清液,确保没有活性炭残留,用0.2 mol/L 的NaOH调节pH 至8.9左右,最后过 0.22 μm的滤膜,得到澄清的且无活性炭的BSA 溶液.用紫外可见分光光度计测定此时的BSA 溶液的质量浓度,约为15 mg/mL,BSA聚集实验待用.
1.3BSA的聚集和聚集体预处理
取上述pH=8.9的BSA 溶液,加入NaCl 促进聚集,使NaCl的最终浓度约为240 mmol/L,62 ℃加热BSA溶液24 h.在孵育过程中,澄清的BSA溶液会逐渐变得浑浊.在24 h聚集过程结束以后,15 000 r/min离心20 min,以去除较大的颗粒获得含BSA纳米级颗粒的胶体溶液体系.
1.4浊度法研究BSA聚集体的分解动力学
基于上述内容,本文将引入Pareto分析法、Hamming距离测度、加权平均算子方法构建智能变电站装配式建筑造价评价模型。
离心处理后的BSA胶体溶液用于BSA聚集体分解过程的研究.取一系列1.5 mL BSA 聚集体溶液,分别加入不同pH值的NaOH溶液0.5 mL.此外,另取1.5 mL BSA 聚集体溶液加0.5 mL高纯水作为对照组.混合均匀后,用德国Implen紫外可见分光光度计测量各溶液在400 nm浊度(浊度用光密度OD表示).采用400 nm进行测量是为了避免蛋白中的色氨酸在280 nm处的吸收干扰.浊度随时间的变化使用多指数函数衰减曲线进行拟合.动力学死时间为1 min,也就是说,在浊度测量之前,需要1 min将BSA聚集体溶液与NaOH混合.笔者报道的pH值为浊度研究的最终pH.整个实验在室温下进行.
1.5原子力显微镜(AFM)研究BSA聚集体形貌
AFM图像通过俄罗斯的NT-MDT Solver P47扫描探针显微镜,采用轻敲模式测得.探针悬臂共振频率为100 kHz,力常数为3 N/m.BSA聚集体样品用高纯水稀释100倍,然后滴在崭新的云母表面.静置5 min后,用去离子水冲洗云母表面,自然风干后测样.
1.6动态光散射(DLS)研究BSA聚集体粒度
BSA聚集体的粒径分布采用美国Beckman Coulter 的DelsaTMNano C particle size analyzer测定.样品放入一次性塑料样品池,室温测量.数据通过仪器内置软件处理.
2结果与讨论
2.1浊度实验概述
在研究BSA聚集体的结构细节时基于如下假设:在合适的环境微扰下,不同状态的BSA分子在聚集体中的分解速率不同.在碱性条件下,监测BSA聚集体分解过程的浊度变化,得到浊度衰减曲线,并对其进行拟合,以揭示不同动力学阶段的存在.每个动力学阶段都代表着不同的BSA分子存在状态,也就是说,BSA聚集体分解的浊度衰减曲线的多指数函数拟合结果,将说明BSA聚集体结构的复杂性.这个思路类似于广泛应用在蛋白质折叠研究里的动力学方法,即蛋白折叠动力学拟合曲线中的不同阶段对应折叠过程中不同的动力学中间体[23-26].聚集体分解研究和蛋白质折叠研究之间最主要的区别是前者笔者使用浊度方法监测蛋白聚集体,后者人们利用光谱技术监测蛋白单体.
2.2制备稳定的BSA聚集体
2.3BSA聚集体的AFM和DLS表征
在动力学实验前,首先需要使用AFM和DLS来表征BSA聚集体.如图2的AFM图像所示,BSA聚集体是形状不同、大小不一的无序聚集体,大小从几十纳米到上百纳米不等.因为AFM不易检测溶液中的聚集体粒径分布情况,通过DLS得到精确地BSA聚集体粒径分布,见图3,从中可以看出BSA聚集体的尺寸为20~100 nm.DLS更适合表征球形颗粒,通过AFM图像可以看出BSA聚集体是不规则形状的,所以在本实验中DLS结果更适合作为BSA聚集体粒径范围的定性分析结果.
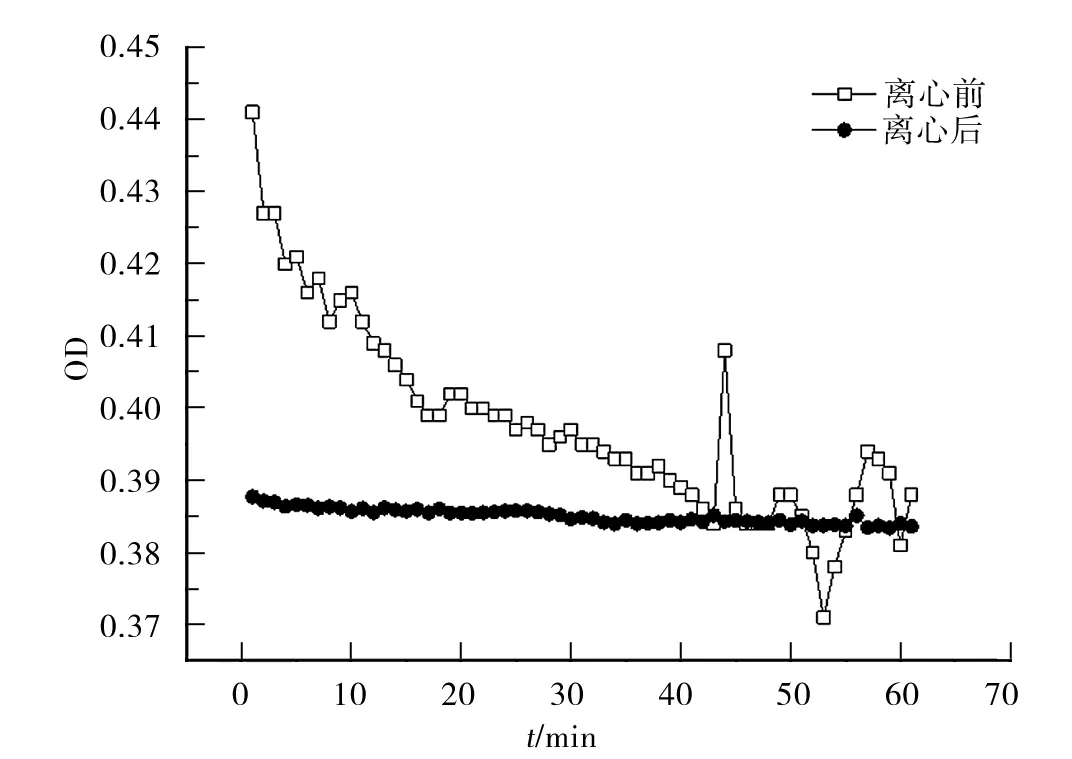
图1 BSA聚集体系统浊度的稳定性(OD) Fig.1 Turbidity stability of BSA aggregate system(OD).
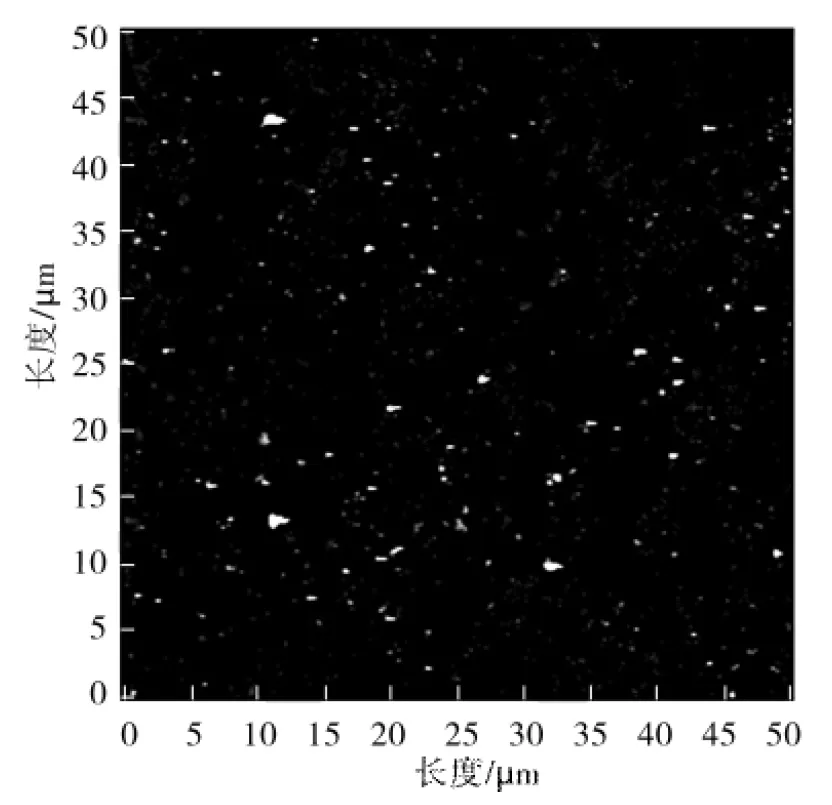
图2 BSA聚集体无序性质的AFM表征Fig.2 AFM characterization of BSA aggregate showing its amorphous nature
2.4BSA聚集体碱性条件下分解的动力学分析
图4展示了基于浊度法分析的不同pH条件下BSA聚集体分解的动力学曲线.从pH=11.6到pH=13.3,研究了7个不同的pH值.显然,碱性条件下BSA聚集体容易分解,分解导致聚集体粒径减小,所以浊度降低.衰减曲线采用多指数方程拟合,如图4所示,各曲线拟合参数列于表1.从图4和表1中可以看出,当pH=11.6,11.8,12.1时,衰减曲线用单指数方程拟合吻合性较好.这就是说,在这些pH条件下只有1种BSA聚集体分子分解.而pH=12.4,12.6,12.9,13.3时,衰减曲线更适合用双指数方程拟合,即在这些pH条件下有2种BSA聚集体分子分解.然而,在上述全部pH条件下,浊度下降到一定程度后都不会再有进一步变化,不会完全消失,这说明BSA聚集体不能全部分解,仍然有一些BSA分子可以很好地抵抗碱性条件并且紧密的结合在一起.综上所述,笔者认为至少有3种BSA分子存在于BSA无序聚集体中.
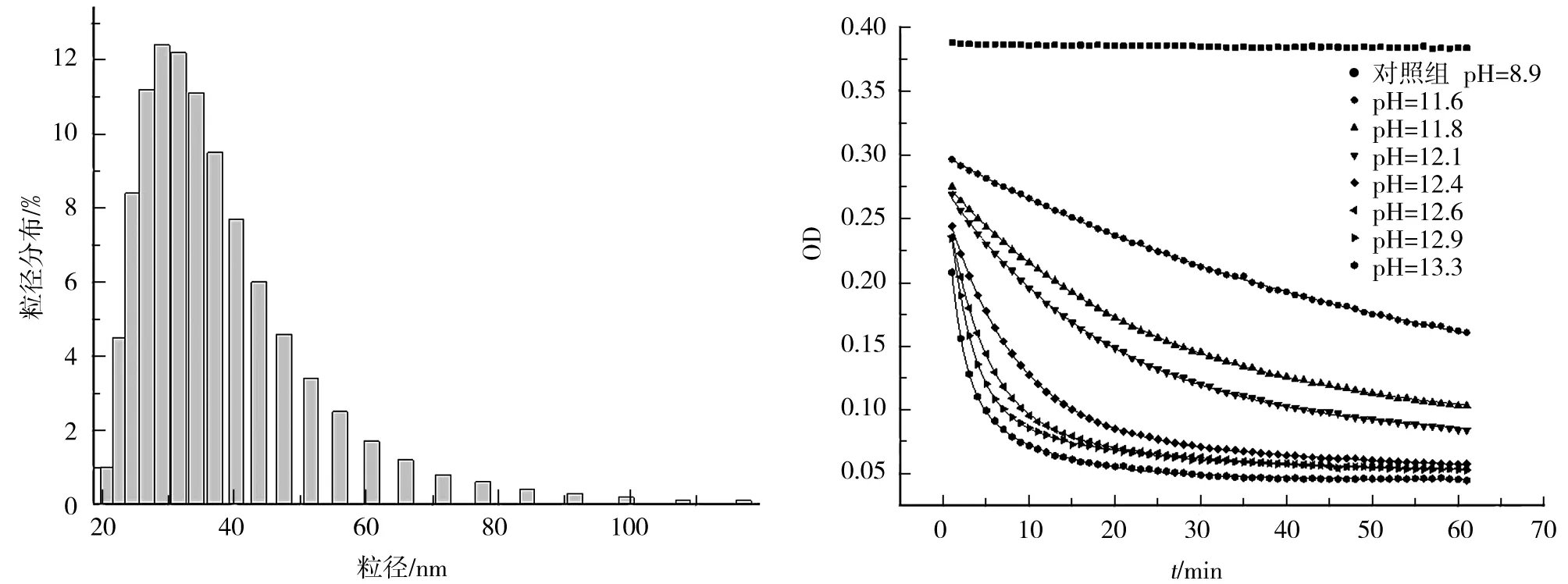
图4 浊度法分析不同pH碱性条件下BSA聚集体的
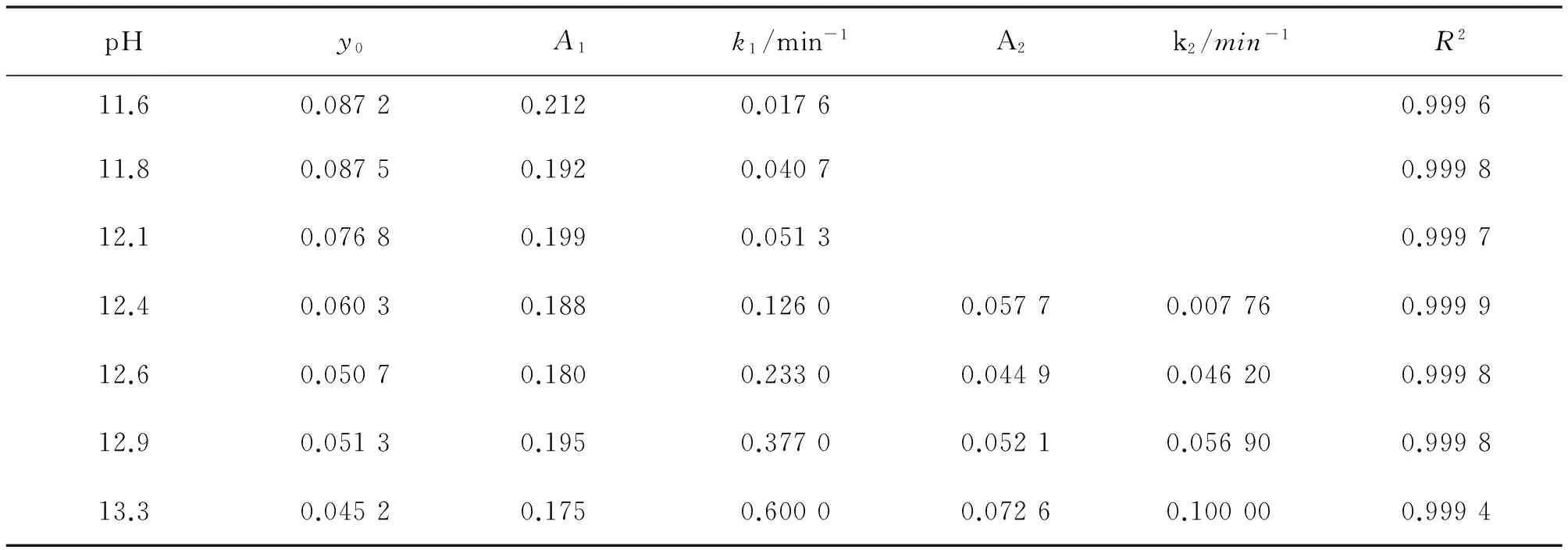
表1 不同pH条件下BSA聚集体分解动力学拟合结果
单指数衰减方程:y=y0+A1exp(-k1t);双指数衰减方程:y=y0+A1exp(-k1t)+A2exp(-k2t),k1和k2为分解速率,t为时间,R2为拟合相关系数.
2.5拟合唯一性的验证
得到上述拟合结果后,需要对其唯一性进行验证.由于任何数学拟合都受到主观性的影响,对于同样一条动力学衰减曲线,可能有几套拟合参数都可以和它很好地吻合.为了避免这种现象的发生,进行了额外的拟合,结果见图5.图5中,使用双指数函数对pH=11.6时的衰减曲线进行拟合,可以看出拟合结果非常好,但拟合参数中的k1和k2是相等的,说明此时曲线使用单指数拟合方式即可.在图6中,用单指数函数对pH=12.6时衰减曲线的拟合唯一性进行验证,拟合曲线明显偏离了实验数据点,所以在pH=12.6时采用双指数函数进行拟合是合适的.
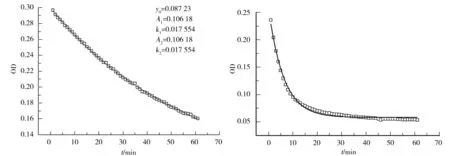
图5pH=11.6时BSA聚集体的分解动力学曲线和其双指数函数拟合
图6pH=12.6时BSA聚集体的分解动力学曲线和其单指数函数拟合
Fig.5Dissociation kinetic curve of BSA aggregate at pH=11.6 and its double-exponential fit
Fig.6Dissociation kinetic curve of BSA aggregate at pH=12.6 and its single-exponential fit
2.6BSA聚集体分解的快速反应阶段
通过详细分析拟合结果,发现BSA聚集体分解过程存在一个快速反应阶段.在蛋白质折叠研究中,快速反应阶段(burst phase)指的是在死时间内(如在反应物快速混和过程中)发生的快速折叠过程[23].在本实验中,快速反应阶段是指在BSA聚集体和NaOH溶液的混合过程这个死时间内发生的快速分解过程.它的大小等于零时刻的浊度真实值和拟合结果外推值之间的差值.在图7中,通过pH=12.4时的分解动力学曲线来说明本实验中快速反应阶段的定义.零时刻真实的OD值实际上应该是用相同体积纯水代替NaOH溶液加入BSA聚集体溶液的对照组中BSA聚集体的OD值,而计算的OD值是通过拟合曲线外推得到的.在图7中,计算得到的OD值为0.266,真实的OD值为0.388.这2个OD值的差值0.122即为快速反应阶段的量值.这说明快速反应阶段就是,在NaOH加入BSA聚集体溶液所需的1 min死时间内,一些BSA分子快速从BSA聚集体中分解的阶段.假设这些快速分解的BSA分子属于第4种BSA分子,位于BSA聚集体的最外层.表2中,列出了在所有pH条件下真实的OD值、推测的OD值和快速反应阶段的量值,从中可以看出在所有pH条件下都能观察到快速反应阶段的存在.
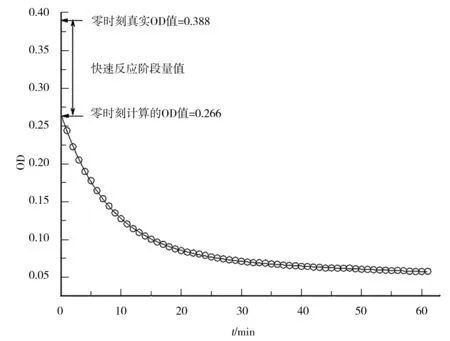
图7 浊度法研究中快速反应阶段的定义Fig.7 Illustration of the definition of burst phase in the turbidity assay
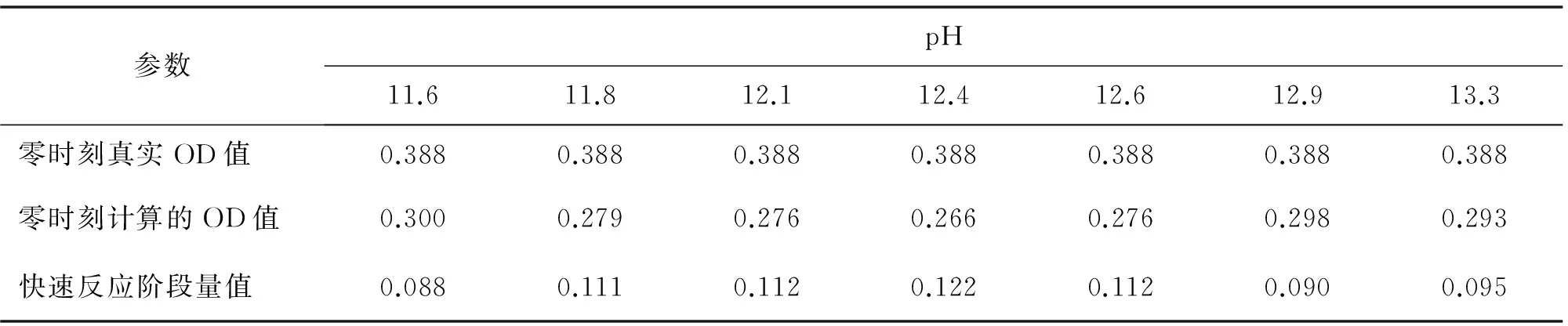
表2 BSA聚集体不同pH条件下零时刻真实的OD值、推测的OD值和快速反应阶段的量值
2.7BSA聚集体中4种不同分子
笔者认为观察到的4个动力学阶段,包括1个快速分解阶段,2个相对较慢的阶段和1个动力学惰性阶段,它们分别对应BSA无序聚集体中的4种分子.由此可能有人对本文的结论有以下几个疑问:第1个疑问是,在蛋白聚集过程中,蛋白质在聚集体表面和内层本质上是不同的.因此,可能会认为,在BSA的分解动力学中,表面和内层的蛋白质应该不同,从而导致至少2个动力学阶段.笔者认为这种假设无法解释观察到的现象.首先,1个分子层的分解不能提供可以产生明显浊度改变的聚集体总体积上的变化.浊度分析无法检测BSA聚集体第1层和第2层分解速率之间的区别.其次,第1个分子层的分解会让之前的第2层成为新的第1层.原则上,这2层分子仍有相同的分解速率.因此,笔者观察到的多重动力学阶段表明BSA聚集体结构的复杂性.第2个疑问是,观察到不同的动力学速率是否对应于不同类型的BSA聚集体的分解,而不是不同类型的BSA分子.笔者的DLS研究可以排除这种可能性.在图8、图9中展示了BSA聚集体在pH=12.1和pH=12.9条件下分解过程的DLS表征.如图所见,分解过程并没有导致BSA聚集体在一个特定的尺寸范围消失或减少,BSA聚集体的粒径分布是整体移动的.
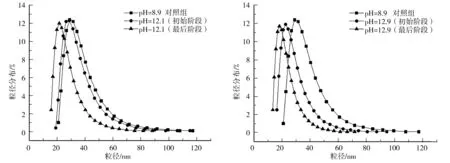
图8 pH=12.1时BSA聚集体分解的DLS表征 图9 pH=12.9时BSA聚集体分解的DLS表征Fig.8 DLS characterization of the dissociation of BSA Fig.9 DLS characterization of the dissociation of BSAaggregate system at pH=12.1 aggregate system at pH=12.9
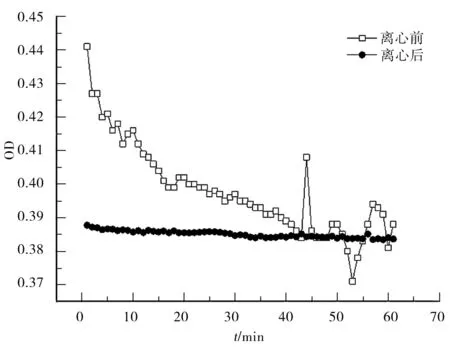
图10 动力学速率(k1)和pH之间的线性相关分析 Fig.10 Linear correlation analysis between kinetic dissociation rate (k1) and pH
2.8与胰岛素纤维聚集体分解的比较
此前,Shammas等人进行过胰岛素有序纤维聚集体在碱性条件下的分解动力学研究[27].笔者要在此讨论一下这2种不同的聚集体在碱性条件下分解特性的不同:第一,在胰岛素有序纤维聚集体系统只有2个动力学阶段,没有观察到快速反应阶段和动力学惰性阶段,在强碱性条件下,胰岛素纤维全部分解.不同的是,笔者发现对于BSA无序聚集体系统来说,分解过程存在4个动力学阶段,包括1个快速反应阶段,而且在强碱性条件下,BSA聚集体不会全部分解,即存在动力学惰性阶段.第二,对于胰岛素纤维,分解速率的对数和pH值之间存在完美的线性关系.这是因为胰岛素纤维中有一个独特的酸性氨基酸对其稳定性产生了决定性的作用.笔者也对BSA聚集体的分解速率和pH值之间的关系进行了研究,结果如图10所示.在图10中,展示了不同pH条件下进行的80次浊度实验的结果.采用动力学速率k1进行线性相关分析,从中可以看出只有一个粗略的线性相关性,并没有一个很好的线性关系,说明有一系列酸性氨基酸都帮助维持BSA聚集体的稳定性.这一现象可以归因于BSA聚集体的无序特性.
3结论
在本文中,用浊度法研究了BSA无序聚集体的分解动力学,发现BSA聚集体在碱性条件下的分解过程有4个动力学阶段,包括1个快速分解阶段,2个相对较慢的分解阶段,和1个动力学惰性阶段.由此推断BSA无序聚集体中至少包含4种不同的单体结构.
参考文献:
[1]FROKJAER S,OTZEN D E.Protein drug stability:a formulation challenge[J].Nat Rev Drug Discovery,2005,4:298-306.DOI:10.1038/nrd1695.
[2]WANG W.Protein aggregation and its inhibition in biopharmaceutics[J].Int J Pharm,2005,289:1-30.DOI:10.1016/j.ijpharm.2004.11.014.
[3]CROMWELL M E,HILARIO E,JACOBSON F.Protein aggregation and bioprocessing[J].AAPS J,2006,8:E572-E579.DOI:10.1208/aapsj080366.
[4]MAHLER H C,FRIESS W,GRAUSCHOPF U,et al.Protein aggregation:pathways,induction factors and analysis[J].J Pharm Sci,2009,98:2909-2934.DOI:10.1002/jps.21566.
[5]冷春生,李庆伟.基因重组药物蛋白类杂质检测及质量控制[J].辽宁师范大学学报(自然科学版),2012,35(4):529-533.
LENG Chunsheng,LI Qingwei.The test and quality control of protein impurity in gene recombination drugs[J].Journal of liaoning Normal University(Natural Science Edition),2012,35(4):529-533.
[6]GEORGIOU G,VALAX P.Isolating inclusion bodies from bacteria[J].Methods Enzymol,1999,309:48.DOI:10.1016/S0076-6879(99)09005-9.
[7]KATAKAM M,BELL L N,BANGA A K.Effect of surfactants on the physical stability of recombinant human growth hormone[J].J Pharm Sci,1995,84:713-716.DOI:10.1002/jps.2600840609.
[8]KREILGAARD L,FROKJAER S,FLINK J M,et al.Effects of additives on the stability of humicola lanuginosa lipase during freeze-drying and storage in the dried solid[J].J Pharm Sci,1999,88:281-290.DOI:10.1021/js980399d.
[9]LIU W R,LANGER R,KLIBANOV A M.Moisture-induced aggregation of lyophilized proteins in the solid state[J].Biotechnol Bioeng,1991,37:177-184.DOI:10.1002/bit.260370210.
[10]COSTANTINO H R,LANGER R,KLIBANOV A M.Moisture-induced aggregation of lyophilized insulin[J].Pharm Res,1994,11:21-29.DOI:10.1023/A:1018981208076.
[11]ROSENBERG A S.Effects of protein aggregates:an immunologic perspective[J].AAPS J,2006,8:E501-E507.DOI:10.1208/aapsj080359.
[12]WANG W,NEMA S,TEAGARDEN D.Protein aggregation-pathways and influencing factors[J].Int J Pharm,2010,390:89-99.DOI:10.1016/j.ijpharm.2010.02.025.
[13]ENGELSMAN J,GARIDEL P,SMULDERS R,et al.Strategies for the assessment of protein aggregates in pharmaceutical biotech product development[J].Pharm Res,2011,28:920-933.DOI:10.1007/s11095-010-0297-1.
[14]CHITI F,DOBSON C M.Protein misfolding,functional amyloid,and human disease[J].Annu Rev Biochem,2006,75:333-366.DOI:10.1146/annurev.biochem.75.101304.123901.
[15]SIPE J D,COHEN A S.Review:History of the amyloid fibril[J].J Struct Biol,2000,130:88-98.DOI:10.1006/jsbi.2000.4221.
[16]张岚,杨延莲,王琛.调节分子对β淀粉样蛋白的聚集调控及细胞毒性抑制效应[J].生物物理学报,2010,26(8):649-661.
ZHANG Lan,YANG Yanlian,WANG Chen.Regulation of aggregation and cytotoxicity ofβ-amyloid by moleculan modulators[J].Acta Biophysica Sinica,2010,26(6):649-661.
[17]金玲,杨慧.α-Synuclein聚集与帕金森病[J].生物化学与生物物理进展,2006,33(4):321-328.
JIN Ling,YANG Hui.α-Synuclein Aggregation and parkinson's disease:factors affecting the aggregation of α-synuclein[J].Prog Biochem Biophys,2006,33(4):321-328.
[18]徐萍,刘超.胰淀素、胰岛淀粉样蛋白沉积与2 型糖尿病[J].医学综述,2005,11(6):500-502.
[19]ROBERTS C J.Non-Native protein aggregation kinetics[J].Biotechnol Bioeng,2007,98:927-938.DOI:10.1002/bit.21627.
[20]SAWAYA M R,SAMBASHIVAN S,NELSON R,et al.Atomic structures of amyloid cross-beta spines reveal varied steric zippers[J].Nature,2007,447:453-457.DOI:10.1038/nature05695.
[21]MARGITTAI M,LANGEN R.Fibrils with parallel in-register structure constitute a major class of amyloid fibrils:molecular insights from electron paramagnetic resonance spectroscopy[J].Q Rev Biophys,2008,41:265-297.DOI:10.1017/S0033583508004733.
[22]CHEN R F.Removal of fatty acids from serum albumin by charcoal treatment[J].J Biol Chem,1967,242:173-181.
[23]RODER H,MAKI K,CHENG H,et al.Rapid mixing methods for exploring the kinetics of protein folding[J].Methods,2004,34:15-27.DOI:10.1016/j.ymeth.2004.03.003.
[24]CHEN Y,DING F,NIE H,et al.Protein folding:then and now[J].Arch Biochem Biophys,2008,469:4-19.DOI:10.1016/j.abb.2007.05.014.
[25]DENTON M E,ROTHWARF D M,SCHERAGA H A.Kinetics of folding of guanidine-denatured hen egg white lysozyme and carboxymethyl[Cys6,Cys127]-lysozyme:a stopped-flow absorbance and fluorescence study[J].Biochemistry,1994,33:11225-11236.DOI:10.1021/bi00203a019.
[26]SASAHARA K,DEMURA M,NITTA K.Equilibrium and kinetic folding of hen egg-white lysozyme under acidic conditions[J].Proteins:Struct,Funct,Bioinf,2002,49:472-482.DOI:10.1002/prot.10215.
[27]SHAMMAS S L,KNOWLES T P,BALDWIN A J,et al.Perturbation of the stability of amyloid fibrils through alteration of electrostatic interactions[J].Biophys J,2011,100:2783-2791.DOI:10.1016/j.bpj.2011.04.039.
(责任编辑:梁俊红)
Structural insights into bovine serum albumin aggregates by a dissociation kinetic investigation
LI Haoyi,LI Dongmin,MA Gang,SHANG Yanli,SUN Ying
(Key Laboratory of Medicinal Chemistry and Molecular Diagnosis of Ministry of Education,College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China)
Abstract:Protein aggregation is not only a common problem in biopharmaceutical industry involving protein drugs,but also a devastating phenomenon closely linked to numerous human diseases.Understanding structural details of protein aggregates is fundamentally important in the prediction and prevention of protein aggregation behavior.In this study,we explore to use a turbidity-based dissociation kinetic assay to tackle the complex nature of protein amorphous aggregates by a model protein,bovine serum albumin(BSA).We observe that the dissociation of BSA aggregates under basic condition consists of four distinct kinetic phases,including a burst phase,two relatively slow phases,and one kinetically inert phase.Such kinetic observation allows us to hypothesize that BSA aggregates consist of at least four different types of BSA monomeric structures at the molecular level.To the best of our knowledge,this is the first turbidity-based investigation with the aim to elucidate the structural heterogeneity of protein amorphous aggregates.
Key words:protein aggregation;bovine serum albumin;turbidity;kinetics
DOI:10.3969/j.issn.1000-1565.2016.01.007
收稿日期:2015-09-14
基金项目:国家自然科学基金资助项目(21075027);教育部科学技术研究重点项目(211014);高等学校博士学科点专项科研基金联合资助课题(20121301110003);河北省自然科学基金资助项目(B2011201082)
通信作者:马刚(1971—),男,北京人,河北大学教授,主要从事与蛋白质和纳米材料相关物理化学研究.
中图分类号:O643
文献标志码:A
文章编号:1000-1565(2016)01-0035-08
第一作者:李昊一(1991—),女,河北廊坊人,河北大学在读硕士研究生.E-mail:haoyi19910324@sina.com.
E-mail:gangma@hbu.edu.cn
