粪菌移植对营养性肥胖大鼠血脂及肠道屏障的影响
2016-06-13郭上齐武华翟春宝程巩蔡景融山西医科大学山西太原0000山西医科大学第一医院普外科山西太原0000山西省人民医院普外科山西太原0000
郭上齐 武华 翟春宝 程巩 蔡景融.山西医科大学,山西太原 0000;2.山西医科大学第一医院普外科,山西太原 0000;.山西省人民医院普外科,山西太原 0000
粪菌移植对营养性肥胖大鼠血脂及肠道屏障的影响
郭上齐1△武华2▲翟春宝3程巩1蔡景融1
1.山西医科大学,山西太原030001;2.山西医科大学第一医院普外科,山西太原030001;3.山西省人民医院普外科,山西太原030001
[摘要]目的观察粪菌移植对营养性肥胖大鼠血脂及肠道屏障的影响。方法将40只雄性SD大鼠,随机分为正常对照组NG,肥胖组HGA、HGB。正常对照组NG喂以普通饲料;肥胖组HGA、HGB喂以高脂、高能饲料,分别饲养6周建立肥胖模型。造模后,HGA组肥胖大鼠通过灌肠移植NG组大鼠的粪菌,HGB组肥胖大鼠、NG组用生理盐水灌肠,每周1次,连续3周。观察实验第6周末和9周末大鼠体重、Lee指数变化。第9周末测大鼠血内毒素、α-肿瘤坏死因子(TNF-α)、血清胆固醇(TC)、甘油三酯(TG)及肝指数。取肝脏行病理学检查。结果高脂饮食喂养6周的大鼠体重明显增加(P<0.05)。第9周末,HGA组Lee指数、肝指数、血清TG、TC、TNF-α及血浆内毒素均明显低于HGB组(P<0.05)。结论粪菌移植能对肥胖大鼠起到减轻内毒素血症、调节血脂,减轻肝脂肪变性的作用。
[关键词]肥胖;粪菌移植;肠道屏障;肠道菌群
△在读硕士研究生▲通讯作者
肥胖在世界各国普遍存在,而且其发病率有逐渐升高的趋势。但到目前为止还没有一种特效的治疗方法。大量的研究表明,肥胖的发生与肠道菌群以及肠道屏障有密切的关系。近年来,粪菌移植(FMT)研究进展迅速并且倍受瞩目。粪菌移植也开始用于多种疾病的治疗,包括治疗胃肠道疾病、代谢疾病、自身免疫性疾病、神经系统疾病等[1]。本研究,我们应用血浆内毒素水平间接了解肠黏膜屏障损伤程度,用血清胆固醇(TC)、甘油三酯(TG)、Lee指数、肝指数(%)评估对营养性肥胖大鼠的影响,对FMT能否改善肥胖进行综合评价,为其临床应用提供依据,现报道如下。
1 资料与方法
1.1动物模型制备和粪菌液制备
取健康雄性SD大鼠40只(清洁级,初断乳,体重70~98 g,饲养于清洁级动物实验室,保持室温20~24℃,相对湿度50%~60%,人工光照时间12时/d),每日上午更换食、水1次,单笼饲养观察1周,能正常饮食者纳入实验用鼠。随机取10只作为正常对照组,喂以普通饲料;余30只用于模型建立,喂以高脂、高能饲料。供给饲料的量为第1、2周内每天每只鼠13 g,以后每周增加2 g,至第6周止。每天的饲料吃完后不再添加。饮水不限。喂养6周后选择体重大于对照组均数20%[3]的18只大鼠作为肥胖大鼠进行实验。高脂饲料(g/100 g)[2]:奶粉10、猪油10、全蛋13、白糖7、普通饲料60、以及浓缩鱼肝油10滴。饲料均为山西医科大学动物中心配制。
新鲜粪菌液制备流程[4,5]:①用灭菌烧杯称取10 g正常大鼠新鲜粪便,加入37℃无菌0.9%NaCl溶液50 mL搅拌,进行初步均质加工;②用双层无菌纱布过滤,以去除未吸收的食物残渣和小颗粒物质,进一步匀质处理;③将再次过滤的样本以6000转/min的速率离心15 min,并将沉淀再悬浮于50 mL 0.9%NaCl溶液中,得无色无味粪菌液。
1.2动物分组
造模后,分别于第7、8、9周HGA组肥胖大鼠通过灌肠移植正常大鼠粪菌液,HGB组肥胖大鼠、NG组正常大鼠用生理盐水灌肠。用手压迫肛门并将大鼠头向下倾斜45°放置1 min以防止回流。每周1次,连续3周。三组饮食不变。
1.3标本采集与制备
1.3.1标本采集第9周末,所有大鼠禁食过夜。麻醉后开腹,使用无热原采血针穿刺门静脉取全血2 mL,低温离心后,吸取上清液,于-20℃保存;门静脉取血后,行腹主动脉穿刺取全血4~5 mL,低温离心后,吸取上清液,于-20℃保存。
1.3.2血脂测定应用全自动生化分析仪,测定血清总胆固醇(TC)、甘油三酯(TG),操作严格按试剂盒说明书进行。
1.3.3血浆内毒素采用鲎试剂偶氮终点显色法测定血浆内毒素浓度,严格按试剂盒说明书进行操作。
1.3.4血浆TNF-α采用双抗体夹心ABC-ELISA法测定血浆TNF-α浓度,严格按试剂盒说明书进行操作。
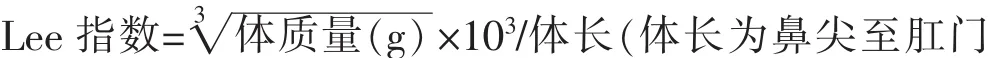
1.3.6病理组织学检查取大鼠右叶肝组织,10%甲醛液固定,病理切片HE染色,判断大鼠肝脏脂肪变性程度,分(-)~(++++)4个等级[6]。
1.4统计学处理
采用SPSS13.0统计学软件进行分析,计量资料以均数±标准差(±s)表示,多组比较用行F检验,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1大鼠一般情况、体质量及肝指数变化
实验期各组大鼠饮食及粪便均正常,未发现呼吸道、消化道疾病及其他疾病。造模期间,与正常对照组大鼠比较,高脂组部分大鼠活动减少。造模后,高脂组大鼠体质量及Lee指数高于NG组,差异具有统计学意义(P<0.05)。第9周末HGA组与HGB组比较,体质量及lee指数下降(P<0.05)。见表1。
表1 各组SD大鼠体质量、Lee指数及肝指数比较(±s)
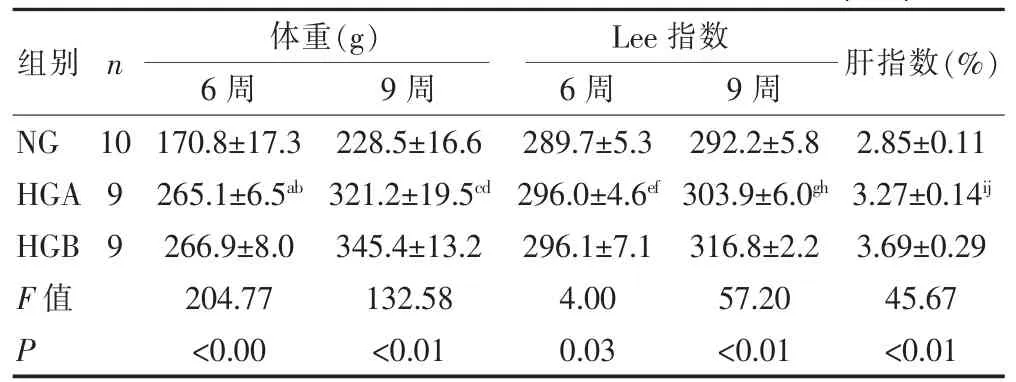
表1 各组SD大鼠体质量、Lee指数及肝指数比较(±s)
注:与HGB比较,t=-1.778,aP=0.755;t=-24.222,cP=0.005;t=-0.111,eP=0.967;t=-12.833,gP=0.000;t=-0.420,iP=0.000;与NG比较,t=94.311,bP=0.000;t=92.722,dP=0.000;t=6.329,fP=0.024;t=11.774,hP=0.000;t= 0.426,jP=0.000
228.5±16.6 321.2±19.5cd345.4±13.2 132.58 <0.01 289.7±5.3 296.0±4.6ef296.1±7.1 4.00 0.03 292.2±5.8 303.9±6.0gh316.8±2.2 57.20 <0.01 2.85±0.11 3.27±0.14ij3.69±0.29 45.67 <0.01肝指数(%)组别n 体重(g)6周 9周Lee指数6周 9周170.8±17.3 265.1±6.5ab266.9±8.0 204.77 <0.00 NG HGA HGB F值P 10 99
2.2对大鼠血脂影响
第9周末,高脂组大鼠TG、TC明显高于NG组,差异有统计学意义(P<0.05)。与HGB组比较,HGA组TG、TC下降(P<0.05)。见表2。
2.3血浆TNF-α变化
第9周末,高脂组大鼠血浆TNF-α水平均高于NG组(P<0.05)。HGA组血浆TNF-α水平低于HGB组(P<0.05)。见表2。
2.4大鼠血浆内毒素变化
第9周末,高脂组大鼠血浆内毒素均高于NG组(P<0.05)。HGA组血浆内毒素水平低于HGB组(P<0.05)。见表2。
2.5形态学观察结果
大鼠肝脏标本HE染色,光镜下观察,NG组正常肝小叶结构,未见肝细胞脂肪变、坏死及炎性细胞浸润。HGA和HGB组均出现程度不同的肝细胞脂肪变性,HGA主要为-~+,未见肝细胞坏死、纤维化及炎症细胞浸润;HGB组主要为+~++,未见肝细胞坏死、炎性细胞浸润及纤维化(封三图2)。
3 讨论
肥胖的形成与人体肠道菌群、免疫反应以及弱炎症反应存在密切关系[7]。
肠道菌群是宿主细胞数量的10倍,又是肠道屏障的重要组成部分,其代谢水平相当于人体肝脏的代谢水平,在胃肠道疾病、代谢疾病、自身免疫性疾病、神经系统疾病中起着重要的作用,被认为是人体又一重要“器官”[8-10]。大部分肠道菌群与宿主相互作用、相互影响,共同维持肠道菌群的平衡。高脂饮食可导致肠道菌群改变,引发肠轴膜中紧密连接蛋白zo-1、occiudin变化,从而促进肠道通透性增加,损害肠轴膜屏障,促进内毒素吸收入血[11]。
表2 各组血TC、TG、TNF-α及内毒素指标比较(±s,n=10)
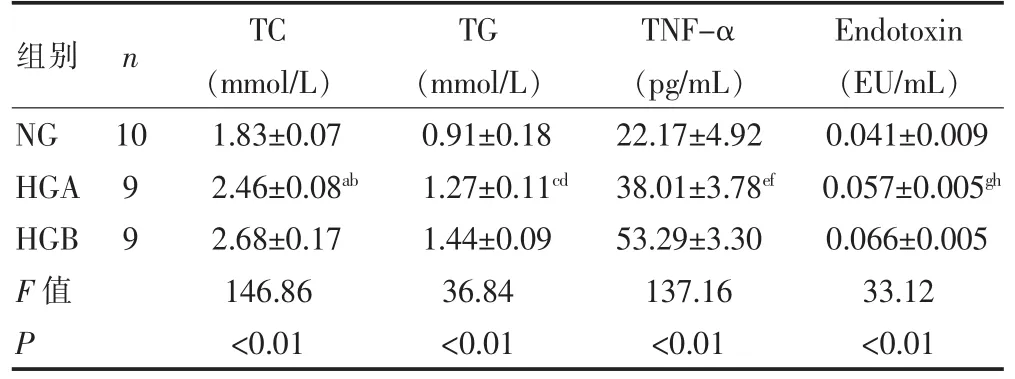
表2 各组血TC、TG、TNF-α及内毒素指标比较(±s,n=10)
注:与HGB比较,t=-0.222,aP=0.000;t=-0.173,cP=0.014;t=-15.281,eP=0.000;t=-0.008,gP=0.011;与NG比较,t=0.629,bP=0.000;t=0.362,dP=0.000;t=15.841,fP=0.000;t=0.016,hP=0.000
组别 n TCTGTNF-αEndotoxin (mmol/L) (mmol/L) (pg/mL) (EU/mL)NG101.83±0.070.91±0.1822.17±4.920.041±0.009 HGA92.46±0.08ab1.27±0.11cd38.01±3.78ef0.057±0.005ghHGB92.68±0.171.44±0.0953.29±3.300.066±0.005 F值146.8636.84137.1633.12 P <0.01<0.01<0.01<0.01
肠道菌群产生的内毒素在肥胖及代谢紊乱过程中发挥重要作用。研究发现,葛兰阴性菌的产物内毒素是代谢性疾病的早期触发因素,并且起到级联放大作用[12]。内毒素通过LPS/CD14信号通路引发慢性炎症反应,导致肥胖及胰岛素抵抗。另外,内毒素能够诱导巨噬细胞M1亚型,使其聚集到凋亡脂肪细胞及肝细胞,释放促炎因子[13]。Cani[14]发现,高脂肪喂养4周的小鼠血浆内毒素浓度升高了2~3倍,血浆中内毒素浓度的增加与肠道菌群的变化(革兰阴性菌与革兰阳性菌在高脂肪喂养时比例增加)密切相关。之后又有学者发现,抗生素治疗能够降低高脂喂养小鼠肠道革兰氏阴性菌比例及肠道血浆内毒素水平,并且能够改善糖耐量,减少体重增加[15,16]。
且肥胖动物体内过多产生的炎性因子如TNF-α,IL-1β,IL-6以及MCP-1能够加重慢性炎症和胰岛素抵抗[17]。TNF-α能够降低胰岛素的敏感性,具有促炎作用[18]。而胰岛素抵抗是肥胖和二型糖尿病发病机制的一个共同特征。任瑞珍等利用放射免疫法检测70例2型糖尿病患者和60例健康对照者空腹血清胰岛素、TNF-α水平,发现2型糖尿病患者TNF-α高于正常者且与胰岛素抵抗指数呈正相关[19]。
综上所述,如何改善肠道菌群结构是防治肥胖的关键环节之一。我国最早应用粪菌移植治疗疾病,早在1700年前,葛洪[20]就将其应用于腹泻患者。发表于新英格兰医学杂志的一项大型随机、对照试验证实,FMT治疗难治性C.difficile的作用[21]。本研究发现,高脂饮食诱导的肥胖大鼠与正常大鼠相比,血浆内毒素和TNF-α均明显增高。经FMT治疗后,血内毒素明显下降,TNF-α水平也显著下降,提示FMT能够纠正肠道微生态,增强肠道屏障功能,降低血内毒素及炎症因子水平。FMT增强肠道屏障功能以及治疗肥胖的具体机制仍需进一步研究,但这也可能为今后肥胖以及代谢综合征的治疗提供一种新的治疗途径。不过,实验中FMT并未能将肥胖体重、血脂以及血浆内毒素完全降至正常水平,这也提示我们,改善生活习惯,合理饮食、积极锻炼仍是十分必要的减肥方法。
[参考文献]
[1]Borody TJ,paramsothy S,Agrawal G.Fecal microbiota transplantation:Indications,methods,evidence,andfuturedirections[J].Curr Gastroenterol Rep,2013,15(8):337.
[2]廖丽萍,张祥捷.高脂饮食诱导的肥胖大鼠空腹及餐后胃促生长素水平与胰岛素抵抗的关系[J].中华内分泌代谢杂志,2013,29(11):991-992
[3]朱惠莲,许月初,蒋卓勤,等.丙酮酸对肥胖大鼠体重和脂肪代谢的影响[J].营养学报,2002,24(3):229-232.
[4]杨云生,王子恺.粪菌移植的研究进展[J].胃肠病学,2014,19(1):1-5.
[5]倪小冬,李幼生,张永良,等.PE途径行粪菌移植加肠内营养治疗复发性溃疡性结肠炎[J].肠外与肠内营养,2015,22(1):29-33.
[6]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南[J].中华肝脏病杂志,2006,14(3):161-163.
[7]韦腾飞,唐古生,沈茜.瘦素系统对调节性T淋巴细胞分化增殖和功能的影响[J].国际免疫学杂志,2013,36(2):97-100.
[8]Xu J,Gordon JI.Honor thy symbionts[J].Proc Natl Acad Sci USA,2003,100(18):10452-10459.
[9]Gill SR,Pop M,Deboy RT,et al.Metagenomic analysis of the human distal gut microbiome[J].Science,2006,312 (5778):1355-1359.
[10]黎介寿.首选肠内营养的合理性[J].肠外与肠内营养,2013,20(6):321-323.
[11]Cani PD,Bibiloni R,Knauf C,et al.Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice[J].Diabetes,2008,57(6):1470-1481.
[12]Hotamisligil GS.Inflammation and metabolic disorders[J]. Nature,2006,444(7121):860-867.
[13]Caesar R.Gut-derived lipopolysaccharide augments adipose macrophage accumulation but is not essential for impaired glucose or insulin tolerance in mice.Gut,2012,61(12),1701-1707.
[14]Schwiertz A,Taras D,Schafer K,et al.Microbiota and SCFA in lean and overweight healthy subjects[J].Obesity,2010,18(1):190-195.
[15]Turnbaugh PJ,Hamady M,Yatsunenko T,et al.A core gut microbiome in obese and lean twins[J].Nature,2009,457(7228):480-484.
[16]Armougom F,Henry M,Vialettes B,et al.Monitoring bacterial community of human gut microbiota reveals an increaseinLactobacillusinobesepatientsand Methanogens in anorexic patients[J].PLoS One,2009,4 (9):e7125.
[17]Qatanani M,Lazar MA.Mechanisms of obesity-associated insulin resistance:many choices on the menu[J].Genes Dev,2007,21(12):1443-1455.
[18]Hui JM,Hodge A,Farrell GC,et al.Beyond insulin resistance in NASH:TNF-α or adiponectin[J].Hepatology,2004,40(1):46-54.
[19]任瑞珍,陈国瑞,蔡俊峰,等.肿瘤坏死因子α基因多态性与2型糖尿病胰岛素抵抗的相关性[J].中华内分泌代谢杂志,2003,19(4):271-274.
[20]Zhang FM,Luo WS,Shi Y,et al.Should we standardize the 1,700-year-old fecal microbiota transplantation?[J]. Am J Gastroenterol,2012,107(11):1755.
[21]Borody TJ,Khoruts A.Fecal microbiota transplantation and emerging applications[J].Nat Rev Gastroenterol Hepatol,2012,9:88-96.
·内科医学·
Effects of fecal microbiota transplantation on lipidemia and gut barrier in diet-induced obesity rats
GUO Shangqi1WU Hua2ZHAI Chunbao3CHENG Gong1CAI Jingrong1
1.Shanxi Medical University,Taiyuan030001,China;2.Department of General Surgery,the First Hospital of Shanxi Medical University,Taiyuan030001,China;3.Department of General Surgery,Shanxi Province People's Hospital,Taiyuan030001,China
[Abstract]Objective To explore the influence of fecal microbiota transplantation(FMT)on lipidemia and gut barrier in rats with diet-induced obesity.Methods Forty SD male rats were randomly divided into three groups:normal control group(NG group;fed a normal diet for 6 weeks),two high-fat diet groups(HGA and HGB groups;fed a high-fat diet for 6 weeks).HGA group recieved fecal microbiota transplantation;The rats in NG and HGB group were given normal saline enema,once a week,continuous enema administration for 3 weeks.Changes in the body weight and Lee index were measured at the end of the sixth-and ninth-week.At the end of ninth-week,the concentration of endotoxin, TNF-α,TC and TG in blood were detected.Liver index were measured and the liver tissue samples were collected for pathology examination.Results The body weight of high-fat group significantly increased in the during the modeling (P<0.05).Compared with the HGB group,Lee index,liver index,the concentration of endotoxin,TNF-α,TC and TG in blood of rats in HGA group remarkably decreased at the end of the ninth-week.Conclusion FMT could ease endotoxemia,decrease liver steatosis gradings and lipidemia.
[Key words]Diet-induced obesity;Fecal microbiota transplantation;Gut barrier;Gut microbiota
[中图分类号]R574.4
[文献标识码]A
[文章编号]1673-9701(2016)04-0025-03
收稿日期:(2015-11-20)
