一株野生香菇的鉴定及菌丝最佳生长条件研究
2016-06-12袁思明房丽丽李翠新
袁思明,房丽丽,何 德,李翠新
(西南林业大学 生命科学学院,云南 昆明 650224)
一株野生香菇的鉴定及菌丝最佳生长条件研究
袁思明,房丽丽,何德*,李翠新*
(西南林业大学 生命科学学院,云南 昆明 650224)
摘要:为了对采集的一株野生香菇进行准确鉴定,实验采取了rDNA ITS序列分析以及形态鉴定的方法,研究结果表明该菌株就是香菇.实验对其菌丝的最佳生长条件进行了研究,结果表明其菌丝生长的最适碳源为麦芽糖,最适氮源为牛肉膏,最适碳氮比为30∶1,最适pH为5~6,硫酸镁能够促进菌丝的生长.
关键词:香菇;鉴定;碳源;氮源

图1 采自云县的野生香菇Fig.1 The wild Lentinula edodes collected from Yunxian
香菇(Lentinulaedodes)又名香菌俗称中国蘑菇,被人们誉为“菇中皇后”[1],是驰名中外的食用菌和药用菌,其人工栽培仅次于双孢菇[2].香菇清香可口,别有风味,深受人们的喜爱.香菇不仅含有丰富的维生素和氨基酸,而且还具有良好的保健功能,如抗肿瘤、增强免疫力、降血脂、抗血栓、保肝[3]、健胃、预防佝偻病和预防现代“文明病”[4]等.野生香菇主要分布在华南、华中、西南地区,人工栽培遍布全国[5].野生香菇除了具有浓郁的香味和脆嫩的质地,还具有很强的抗逆性,因此可以作为培养香菇优良品种的杂交亲本[6],合理开发和利用这些资源将是提高香菇育种水平的前提和保障,因此分离、保藏野生香菇菌株具有十分重要的意义[7-10].云南省地处低纬,干湿分明,气候宜人,为野生食用菌的生长提供了优质的气候环境[11],该地区的野生香菇资源丰富,香味浓郁,深受消费者喜欢.因此本文将研究野生香菇菌丝体的生物学特性,以期为香菇的生产和基础研究提供依据.
1材料和方法
1.1供试菌种
对2014年5月采自云南省云县的野生香菇(如图1所示)的一株进行了菌种分离培养.
1.2香菇的DNA提取及ITS分子鉴定
1.2.1基因组DNA的提取将分离得到的野生香菇菌种接到PDA斜面培养基上,26℃培养7~10 d,然后接种于液体培养基中,室温静置培养一个月后用滤纸收集香菇的菌丝体,吸水纸吸干.取适量菌丝体用液氮充分研磨后快速盛入1.5 ml的Eppendorf管中,加入750 μL的预热CTAB(2%)提取缓冲液,振荡混匀后加入5 μL的β-巯基乙醇,65℃水浴1 h后12 000 r/min离心20 min.取上清液加入等体积的苯酚、氯仿、异戊醇混合液(体积比为25∶24∶1)充分混匀,慢慢摇晃1 h后12 000 r/min离心20 min.取上清液转管至新的1.5 mL的Eppendorf管中,加入等体积的氯仿、异戊醇混合液(体积比为24∶1)慢慢摇晃1 h后12 000 r/min离心20 min.取上清液转管,加入2/3体积预冷的异丙醇置于-20℃冰箱30 min,8 000 r/min离心5 min.弃上清液,沉淀用75%的乙醇洗涤2~3次,晾干加入30 μL TE溶液充分溶解,然后用1.0%的琼脂糖凝胶检测DNA样品的浓度和质量,DNA样品置于-20℃保存备用.
1.2.2ITS-PCR扩增利用真菌通用引物ITS1(TCCGTAGGTGAACCTGCG)和ITS4(TCCTCCGCTTATTGATATGC)对香菇菌种进行ITS-PCR扩增,反应体系为35 μL,包括:2×HiFiTaqPCRStarMix17.5 μL、引物ITS1(10 μM)和ITS4(10 μM)各0.7 μL、DNA模板1 μL,用去离子水将体积补至35 μL.ITS-PCR反应程序为:94℃预变性2 min,94℃变性1 min,55℃退火1 min,72℃延伸1 min,34个循环,72℃延伸8 min,4℃保存.扩增得到的PCR产物经1.0%琼脂糖凝胶电泳检测扩增结果,对合格的产物送至北京六合华大基因科技股份有限公司进行测序.
1.3野生香菇的菌丝生长条件试验
基础培养基配方:葡萄糖20 g、蛋白胨2 g、硫酸镁0.15 g、磷酸二氢钾0.15 g、磷酸氢二钾0.15 g、琼脂15 g、水1 000 mL、pH自然.
1.3.1碳源试验供试碳源:葡萄糖、果糖、蔗糖、麦芽糖、淀粉.分别以20 g的果糖、蔗糖、麦芽糖、淀粉代替基础培养基中的葡萄糖,配置成不同的碳源培养基,按常规方法灭菌、倒平板,用内径5 mm的打孔器在活化平板培养基的同一半径处打孔,接种到每一供试平板的中央,每一碳源设置3个重复,置于25℃恒温培养箱中连续培养11 d,第三天开始每隔两天利用十字交叉法测一次菌落的直径,并且观察菌落形态、菌丝的长势.菌丝的生长速度用(mm/d)表示.菌丝生长浓密、粗壮用“+++”表示,生长较为浓密用“++”表示,菌丝稀疏细弱用“+”表示,不生长用“-”表示.
1.3.2氮源试验供试氮源:硝酸铵、硫酸铵、牛肉膏、蛋白胨、尿素.以等量的硝酸铵、硫酸铵、牛肉膏、尿素代替基础培养基中的蛋白胨,配置成不同氮源的培养基,其余操作同1.3.1.
1.3.3无机盐试验在每升基础培养基中分别加入1 g氯化钙、氯化钠、硫酸镁、磷酸二氢钾、硫酸亚铁,其余操作同1.3.1.
1.3.4pH值试验用10%的氢氧化钠和10%的盐酸在灭菌前将基础培养基的pH值调为5、6、7、8、9共5个梯度,其余操作同1.3.1.
1.3.5碳氮比试验以葡萄糖为碳源,以蛋白胨为氮源,以20 g葡萄糖为标准,配制成碳氮比分别为10∶1、20∶1、30∶1、40∶1、50∶1共5种配方,其余操作同1.3.1.
1.3.6菌丝生长速度的测定菌丝平均生长速度(mm/d)=所测得三个菌落半径的平均值/生长的天数.
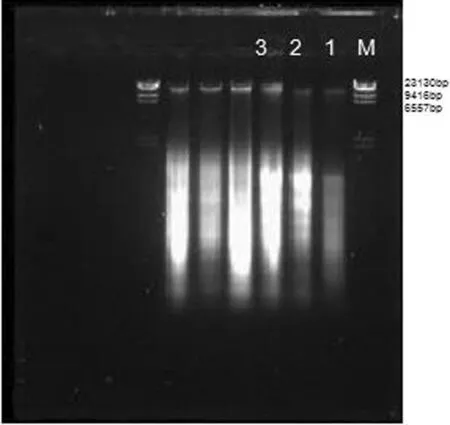
图2 野生香菇DNA提取结果Fig.2 Results of DNA extraction from wild Lentinula edodes注:M:λ-Hind Ⅲ diges DNA marker
2结果与分析
2.1形态鉴定结果
所采集的野生香菇子实体中等大,菌盖表面平整,呈扁平或者稍扁平,周围为浅褐色,中部为黄褐色,相比于人工栽培的菌肉肥厚香菇而言,其菌盖较薄,表面无鳞片,边缘不内卷;菌柄褐色,中生,弯曲,肉质,相比于人工栽培的香菇,其菌柄较细长;菌褶弯生不等长,白色肉质,密集;菌肉白色厚实,具有特殊的香味,从形态上初步鉴定为野生香菇.
2.2DNA的提取
野生香菇菌株的DNA提取结果如图2中的1、2、3.得到的野生香菇菌株DNA大小在23 130 bp附近,电泳图中,DNA条带清晰,DNA的浓度、纯度以及产率都比较高,可用于PCR扩增.
2.3野生香菇的ITS-PCR扩增和测序结果
利用真菌通用引物ITS1和ITS4对野生香菇菌株进行了ITS-PCR扩增,扩增产物经1%琼脂糖凝胶电泳检测,检测结果如图3.测序结果rDNA ITS区段长度为740 bp.所得序列进行Blast搜索,Blast结果击中(hit)均为香菇(如图4),序列相似性为96%,E value(期望值)为0,主要击中香菇菌株SB104、 香菇菌株GAN046-IAMHAU、香菇菌株TMI1546、香菇菌株YUN102-IAMHAU、香菇菌株50784-ACCC、香菇菌株STCL149.Landeweert等[5]认为ITS序列经比对,序列相似性≥99%,属于相同种;序列相似性大于95%,小于99%,属于相同属;序列相似性≤95%,属于相同科.因此ITS分子分析结合上面形态上的鉴定,表明分离得到的野生菌株是香菇.
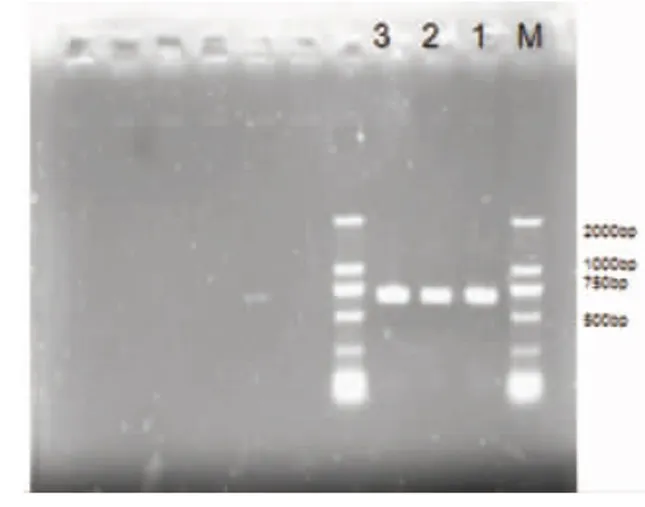
图3 野生香菇rDNA ITS区段的PCR产物 图4 野生香菇ITS序列BLAST结果Fig.3 PCR product of rDNA ITS of wild Lentinula edodes注:M:Direct-Load TM star marker
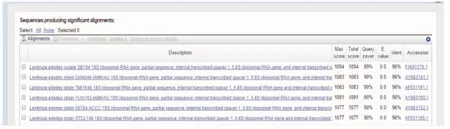
图4 野生香菇ITS序列BLAST结果Fig.4 The BLAST results of rDNA ITS sequence

图5 在不同碳源中菌丝生长曲线Fig.5 The growth curve of mycelial in different carbon source

图6 不同氮源下菌丝的生长曲线Fig.6 The growth curve of mycelial in different nitrogen source
2.4不同的碳源对香菇菌丝生长的影响
碳源对香菇菌丝生长的影响见下表1,生长曲线见下图5.从表1可知,供试的5种碳源均可以作为野生香菇菌丝生长的碳源,但在以蔗糖为碳源的培养基上菌丝的长势明显低于其他几种碳源,结合菌丝在不同碳源下的生长曲线,可以看出野生香菇在以麦芽糖和葡萄糖为碳源的培养基上生长势最好.
表1碳源对野生香菇菌丝生长的影响
Tab.1Effects of carbon sources on mycelial growth of wildLentinulaedodes

碳源平均生长速度/(mm·d-1)菌落形态菌落颜色菌丝生长势蔗糖1.20不规则圆形灰白+葡萄糖2.73规则圆形洁白+++麦芽糖2.82规则圆形洁白+++淀粉2.48规则圆形洁白++果糖2.46规则圆形洁白+++
2.5不同氮源对香菇菌丝生长的影响
不同氮源对野生香菇菌丝生长的影响见下表2,菌丝在不同氮源下的生长曲线如图6,从表2和图6可以看出,香菇菌丝在以尿素为氮源的培养基上不生长,在以硝酸铵、硫酸铵、蛋白胨、牛肉膏为氮源的培养基上都能生长,总体看来菌丝在有机氮上比在无机氮上生长更好,其中在牛肉膏上生长最好,菌丝浓密、粗壮.
表2氮源对野生香菇菌丝生长的影响
Tab. 2Effects of nitrogen sources on mycelial growth of wildLentinulaedodes
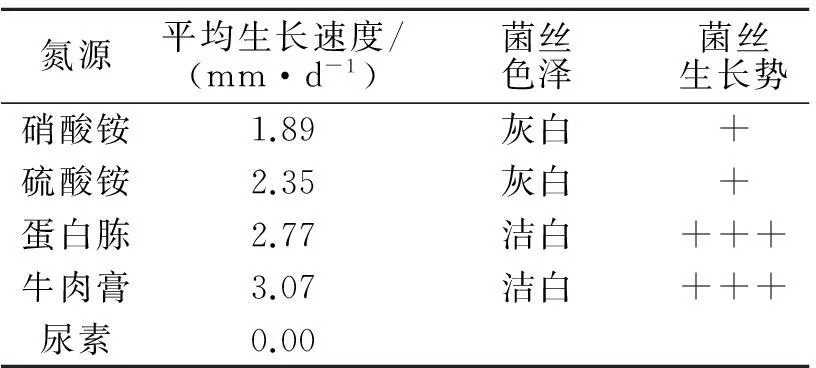
氮源平均生长速度/(mm·d-1)菌丝色泽菌丝生长势硝酸铵1.89灰白+硫酸铵2.35灰白+蛋白胨2.77洁白+++牛肉膏3.07洁白+++尿素0.00
2.6无机盐对野生香菇菌丝生长的影响
无机盐对野生香菇菌丝生长的影响见下表3,从表3可以看出除了硫酸亚铁降低了菌丝的生长速度以外,其余几种无机盐均不同程度的促进了菌丝的生长,其中硫酸镁效果最明显.
2.7不同pH值对香菇菌丝生长的影响
野生香菇菌丝在不同pH值下的平均生长速度见下图7,野生香菇菌丝在pH值为5~9中均能生长,在pH值为6时生长最好,菌丝浓密,但是菌落不规则,pH为7~9时菌丝生长速度逐渐下降,总体来说在偏酸性环境中生长的更好.
表3无机盐对野生香菇菌丝生长的影响
Tab.3Effects of mineral salt on mycelial growth of wildLentinulaedodes

无机盐平均生长速度/(mm·d-1)菌落形态菌丝色泽菌丝生长势氯化钙2.82不规则圆形洁白+氯化钠2.75不规则圆形灰白++硫酸亚铁0.98不规则圆形灰白+磷酸二氢钾2.38规则圆形洁白+++硫酸镁2.94规则圆形洁白+++

图7 pH值对野生香菇菌丝生长速度的影响Effects of pH value on mycelial growth of wild Lentinula edodes
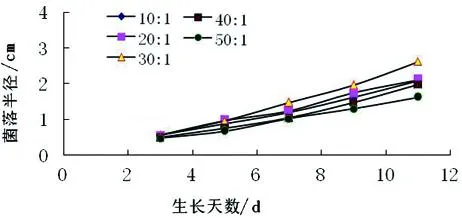
图8 在不同碳氮比下菌丝生长曲线Fig.8 The growth curve of mycelial indifferent C/N ratio
2.8碳氮比的影响
碳氮比对香菇菌丝生长的影响见下表4,不同碳氮比下的生长曲线见下图8,从表4和图8可以看出在供试的五种碳氮比中,菌丝都能够生长.所有菌落均表现出规则圆形,生长速度最快的是30∶1,从30∶1到50∶1随着碳氮比的增加,菌丝生长速度逐渐减慢,说明氮源过低不利于菌丝的生长.
表4不同碳氮比对野生香菇菌丝生长的影响
Tab. 4Effects of carbon-nitrogen ratio on mycelial growth of wildLentinulaedodes

碳氮比菌丝平均生长速度/(mm·d-1)菌丝色泽菌丝生长势10∶11.91洁白++20∶11.93洁白++30∶12.39洁白+++40∶11.80灰白+50∶11.48灰白+
3结论与讨论
在云南省云县采集的一株野生菌株通过形态鉴定和分子生物学技术可以确定该菌株就是香菇.对该野生香菇进行了菌丝生长条件的研究,该实验表明,该野生香菇菌丝生长的最适碳氮源分别为麦芽糖和牛肉膏,菌丝不但生长快,而且色泽洁白菌丝浓密,长势旺盛.菌丝在pH值为5~9中均能生长,在pH为6时菌丝生长最快,菌丝生长浓密.无机盐对香菇菌丝的生长有一定的促进作用,特别是硫酸镁和氯化钠.菌丝在C/N为10∶1~50∶1的范围内均可以生长,但以C/N为30∶1时菌丝生长最快,菌丝浓密粗壮、长势旺盛.我国地域广阔,生态环境多样,香菇种质资源十分丰富,在香菇育种中应更多地引进我国丰富的野生香菇种质资源[10].在香菇生产的三大要素(菌种、培养料、栽培管理)中,菌种是最重要的基础生产资料,是影响香菇产量和质量的关键要素[11],了解野生香菇的生物学特性将为香菇的生产栽培提供依据.
参考文献:
[1]杨瑞长,乔卫亚,关斯明.中国香菇栽培新技术[M].北京:金盾出版社,1998:2-5.
[2]胡菲.香菇栽培技术[J].现代农业科技,2011(8):120-125.
[3]薛艳蓉,梁茂文,王呈,等.香菇的价值及系列食品的生产工艺[J].甘肃农业科技,2011(10):44-47.
[4]李月梅.香菇产业具有良好的发展前景[J].食品科学,2005,26(7):261-266.
[5]刘春如.香菇的分布概况及生物学特性[J].中国林副特产,2001(4):32-33.
[6]陈忠纯.野生香菇人工栽培试验[J].浙江食用菌,1995(5):1-2.
[7]Landeweert R,Leeflang P,Kuyper T W,et al. Molecular identification of ectomycorrhizal mycelium in soil horizons[J].Applied and Environmental Microbiology,2003,69(1):327-333.
[8]金昌福.不同烘干方法的香菇干燥品质的影响[J].延边大学农学学报,2013,35(4):348-351.
[9]鲁永新,田候明,杨海抒,等.云南省野生食用菌气候生境特征与评价[J].中国生态农业学学报,2015,23(6):748-757.
[10]潘迎捷,谭琦,陈明杰,等.香菇遗传研究和菌种选育的现状及发展[J].食用菌学报,1998,5(3):59-64.
[11]朱朝辉,潘迎捷.中国主要香菇栽培菌种交配型基因的遗传学分析[J].食用茵学报,2000,7(3):1-5.
责任编辑:高山
Identification of a Strain of WildLentinulaedodesand Study on the Optimum Growth Conditions of its Mycelium
YUAN Siming,FANG Lili,HE De*,LI Cuixin*
(College of Life Science,South West Forestry University,Kunming 650224,China)
Abstract:n order to identify a strain of wild Lentinula edodes exactly,we conducted some experiments using its rDNA ITS sequences analysis and morphological identification.The results indicated that this wild strain is Lentinula edodes.Some studies on the optimum growth rate of its mycelium in this paper showed that the best carbon source was maltose,the optimum nitrogen source was beef extract,the optimum C/N was 30∶1,the optimum pH value range was 5 to 6,and magnesium sulfate could promote the growth of its mycelium.
Key words:Lentinula edodes;identification;carbon source;nitrogen source
收稿日期:2016-01-18.
基金项目:云南省优势特色重点学科生物学建设项目(50097505);云南省应用基础研究计划项目基金(2011FZ141);云南省高校林下生物资源保护及利用科技创新团队(51400605);西南林业大学科研启动基金(111046).
作者简介:袁思明(1989- ),女,硕士生,主要从事微生物学的研究;*通信作者:李翠新(1972- ),女,博士,副教授,主要从事食用菌栽培与利用的研究;何德(1970- ),男,博士,副教授,主要从事分子细胞生物学的研究.
文章编号:1008-8423(2016)01-0077-04
DOI:10.13501/j.cnki.42-1569/n.2016.03.020
中图分类号:S646
文献标志码:A
