重组谷氨酸脱羧酶制备γ-氨基丁酸的工艺条件优化
2016-06-10黄燕宿玲恰吴敬
黄燕 宿玲恰 吴敬
(江南大学 食品科学与技术国家重点实验室 生物工程学院工业生物技术教育部重点实验室,无锡 214122)
重组谷氨酸脱羧酶制备γ-氨基丁酸的工艺条件优化
黄燕 宿玲恰 吴敬
(江南大学 食品科学与技术国家重点实验室 生物工程学院工业生物技术教育部重点实验室,无锡 214122)
谷氨酸脱羧酶,一种磷酸吡哆醛(PLP)依赖性酶,能专一、不可逆地催化L-谷氨酸脱羧得到γ-氨基丁酸(GABA)。构建了产Lactobacillus brevis WJH3 谷氨酸脱羧酶重组大肠杆菌E.coli BL21(DE3)/pET-24a-gad,以此作为菌种进行摇瓶发酵诱导培养,发酵过程中一次性添加0.05 mmol/L PLP培养24 h,破壁上清酶活达81.7 U/mL,是不添加PLP对照酶活的1.8倍。对酶转化L-谷氨酸钠生成GABA反应条件进行了优化,结果表明,在转化体系不添加PLP的情况下,底物谷氨酸钠浓度为250 g/L,反应初始pH5.0,温度37℃,加酶量60 U/g 底物,转速200 r/min,在此条件下反应18 h,GABA转化率达到100%,为γ-氨基丁酸的工业化生产奠定基础。
谷氨酸脱羧酶;酶转化;磷酸吡哆醛;谷氨酸钠;γ-氨基丁酸
γ-氨基丁酸(γ-aminobutyric acid,GABA),一种非蛋白质氨基酸,以自由态形式广泛存在于自然界中,是哺乳动物中枢神经系统的抑制性传递物质[1]。GABA具有多种生理功能,如镇静神经[2]、降血氨[3]、健肝利肾[4]及治疗癫痫[5]等。此外,研究表明GABA可以作为工业上合成N-甲基吡咯烷酮[6]、生物塑料及尼龙[7,8]等含氮化学制品的环保型前体物质。因此GABA正被广泛应用于医药、食品保健、化工及农业等行业。
GABA天然存在量很低,很难从天然组织中大量分离,阻碍了它的工业生产。目前,GABA的制备方法有化学合成法、植物富集法和微生物合成法。相比而言,化学合成GABA安全性差、环境污染严重,植物富集GABA含量较低,而微生物合成生产法因具有条件温和、成本低,能耗低,产量高等优点而成为主要的生产方法。微生物合成法的原理是采用谷氨酸脱羧酶(glutamate decarboxylase,GAD;EC4.1.1.15)专一、不可逆地催化L-谷氨酸裂解为GABA和CO2。
Li等[9]采用Lactobacillus brevis NCL912野生菌发酵48 h时,发酵液中GABA浓度达到102.78± 5.30 g/L,无谷氨酸钠残留。根据Plokhov等[10]报道,在大肠杆菌基因来源的Escher-ichia coli BL21(DE3)重组菌发酵过程中添加0.02 mmol/L的PLP,能使GAD产量提高2倍,同时又有文献报道短乳杆菌GAD与辅酶PLP紧密结合,经破壁、蛋白纯化等步骤均不会丢失[11,12],因此我们猜想如果在发酵过程中添加一定量的PLP,所得到的短乳杆菌的粗酶液应该可以用于在不添加辅酶的条件下生产GABA,以达到节约成本的目的。为探索出一种重组谷氨酸脱羧酶无需辅酶PLP转化合成GABA的生产工艺,本研究从实验室现有菌株短乳杆菌(Lactobacillus brevis WJH3)[13]PCR获得GAD基因并连接到表达载体pET-24a(+),进行重组表达,并在此基础上,对酶转化过程中不添加辅酶PLP的酶转化工艺进行优化,以期获得高效生产GABA的方法。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 短乳杆菌(Lactobacillus brevis WJH3):实验室筛选获得,保藏编号为CCTCC M2014150;E.coli JM109、E.coli BL21(DE3):本实验室保藏;克隆载体pMD18-T Simple vector:购自TaKaRa公司;表达载体pET-24a(+):购自Novagen公司。
1.1.2 培养基 MRS,LB,TB,SOB,SOC 培养基:细菌常规通用培养基;重组大肠杆菌培养基中添加终浓度为30 μg/mL的卡那霉素。
1.1.3 主要试剂和仪器 基因组试剂盒、胶回收试剂盒、质粒抽提试剂盒和PCR 产物纯化试剂盒均购自天根生化科技有限公司;限制性内切酶、T4 DNA连接酶、PrimeSTAR®HS DNA 聚合酶、蛋白质相对分子质量标准、核酸分子量标准及琼脂糖购自TaKaRa公司;氨苄那霉素、卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)购自于生工生物工程(上海)有限公司;γ-氨基丁酸、邻苯二甲醛购自Sigma 公司;蛋白胨、酵母粉购自英国Oxoid公司;其他所用试剂购自于中国国药集团。
主要仪器:PCR 仪、UVP 凝胶成像系统、蛋白电泳仪购自美国Bio-Rad公司;DYY-6C型核酸电泳仪购自北京六一仪器厂;高效液相色谱仪购自Agilent公司;细胞破碎仪购自北京科实兴业科技有限公司;紫外可见光分光光度计购自日本Shimadzu公司。
1.2 方法
1.2.1 工程菌的构建 提取Lactobacillus brevis WJH3的基因组DNA,并以此为模板PCR扩增目的基因gad。PCR反应条件为:94℃ 4 min;94℃ 45 s,60℃45 s,72℃ 130 s,循环 30次,72℃ 10 min。PCR引物如下:P1(5'-3'):CGCCATATGGCTATGTTGTATGGAAA(正向引物);P2(5'-3'):CCC0AAGCTTAGTGCGTGAACCCGTATTT(反向引物)。P1、P2 分别含NdeⅠ和Hind Ⅲ的限制性酶切位点。将PCR产物经胶回收试剂盒回收纯化后连接至克隆载体pMD18-T,连接产物经热激法转入E.coli JM109感受态细胞,在含100 μg/mL氨苄青霉素(Amp)平板上培养过夜,挑取单克隆在含100 μg/mL Amp液体LB培养基中培养8-10 h,抽提质粒得到pMD18-T-gad,并采用酶切电泳和测序鉴定。序列测定由上海生工生物工程有限公司完成。
将pMD18-T-gad经NdeⅠ和Hind Ⅲ双酶切后回收目的片段,再与同样处理酶切处理的表达达载体pET-24a(+)用T4连接酶连接,连接产物转入E.coli JM109感受态细胞中,在含30 μg/mL 卡那霉素(Kan)平板培养过夜,挑取单克隆在含30 μg/mL Kan液体LB中37℃培养8-10 h,提取得到重组质粒pET-24a(+)-gad。将重组质粒双酶切验证,验证正确后转入E.coli BL21(DE3)中,37℃培养过夜,保存甘油管。
1.2.2 摇瓶发酵生产GAD 将-80℃保藏的重组菌Ecoli BL21/pET-24a(+)-gad从甘油管中接入种子培养基,初始pH7.0-7.2,回转恒温摇床37℃、200 r/min培养8 h后,按 5%的接种量接种至TB中,37℃培养2 h后加入一定量浓度的 IPTG和0.05 mmol/L PLP,降温至25℃进行重组蛋白的诱导表达,诱导24 h后,每隔3 h取样、离心收集菌体。当OD600低于5.0时直接用50 mmol/L pH 5.5 Na2HPO4-柠檬酸缓冲液悬浮菌体,当菌体生长至OD600大于5.0时,采用缓冲液稀释至5.0,超声破碎后离心,破壁上清即为GAD粗酶液,单位体积酶活根据相应体积发酵液菌体稀释倍数折算得出。
1.2.3 GAD活性测定 取40 μL GAD粗酶液加入360 μL底物(底物体系:采用50 mmol/L pH4.8 Na2HPO4-柠檬酸缓冲液溶解0.15 mmol/L PLP和0.1 mol/L 谷氨酸),于37℃恒温水浴反应4 min,然后用600 μL 0.2 mol/L pH10硼酸缓冲液终止反应。采用HPLC-OPA柱前衍生法测量GABA生成量。酶活单位定义为在酶活测量体系下,在1 min内能转化生成1 μmol GABA的酶量。
1.2.4 GABA的制备及含量测定 用pH5.0 Na2HPO4-柠檬酸缓冲液配制浓度为250 g/L的谷氨酸钠溶液,与一定量的粗酶液(上述1.2.2添加辅酶PLP发酵所得菌体经浓缩高压匀浆破壁所得)充分混匀后在37℃、200 r/min水浴摇床中控制反应pH 5.0,反应4 h后,每隔2 h补加50 g/L谷氨酸钠固体至相应底物浓度反应18 h,酶转化过程中反应体系未添加PLP,转化后的反应液加入等体积的三氯乙酸后,静置2 h,12 000 r/min离心10 min,取上清进行分析。产物采用HPLC-OPA柱前衍生法进行检测。
转化率定义为:生成的GABA的摩尔数/L-谷氨酸的摩尔数*100%。
1.2.5 HPLC-OPA柱前衍生法测量GABA 利用HPLC-OPA柱前衍生法进行氨基酸分析的色谱 条 件 是:Agilent 1200 HPLC色 谱 仪(Agilent Technologies,Palo Alto,CA,USA),Agilent自 动进样器,XDB-C18(4.6 mm × 150 mm)色谱柱,Agilent紫外检测器(338 nm);流动相 A:醋酸钠4.52 g/L,200 μL/L 三乙胺,5 mL/L四氢呋喃,醋酸调节pH7.2。流动相B:醋酸钠 22.6 g/L /乙腈/甲醇= 1∶2∶2(体积比)。二元梯度洗脱;流速0.8 mL/min;柱温40℃[14]。
2 结果
2.1 GAD重组菌的构建
2.1.1 重组质粒pET-24a(+)-gad 的构建 以提取的Lactobacillus brevis WJH3基因组为模板,PCR扩增得到目的基因gad,其长度大小经凝胶电泳验证为1.4 kb。将gad 基因片段插入pMD18-T simple 质粒中,测序后发现gad 基因所编码的氨基酸序列与Lactobacillus brevis NCL912 同源性99%。纯化回收目的基因后与同样酶切、纯化回收的pET-24a(+)连接,连接后转入E.coli JM109,培养重组菌并抽提质粒进行双酶切验证,如图1所示,分别在5 300 bp和1 400 bp附近有明显的条带,条带大小与预期相符,表明重组表达载体pET-24a(+)-gad构建成功。
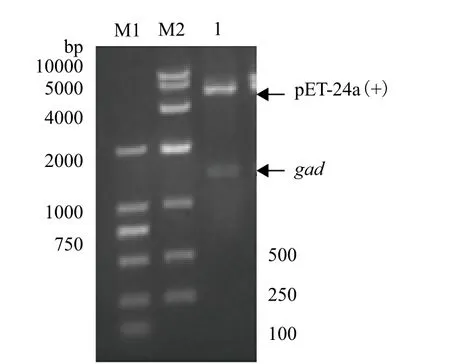
图1 重组质粒pET-24a(+)-gad酶切验证
2.1.2 重组菌E.coli BL21(DE3)/ pET-24a(+)-gad的构建及培养 将重组质粒pET-24a(+)-gad转化E.coli BL21(DE3)感受态细胞,经0.2 mmol/L IPTG诱导并同时添加0.05 mmol/L PLP发酵培养24 h后离心收集菌体,超声破碎后离心得到GAD粗酶液。结果如图2所示,随着时间的推移,重组GAD酶活不断增加,诱导15 h胞内酶活达到81.7 U/mL,是不添加PLP对照酶活的1.8倍。SDS-PAGE分析结果见图3,从图3可见在54 kD处出现一条蛋白条带,与理论GAD分子量相符,表明GAD在E.coli BL21(DE3)中成功表达。

图2 重组菌在摇瓶发酵中的产酶曲线

图3 谷氨酸脱羧酶SDS-PAGE分析
2.2 重组GAD制备GABA工艺优化
2.2.1 反应pH对GABA合成的影响 以250 g/L的谷氨酸钠作为底物,加酶量80 U/g底物,温度37℃,转速200 r/min,分别控制在pH 3.5、4.0、4.5、5.0、5.5和6.0转化环境中反应18 h。产物用HPLCOPA衍生法进行检测。结果如图4所示,当pH为5.0时,GABA转化率为100%。与文献报道短乳杆菌的GAD最适转化pH范围4.8接近[13]。当pH低于5.0时,谷氨酸钠容易以谷氨酸形式析出形成白色乳浊液,不利于酶催化反应;当pH大于5.0时不利于酶活性中心的赖氨酸残基以shifft-碱与辅酶(PLP)、底物结合,从而不利于GABA的合成[15]。因此过酸或过碱对酶促反应都不利,在pH为5.0时GABA转化率最高。
2.2.2 反应温度对酶转化的影响 以250 g/L的谷氨酸钠作为底物,加酶量80 U/g底物,pH5.0,转速200 r/min,分别在30℃、37℃、40℃、50℃和60℃反应18 h。产物用HPLC-OPA衍生法进行检测。如图5所示,反应温度37-40℃时,GABA转化率达到100%,与其他大部分来源GAD的最适酶转化温度一致[13,16,17]。随着温度的升高或下降,GABA转化率下降。60℃条件下,GABA转化率只有12.4%,这可能是在高温下酶与辅酶的不稳定,从而影响GABA 的产率。为了与其他文献对比,我们采用37℃为最佳转化温度。

图4 反应pH对酶转化的影响
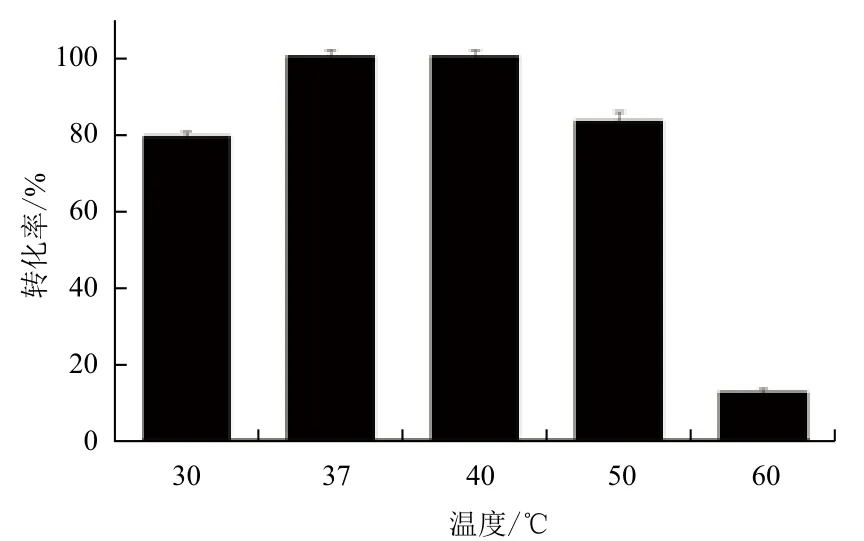
图5 反应温度对酶转化的影响
2.2.3 加酶量对酶转化的影响 以250 g/L的谷氨酸钠作为底物,加入不同量的GAD,加酶量分别为每克底物20、40、60、80、100 U/g,pH 5.0,反应温度37℃,转速200 r/min反应18 h。产物用HPLCOPA衍生法进行检测。如图6所示,随着加酶量的增多,GABA转化率逐渐增大,在60 U/g时转化率达到100%,之后加酶量增加,转化率不变,转化时间缩短。考虑到经济性因素,选择加酶量为60 U/g。2.2.4 底物浓度对GABA酶转化的影响 通过温度、pH等优化结果显示,当底物浓度为250 g/L时转化率已达到100%,为继续提高反应强度,尝试提高初始谷氨酸钠浓度,经过实验发现,当底物浓度大于250 g/L时谷氨酸钠将以谷氨酸形式析出形成白色乳浊液,不利于反应进行,且对酶及辅酶稳定性产生影响。为进一步提高反应强度,我们尝试分批补料添加一定量的谷氨酸钠固体以提高底物浓度。
初始谷氨酸钠浓度为250 g/L,加酶量60 U/g,控制pH 5.0,温度37℃,置于200 r/min的恒温水浴摇床中反应4 h后,每隔2 h补加50 g/L的谷氨酸钠固体至相应底物浓度(400或500 g/L),反应18 h后终止反应,产物采用HPLC-OPA柱前衍生法进行检测。如图7所示,谷氨酸浓度为250 g/L时,GABA转化率达到100%。随着谷氨酸钠浓度的增加,GABA转化率逐渐降低,当谷氨酸钠浓度为400 g/L时,GABA转化率为88.4%,GABA产量达到247.8 g/L。继续增加谷氨酸浓度到500 g/L时,GABA转化率下降为74.3%,GABA产量达到255.7 g/L。补料添加GABA产率比一次性添加的175.2 g/L有所提高,但综合考虑产品中GABA的比例和产率,本着节省资源,降低工业成本的原则,选择250 g/L 浓度。

图6 加酶量对酶转化的影响
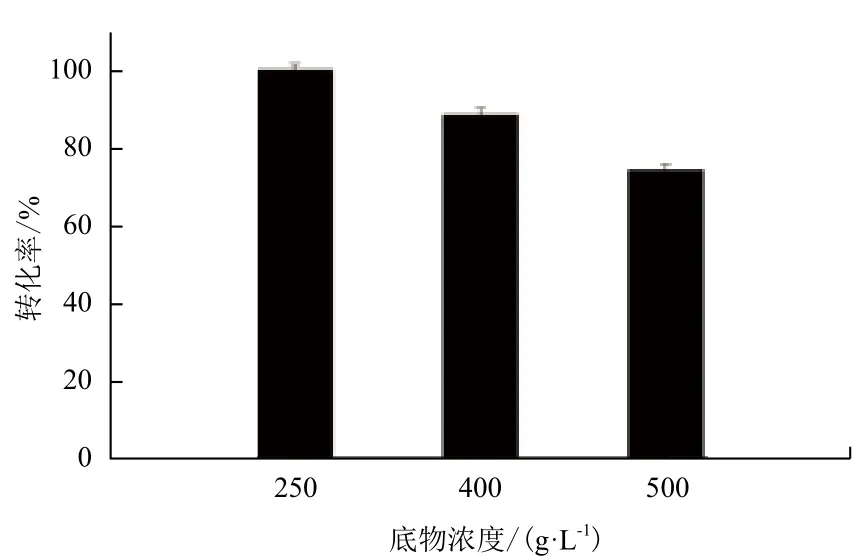
图7 分批补料浓度对酶转化的影响
3 讨论
目前国内外关于生产GABA的报道集中于从传统食物中筛选产量较高的野生菌进行发酵生产GABA。Binh等[18]从泡菜中筛选得到一株Lactobacillus brevis,优化培养条件后,GABA终浓度达到4.2 g/L,转化了达到99.7%。Shi等[19]从采用Lactobacillus brevis CGMCC No.3414菌株发酵结束后添加50 g/L谷氨酸,反应4 h后转化率达到93.15%。夏江等[20]筛选了一株Lactobacillus brevis CGMCC NO.1306,其GABA 的最大产量已达到76.4 g/L。Li等[21]从泡茶中分离得到一株Lactobacillus brevis NCL912,对发酵条件进行优化后,GABA产量高达103.6 g/L,发酵液中无谷氨酸残留。但是野生菌谷氨酸脱羧酶的表达量很低,无法满足生产需要。另外,由于发酵液是一个复杂的多相体系,除了目的产物GABA,还含有蛋白质、残糖及无机盐等杂质,使得GABA分离纯化步骤变得十分复杂,因此,利用分子生物学技术高效表达GAD并优化酶制备工艺得到该领域学者、专家的关注。但是,目前报道中的短乳杆菌GAD产量都比较低,最高仅有12.7 U/mL[22],且关于采用短乳杆菌GAD酶法合成工艺的报也很少。因此,本实验在E.coli BL21(DE3)中成功表达了来源于Lactobacillus brevis WJH3的GAD,且在发酵过程中一次性添加0.05 mmol/L PLP培养24 h,破壁上清酶活达81.7 U/mL,是不添加PLP对照酶活的1.8倍。我们还分别考察了该重组酶制备GABA的应用,考察了pH、温度、加酶量、底物浓度等对酶转化的影响,在最优条件下能将250 g/L 的L-谷氨酸钠完全转化成GABA。下一步的研究重点是将该重组菌在3 L发酵罐中进行优化,获得更高表达量的酶液,为工业化奠定基础。
4 结论
本研究成功构建了表达GAD的重组E.coli BL21(DE3)菌株,初步实验表明在发酵过程中添加0.05 mmol/L的辅酶PLP重组菌破壁上清液中GAD酶活可达81.7 U/mL,较空白提高1.8倍。采用该重组GAD粗酶液优化了酶法生产GABA的工艺条件。结果表明,底物谷氨酸钠浓度为250 g/L,反应pH 5.0,温度37℃,加酶量60 U/g 底物,转速200 r/min,转化时间18 h,GABA转化率可达100%;采用GAD粗酶液不添加辅酶PLP合成GABA的方法操作简单、节约成本、利于提取。
[1]Manyam BV, Katz L, Hare TA, et al. Isoniazid-induced elevation of CSF GABA levels and effects on chorea in huntington’s disease[J]. Annals of Neurology, 1981, 10(1):35-37.
[2]Wong T, Guin C, Bottiglieri T, et al. Gaba, γ-hydroxybutyric acid, and neurological disease[J]. Annals of Neurology, 2003, 54(S6):S3-S12.
[3]Inoue K, Shirai T, Ochiai H, et al. Blood-pressure-lowering effect of a novel fermented milk containing γ-aminobutyric acid(GABA)in mild hypertensives[J]. European Journal of Clinical Nutrition, 2003, 57(3):490-495.
[4]杨胜远, 陆兆新, 吕凤霞, 等. γ -氨基丁酸的生理功能和研究开发进展[J]. 食品科学, 2005, 26(9):546-551.
[5]Meldrum BS. Epilepsy and y-aminobutyric acid-mediated inhibition[J]. Int Rev, Neurobiol, 1975, 17(1).
[6]Lammens TM, Franssen MCR, Scott EL, et al. Synthesis of biobased N-methylpyrrolidone by one-pot cyclization and methylation of γ-aminobutyric acid[J]. Green Chemistry, 2010, 12(8):1430-1436.
[7]Saskiawan I. Biosynthesis of polyamide 4, a biobased and biodegradable polymer[J]. Microbiology Indonesia, 2008, 2(3):5.[8]Kawasaki N, Nakayama A, Yamano N, et al. Synthesis, thermal and mechanical properties and biodegradation of branched polyamide 4[J]. Polymer, 2005, 46(23):9987-9993.
[9]Li H, Qiu T, Huang G, et al. Production of gamma-aminobutyric acid by Lactobacillus brevis NCL912 using fed-batch fermentation[J]. Microb Cell Fact, 2010, 9(9):85.
[10]Plokhov AY, Gusyatiner MM, Yampolskaya TA, et al. Preparation of γ-aminobutyric acid using E. coli cells with high activity of glutamate decarboxylase[J]. Applied Biochemistry and Biotechnology, 2000, 88(1-3):257-265.
[11] 范恩宇. 短乳杆菌谷氨酸脱羧酶基因的克隆与表达[D]. 杭州:浙江大学, 2010.
[12] Fan E, Huang J, Hu S, et al. Cloning, sequencing and expression of a glutamate decarboxylase gene from the GABA-producing strain Lactobacillus brevis CGMCC 1306[J]. Annals of Microbiology, 2012, 62(2):689-698.
[13]朱孔亮. 泡菜用乳酸菌的筛选, 高密度培养及菌剂配方的研究[D]. 无锡:江南大学, 2014.
[14]Chen X, Su L, Wu D, et al. Application of recombinant Bacillus subtilis γ-glutamyltranspeptidase to the production of l-theanine[J]. Process Biochemistry, 2014, 49(9):1429-1439.
[15] Gut H, Pennacchietti E, John RA, et al. Escherichia coli acid resistance:pH-sensing, activation by chloride and autoinhibition in GadB[J]. The EMBO Journal, 2006, 25(11):2643-2651.
[16]吴晓燕, 钱绍松, 李加友, 等. 酶法制备 D-谷氨酸和 γ-氨基丁酸的工艺研究[J]. 化工进展, 2005, 24(8):889-892.
[17]田灵芝, 徐美娟, 饶志明. 一株重组大肠杆菌/pET-28a-lpgad的构建及其高效生产 γ-氨基丁酸转化条件的优化[J]. 生物工程学报, 2012, 28(1):65-75.
[18]Binh TTT, Ju WT, Jung WJ, et al. Optimization of γ-amino butyric acid production in a newly isolated Lactobacillus brevis[J]. Biotechnology Letters, 2014, 36(1):93-98.
[19]Shi X, Zheng B, Chang C, et al. Enzymatic Bioconversion for γ-Aminobutyric Acid by Lactobacillus brevis CGMCC No. 3414 Resting Cells[M]//Springer Berlin Heidelberg:Advances in Applied Biotechnology, 2015:609-617.
[20] 夏江, 梅乐和, 黄俊, 等. 产 γ-氨基丁酸的乳酸菌株筛选及诱变[J]. 核农学报, 2006, 20(5):379-382.
[21] Li H, Qiu T, Huang G, et al. Production of gamma-aminobutyric acid by Lactobacillus brevis NCL912 using fed-batch fermentation[J]. Microb Cell Fact, 2010, 9(9):85.
[22] 范恩宇. 短乳杆菌谷氨酸脱羧酶基因的克隆与表达[D]. 杭州:浙江大学, 2010.
(责任编辑 李楠)
Optimization of γ-aminobutyric Preparation by Recombinant Glutamate Decarboxylase
HUANG Yan SU Ling-qia WU Jing
(State Key Laboratory of Food Science and Technology,School of Biotechnology and Key Laboratory of Industrial Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122)
Glutamate decarboxylase(GAD),a pyridoxal 5'-phosphate(PLP)-dependent enzyme,irreversibly catalyzes the decarboxylation of L-glutamate to be the valuable food additive γ-aminobutyric acid(GABA). In this study,a recombinant Escherichia coli BL21(DE3)/pET-24a-gad producing Lactobacillus brevis WJH3 GAD was constructed as strain in the flask culturing of fermentation and induction. The activity of GAD produced in the supernatant of culturing for 24 h medium supplemented one-time with 0.05 mmol/L PLP was 81.7 U/mL,and this was 1.8-fold of that without PLP supplementation. Furthermore,the condition for GABA preparation by enzymatic conversion was optimized;under the condition of 250 g/L monosodium glutamate(MSG),pH5.0,37℃,60 U GAD per gram substrate incubated for 18 hours,and rotation rate 200 r/min,100% of the MSG was transformed into GABA. These results establish the utility of PLP supplementation and lay the foundation for large-scale enzymatic production of GABA.
glutamate decarboxylase;enzymatic conversion;pyridoxal 5'-phosphate;monosodium glutamate;γ-aminobutyric
10.13560/j.cnki.biotech.bull.1985.2016.06.029
2015-09-17
国家杰出青年基金项目(31425020),111计划(111-2-06)
黄燕,女,硕士研究生,研究方向:重组酶的制备和应用;E-mail:18206180508@163.com
吴敬,女,博士生导师,研究方向:食品与发酵;E-mail:jingwu@jiangnan.edu.cn
