乙肝病毒在早期胚胎中复制情况实验研究
2016-06-07陕西省人民医院消化内一科西安710068
陕西省人民医院消化内一科(西安710068)
金 燕 吕颐菲 邱 婷 王 雪 高淑娟 闫春英 刘贵生
乙肝病毒在早期胚胎中复制情况实验研究
陕西省人民医院消化内一科(西安710068)
金燕吕颐菲邱婷王雪高淑娟闫春英刘贵生
摘要目的:观察HBV会在早期卵裂胚胎中复制情况,探讨HBV在早期胚胎内的生物学活性。方法:选取行辅助生育技术治疗女方或男方有一方或双方患有慢性乙肝夫妇的废弃胚胎为实验组,同期HBV阴性的废弃单细胞卵裂胚胎作为阴性对照组。采用单细胞RT-PCR方法检测早期卵裂胚胎中的HBV mRNA。结果:实验组62个卵裂胚胎中有6个检测到特异性HBV mRNA片段,阳性检出率 9.7%(6/62)。女方HBV标志物阳性、男方HBV标志物阳性和夫妻双方HBV标志物阳性的卵裂胚胎阳性检出率分别为13.2%(5/38)、5.6%(1/18)和0%(0/6)。结论:在早期卵裂胚胎内存在的HBV具有复制活性使胚胎感染HBV,发生真正意义上的经卵细胞途径的HBV母婴垂直传播。
主题词 乙型肝炎病毒胚胎发育病毒复制多重聚合酶链式反应
目前研究证实乙型肝炎病毒的母婴传播是造成HBV感染慢性化的主要原因。多项研究结果[1-3]证实,HBV可以穿过透明膜和细胞膜进入卵母细胞并在卵细胞内进行复制和增殖,但是这些并不足以证明HBV会经卵细胞将感染传递到下一代,要得出这个结论尚需要解决几个关键问题,即:①在自然受精时,存在HBV DNA的人卵母细胞是被选择性剔除还是能顺利地完成受精过程而将HBV带入受精卵;②在早期胚胎中存在的HBV是以片段整合于宿主细胞还是具有复制活性?本研究借助进行体外受精人群,利用单细胞RT-PCR技术了解HBV mRNA在单细胞卵裂胚胎中的情况,分析HBV在早期胚胎内的复制活性。
材料和方法
1材料选取2010年6月至2011年12月在陕西省妇幼保健院生殖中心行辅助生育技术治疗女方或男方或夫妻双方均患者乙肝的62个废弃胚胎作为实验组;同期进行体外受精的50例夫妇双方HBV两对半检测均为阴性的76个废弃胚胎作为阴性对照组。所有乙肝患者符合以2000年全国病毒性肝炎学术会议(西安)修订的慢性病毒性肝炎的诊断标准。所有患者在手术前于肘静脉处抽取10ml静脉血,分别用于血清HBV DNA定量检测,和HBVM检测(送生化实验室完成)。同时检测患者血清中HAVM、HAV、HCV、HDV和HIV抗体,排除有上述病毒的感染。
2实验方法
2.1细胞裂解:将废弃单细胞卵裂胚胎置于分装的裂解液,按照Invitrogen的Superscript III First-Strand Synthesis 反转录试剂盒说明书进行逆转录反应,整个反应在冰上进行。用Oligo6.0生物软件设计管家基因β-actin的引物[4]。根据HBV的S区 mRNA基因序列[5]。PCR反应扩增条件:预变性:95℃ 3min,变性:94℃ 50s,56℃ 50s,延伸:72℃ 50s,30个循环→72℃延伸10min后,进行第二轮PCR。条件和步骤同第一轮。
2.2对照选择:阴性对照:选择夫妻双方HBV两对半检测均为阴性的废弃胚胎,转录过程中不加模板,转录中不加逆转录酶,不加模板的PCR反应体系,空白对照代替模板。PCR扩增时不加Taq酶。阳性对照为HBV患者阳性血清DNA。
结果
1RT-PCR结果
1.1所有单细胞卵裂胚胎置于裂解液后在同一EP 管中进行逆转录生成cDNA后,行PCR扩增管家基因β-actin,扩增片段长度为179bp。除了阴性对照,每管都扩增出目的片段(图1)。

图1 β-actin扩增电泳图
扩增产物为管家基因β-actin,扩增片段长度为179bp。除了阴性对照,每管都扩增出目的片段。
1.2 用巢式PCR扩增出目的片段,第一轮均无目的片段扩增,第二轮产物为206bp。62个卵裂胚胎中有6个检测到特异性HBV mRNA片段,阳性检出率为 9.7%(6/62)。女方HBV标志物阳性、男方HBV标志物阳性和夫妻双方HBV标志物阳性的卵裂胚胎阳性检出率分别为13.2%(5/38)、5.6%(1/18)和0%(0/6),用Fisher确切概率法分析,各组间阳性率差异无明显统计学意义(P=0.468),见附表。
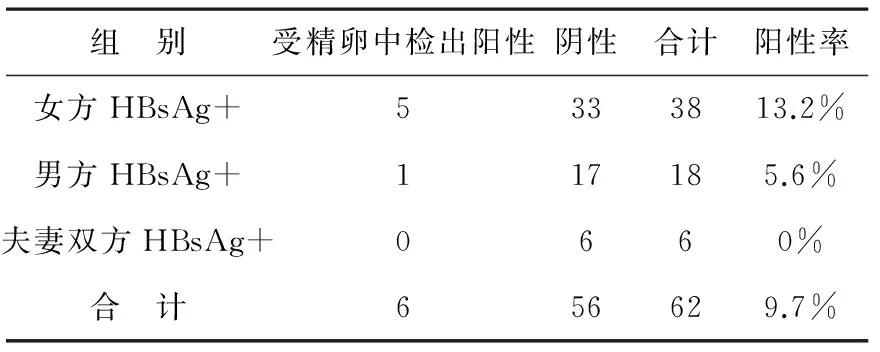
附表 各组受精卵中HBV阳性率比较
用Fisher确切概率法分析,各组间受精卵中检出HBV阳性率的比较差异χ2= 1.519,P>0.05,无明显统计学意义。
14例女方HBV标志物阳性卵裂胚胎中,2例卵裂胚胎中HBV mRNA阳性,阳性率为14.3%(2/14);其中1例的5个胚胎中有3个阳性信号,另1例3个卵裂胚胎中检出2个阳性信号。9例男方HBV标志物阳性的卵裂胚胎中的阳性率为11.1%(1/9),此例的4个胚胎中检出1个阳性信号。阴性对照的胚胎中未检出特异性HBV mRNA信号(图2)。
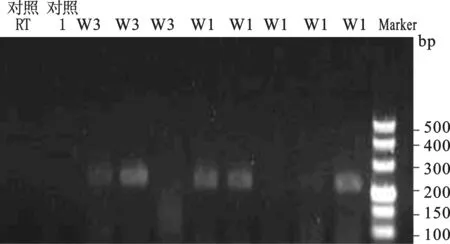
图2 单个卵裂胚胎HBV mRNA扩增产物电泳图
用巢式PCR扩增出目的片段,第一轮均无目的片段扩增,第二轮产物为206bp。上图为女方乙肝阳性组,其中一例的5个胚胎中有3个阳性信号,另1例3个卵裂胚胎中检出2个阳性信号。下图显示1例男方HBV标志物阳性的4个胚胎中检出1个阳性信号。
讨论
我们在卵巢组织及卵母细胞内检测到HBV复制的指标,包括HBcAg、HBV DNA和HBV mRNA,这些都为HBV随着受精进入胚胎并具有活跃复制提供基础。有学者将HBV基因转入小鼠卵细胞后与正常精子受精或直接转染入受精卵内,在子代小鼠中不仅观察到了整合的HBV DNA片段[6],还发现了HBV复制和表达的证据,更有甚者还发现了3.5 kb mRNA和少量包装在Dane颗粒中的部分双链DNA[7]。这些研究说明HBV可进入动物卵母细胞,而这些含有HBV的卵母细胞并不被选择性淘汰而成功受精,并在母体内发育成熟产生新的子代个体。HBV不仅能在新子代个体基因内整合,更有甚者,在HBV会在其内复制和表达,最终造成转基因动物的HBV母婴垂直传播。但是由于HBV具有严格的种属特异性,且转基因过程与自然感染有很大差距,因此以上研究与自然过程发生的人类经卵细胞HBV母婴传播有着很大的差距。由于人类的卵母细胞不易获得,研究人类的HBV经卵细胞传播途径进展缓慢。有报道指出HBV DNA在人类卵母细胞基因组内存在整合;人类生殖细胞携带的HBV DNA能够通过受精的方式垂直传递给早期胚胎。但是仅仅是以整合状态存在的遗传传递并不意味着胚胎必定会感染HBV,只有发现具有完整复制活性的病毒才是真正意义的母婴传播。
我们通过单细胞RT-PCR技术,检测到了在早期卵裂细胞中存在HBV mRNA且结果显示女方HBV标志物阳性组、男方HBV标志物阳性组和夫妻双方HBV标志物阳性组的早期卵裂胚胎中HBV mRNA的阳性检出率分别为13.2%(5/38)、5.6%(1/18)和0%(0/6),且各组间的差异无统计学意义。本研究在人类早期胚胎中检测出了HBV mRNA,说明胚胎中感染的HBV不仅仅是以整合状态存在,还具有一定的复制活性,在一定的条件下可以进行转录和翻译。由于所有受试人员来自体外受精人群,在取卵过程中尽量避免了血液污染并进行了充分的清洗,胚胎中所含HBV应该来自于生殖细胞本身,同时我们之前通过原位杂交在卵母细胞中也检出的HBV mRNA,因此,有理由相信卵母细胞中活跃复制的HBV可以随着受精过程进入受精卵并在胚胎内也可以复制,发生真正意义上的HBV经卵细胞母婴垂直传播。遗憾的是,我们并没有检测受精前的生殖细胞中的HBV,不能证实在早期胚胎中的检出的HBV直接来自这些生殖细胞。这是由于所有患者要求的将取出的生殖细胞(精子和卵子)进行体外受精以确保受精成功率。
我们对所有逆转录产物都进行了管家基因β-actin的扩增,结果显示均扩增出了目的片段,其意义在于表明所有标本的mRNA均被成功逆转录成CDNA,以排除因实验问题导致的假阴性的可能性。同时设置了逆转录和PCR时的阴性对照以排除实验本身引起的假阳性。
总之,通过选择患有慢性乙肝并进行体外受精的这一特殊人群,我们证实了在早期卵裂胚胎内存在的HBV具有复制活性使胚胎感染HBV,发生真正意义上的经卵细胞途径的HBV母婴垂直传播。
参考文献
[1]Feng Y, Ya-Fei Yue, Shu-Hong Li,etal. Presence of HBsAg, HBcAg and HBVDNA in Ovary and ovum of the Patients with Chronic Hepatitis B Virus Infection [J]. Am J Obstet Gynecol, 2006, 193(2): 387-392.
[2]Wang AH, Wang AQ, Xu DZ,etal. The mechanism of HBV infection of human trophoblast cell[J]. Zhonghua Shi Yan He Lin Chuang Za Zhi, 2008, 22: 51-53.
[3]金燕,邱婷,吕颐菲,等. HBV在卵巢组织及卵细胞中的复制情况的研究.[J].陕西医学杂志,2015,44(7):17--20.
[4]Barone M, Spano D, D'Apolito M,etal. Gene expression analysis in HBV transgenic mouse liver: A model to study early events related to hepatocarcinogenesis [J]. Mol Med, 2006, 12(4-6): 115-123.
[5]Cabrerizo M, Bartolomé J, Caramelo C,etal. Molecular analysis of hepatitis B virus DNA in serum and peripheral blood mononuclear cells from hepatitis B surface antigen-negative cases [J]. Hepatology, 2000, 32(1): 116-123.
[6]Chen LZ, Fan XG, Gao JM. Detection of HBsAg, HBcAg, and HBV DNA in ovarian tissues from patients with HBV infection [J]. World J Gastroenterol,2005, 11: 5565-5567.
[7]Bagis H, Arat S, Merean HO,etal. Stable transmission and expression of the Hepatitis B virus total genome in hybridtransgenie miee until F10 generation [J]. J Exp Zoolog A Comp Exp Biol, 2006, 305(5): 420-427.
(收稿:2015-06-09)
【中图分类号】R392.3
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.03.005
