慢性肾脏病合并慢性丙型肝炎的诊治研究进展
2016-06-07吴逸如刘文虎
吴逸如,刘 莎,刘文虎
·新进展·
慢性肾脏病合并慢性丙型肝炎的诊治研究进展
吴逸如,刘 莎,刘文虎
100050北京市,首都医科大学附属北京友谊医院肾内科,首都医科大学肾病学系
【摘要】慢性肾脏病患者丙型肝炎病毒感染率较普通人群高,在发达国家,慢性肾脏病患者丙型肝炎病毒感染率为7%~40%。丙型肝炎病毒感染增加了慢性肾脏病患者的死亡风险,有效的抗病毒治疗可以改善此类患者的预后。然而,慢性肾脏病合并慢性丙型肝炎的诊治较复杂,目前缺乏诊疗经验,现对慢性肾脏病合并慢性丙型肝炎患者的诊治做一综述。
【关键词】肾疾病;丙型肝炎,慢性;抗病毒药;综述文献(主题)
吴逸如,刘莎,刘文虎.慢性肾脏病合并慢性丙型肝炎的诊治研究进展[J].中国全科医学,2016,19(15):1833-1836.[www.chinagp.net]
Wu YR,Liu S,Liu WH.Research progress of chronic kidney disease combined with chronic hepatitis C[J].Chinese General Practice,2016,19(15):1833-1836.
慢性丙型肝炎(chronic hepatitis C,CHC)是慢性肾脏病(chronic kidney disease,CKD)尤其是维持性血液透析(maintenance hemodialysis,MHD)患者常见的合并症,是导致CKD患者肝脏损伤最常见的原因。输血、反复穿刺、营养状况差等原因导致CKD患者丙型肝炎病毒(hepatitis C virus,HCV)感染率较普通人群明显升高,在发达国家,CKD患者HCV感染率为7%~40%[1-2]。尽管对于MHD患者,HCV相关的肝脏疾病大多是无症状的,肝脏的相关并发症也是CKD尤其是终末期肾脏病(end stage renal disease,ESRD)合并HCV感染患者的重要死因之一[3]。抗病毒治疗可以改善此类患者的预后,然而,与普通人群相比,CKD合并CHC的诊治相对复杂,诊疗经验相对缺乏[3],本文就CKD合并CHC患者的诊治做一综述。
1CHC
1.1CHC的病原学及流行病学HCV属于黄病毒科,为单股正链RNA病毒,易变异。HCV-RNA只有一个开放读框,编码10余种结构和非结构(NS)蛋白。HCV目前可分为6个基因型,每个基因型又分为不同亚型。HCV1b基因型和HCV2a基因型在我国较为常见,其中以HCV1b基因型为主。该病毒抵抗力差,100 ℃ 5 min或60 ℃ 1 h、高压蒸气和甲醛熏蒸等均可灭活该病毒[4]。
CHC呈全球流行趋势,是欧美等发达国家终末期肝病最主要的原因[5]。目前,全球HCV感染率为3%,HCV患者约有1.7亿[4]。HCV的传播途径包括血液传播、性传播和母婴传播,因此加强血制品的管理及性教育等可以有效降低HCV感染率[4]。
1.2丙型肝炎的自然史感染HCV后1~3周,在外周血可检测到其RNA,在急性感染出现临床症状时,仅50%~70%的患者出现抗-HCV抗体阳性,3个月后约90%患者抗-HCV抗体阳转[6]。病毒血症持续超过6个月者为慢性感染,丙型肝炎慢性化率为50%~90%[6]。感染HCV 20~30年后肝纤维化发生率为10%~20%,而肝硬化后肝癌年发生率为1%~5%,肝功能不全的年发生率为3%~6%,一旦发生肝功能不全,患者病死率为15%~20%[6]。
1.3CHC的治疗2014年欧洲肝病学会提出的HCV感染诊治指南指出,所有初治和经治的代偿期患者均应接受抗病毒治疗,其中有中度到重度肝纤维化(Metavir评分为F2~F4)或者有HCV相关肝外表现者,应立即治疗;而对于无或有轻度肝纤维化(Metavir评分为F0~F1)者,可综合评估患者一般状况、感染情况、疾病进展风险及有无其他合并症等因素后,择期或立即治疗。若择期治疗,必须定期评估病情,一旦发现疾病进展须立即开始治疗[5]。
感染HCV后一般病情进展缓慢,抗病毒治疗疗效评价多采用短期的临床指标,包括病毒学应答、生化学应答与肝组织学应答等指标。其中病毒学应答指标中的持续病毒学应答(SVR)是评价抗病毒治疗疗效的最主要指标。SVR是指治疗结束时HCV-RNA载量小于最低检测值,停药随访24周HCV-RNA载量仍小于最低检测值。病毒基因型与基线核酸载量是影响患者抗病毒治疗疗效的两个最重要的因素。聚乙二醇干扰素(pegylated interferon,Peg-IFN)联合利巴韦林是目前治疗CHC的标准方案,且约65%的患者可达到SVR[7]。对于无病毒学应答的患者,近年来新兴的直接抗病毒药物(direct-acting antiviral agents,DAAs)为此类患者的治疗提供了更多的选择[8-10]。目前上市和在研的DAAs主要包括3类,即NS3/4A蛋白酶抑制剂、NS5A蛋白酶抑制剂和NS5B聚合酶抑制剂[11]。DAAs的上市为难治性CHC及不能耐受干扰素的患者提供了新的治疗选择,提高了抗病毒治疗的疗效。2014年欧洲肝病学会已将DAAs纳入CHC的基础治疗,根据不同的基因型选择不同的DAAs联合或不联合干扰素及利巴韦林,大部分的患者可达到SVR[5]。然而目前国内尚无上市的DAAs,尽管可以外购,但其费用昂贵,因此目前我国尚未普及。
2CKD合并CHC
2.1CKD合并CHC患者的预后CKD患者HCV感染率较普通人群高,透析患者尤为明显[12]。DOPPS研究纳入308个透析中心共8 615例透析患者,发现平均13.5%的患者合并CHC,不同国家不同透析中心发病率不同,其与每个透析中心及国家的经济卫生水平相关[2]。CKD患者与普通人群类似,HCV感染通常没有急性症状且疾病进展缓慢,大多数情况下通过实验室检查发现。CHC自愈率低,在MHD患者中,HCV-RNA自发清除率仅为1%,大多数患者一经感染即持续存在HCV[13]。
HCV感染可以增加透析患者的死亡风险。有报道称,ESRD合并HCV感染者死亡的相对风险率为1.35,而对于此类患者,肝脏疾病是其最常见的死因[3]。最近的一项Meta分析综合了14项临床随机对照试验,发现HCV感染可以增加MHD患者的全因死亡风险与心血管死亡风险[3]。然而,有学者认为,与普通CHC患者相比,ESRD合并CHC患者肝脏并发症的进展更慢。该学者观察了189例CHC合并血液透析患者(试验组)与单纯CHC患者(对照组),两组患者年龄无差异,随访4~23年后,试验组未出现肝纤维化,而对照组25%患者出现肝纤维化,两组有差异[14],另一项研究也支持该观点[15]。可见,尽管对于CHC患者而言,若合并ESRD则其全因死亡风险增加,但发展为终末期肝病的速度减慢。这一现象的原因目前尚不清楚,可能因为尿毒症患者HCV-RNA载量较非尿毒症患者低[16],也有学者认为其与病毒微粒进入透析液、黏附于透析膜进而激活宿主的抗病毒免疫反应相关[17]。
2.2CKD合并CHC患者的预防及监测为了控制CKD尤其是血液透析患者CHC的高发病率,各个指南关于CHC的预防均提出要合理应用注射类药物、透析机器严格消毒及注意手卫生等,最重要的是,要定期监测抗-HCV抗体。2008年KDIGO指南关于CHC患者的管理指出,推荐所有CKD尤其是CKD 5期患者进行HCV感染相关检测,强烈建议ESRD患者开始第一次透析前或更换透析中心时监测HCV感染相关指标,而对于未透析CKD患者其推荐等级弱。至于监测的指标,KDIGO指南建议,抗-HCV抗体或HCV-RNA均可作为最初的监测指标,具体根据当地及该透析中心CHC的流行情况而定,若是高发病区,建议将HCV-RNA作为最初的筛查指标;反之,可检测抗-HCV抗体[18]。但是,抗-HCV抗体阴性并不意味着未感染HCV。德国的一项多中心研究调查了2 796例透析患者,发现0.8%的患者HCV-RNA阳性但抗-HCV抗体阴性。不管是普通人群还是ESRD人群,关于HCV感染的监测,HCV-RNA的灵敏度和特异度均高于抗-HCV抗体,因此,推荐初次筛查选择HCV-RNA检测[18]。但是,如何监测HCV感染情况要根据各个透析中心的情况及每个国家的财政状况而定,我国原卫生部关于血液透析标准操作规范指出,对于第一次透析的新入患者或由其他中心转入的患者必须在治疗前进行抗-HCV抗体检测[19];对于抗-HCV抗体阳性的患者,应进一步行HCV-RNA及肝功能指标的检测。
KDIGO指南并没有明确指出CKD非透析患者的监测频率,而对于透析患者,根据DOPPSⅠ期研究发现,在为期5年的随访中绝大多数透析中心新发HCV感染率波动于0~3.6%,新发HCV感染率并不高,于是KDIGO指南指出,未感染HCV的患者,每6~12个月监测1次抗-HCV抗体;而当出现不明原因转氨酶水平升高时,患者属于高危人群,应检测HCV-RNA以确定是否感染HCV;若新发HCV感染患者为疑似医院感染时,所有患者检测HCV-RNA,若为阴性,2~12周复查[18]。
2.3CKD合并CHC患者的治疗CKD尤其是透析合并CHC患者的死亡风险明显高于普通CKD或透析患者。与普通CHC患者不同,CKD合并CHC患者治疗方案的选择不仅要考虑肝脏疾病发展情况,亦要考虑肾功能进展情况。2008年KDIGO指南指出,所有CKD合并CHC患者应评估抗病毒治疗的利弊,以判断是否进行抗病毒治疗[18]。抗病毒治疗的弊端主要在于药物尤其是干扰素的不良反应。干扰素常见不良反应的临床表现及处理见表1。鉴于此,抗病毒治疗时,需要根据CKD分期或肾小球滤过率(eGFR)调整药物的剂量(见表2)。由于利巴韦林可以引起溶血性贫血,尤其在合并肾性贫血时其发生率更高,故而CKD 3期之后不推荐应用利巴韦林治疗[18]。然而,早年由于可供选择的药物有限,部分ESRD合并CHC患者抗病毒治疗时也会选择干扰素或Peg-IFN联合利巴韦林[18]。抗病毒治疗的目标是达到SVR,近几年的Meta分析显示,MHD合并CHC患者抗病毒治疗平均SVR率偏低(见表3)[20-25]。尽管Peg-IFN联合利巴韦林可以达到相对比较高的持续病毒缓解,但是KDIGO指南并不建议对于MHD患者应用Peg-IFN或利巴韦林治疗,而单独普通干扰素治疗效果较差[18]。

表2 CKD合并CHC抗病毒治疗的方案
注:CKD=慢性肾脏病,Peg-IFNα-2a=聚乙二醇干扰素α- 2a,Peg-IFNα-2b=聚乙二醇干扰素α- 2b,eGFR=肾小球滤过率
表1干扰素常见不良反应的临床表现及处理
Table 1Clinical manifestations and treatment of common adverse reactions of IFN

不良反应临床表现处理流感样症候群发热,肌肉酸痛睡前注射或加用NSAIDS骨髓抑制WBC、PLT减少减量或停药精神异常抑郁、妄想,焦虑用药前评估,必要时停药诱导产生自身抗体(抗甲状腺抗体、抗核抗体、抗胰岛素抗体)无明显临床表现,部分患者可出现相应疾病严重者停药其他(少见)肾脏损害(间质性肾炎、NS、ARF),心血管并发症视网膜病变,听力下降,间质性肺炎停药
注:NSAIDS=非甾体抗炎药,WBC=白细胞计数,PLT=血小板计数,NS=肾病综合征,ARF=急性肾衰竭
表3不同治疗方案对MHD合并CHC患者的治疗效果
Table 3Therapeutic effects of different treatment regimens on patients with MHD and CHC
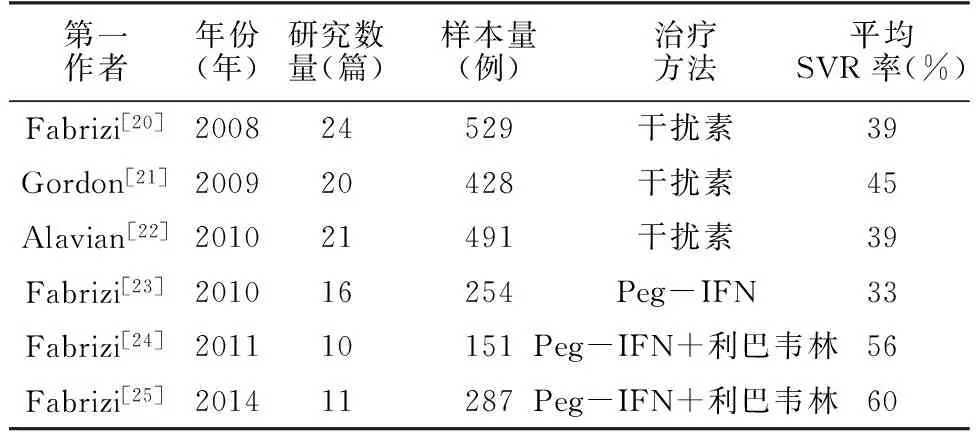
第一作者年份(年)研究数量(篇)样本量(例)治疗方法平均SVR率(%)Fabrizi[20]200824529干扰素39Gordon[21]200920428干扰素45Alavian[22]201021491干扰素39Fabrizi[23]201016254Peg-IFN33Fabrizi[24]201110151Peg-IFN+利巴韦林56Fabrizi[25]201411287Peg-IFN+利巴韦林60
注:SVR=持续病毒学应答,Peg-IFN=聚乙二醇干扰素
随着CKD的进展,CKD合并CHC的治疗选择越来越局限。然而,2011年美国食品药品监督管理局(FDA)批准上市两个NS3/4A蛋白酶抑制剂boceprevir和telaprevir,为CHC的治疗开创了新纪元,标志着DAAs时代的开始[11]。单独应用DAAs或者DAAs与干扰素或利巴韦林联用或者联用不同类型的DAAs可以获得更高的SVR率[8-10,26]。Durmortier等[27]报道了4例ESRD合并CHC患者,其对Peg-IFN联合利巴韦林治疗并无反应,而加用telaprevir后,3例患者达到了SVR。
DAAs开创了CHC治疗的新纪元,目前多种DAAs处于临床试验阶段,但是,新型药物在肾功能受损患者的临床研究很少,缺乏临床应用证据。boceprevir、telaprevir和simeprevir主要经肝脏代谢,很少经肾脏排泄,而且研究显示,普通人与ESRD患者boceprevir的药代动力学指标无差异,可能肾功能受损与否对这些药物的应用并无影响[28]。尽管肾功能受损患者并不需要调整boceprevir的用量,但是缺乏标准治疗与该药联合应用的研究,因而目前并不推荐将该药应用于晚期肾衰竭患者[29]。而已上市的NS5B聚合酶抑制剂sofosbuvir经肾脏代谢,对于早期CKD患者不需要调整剂量,而对于ESRD患者不推荐应用,2014年欧洲HCV感染诊治指南也明确指出,sofosbuvir不可用于eGFR<30 ml·min-1·(1.73 m2)-1或晚期肾脏病患者[5]。
3总结与展望
目前血液制品筛查严格、透析用品消毒规范,但是,在CKD患者中HCV感染率仍偏高。尽管CKD合并CHC患者较普通CHC患者肝脏并发症发展较慢,然而,HCV感染降低了CKD患者的生存期,威胁着CKD患者的生命健康。虽然以干扰素为核心的抗病毒治疗不良反应大,但是持续的病毒缓解可以降低肝脏并发症,延长患者生存期。近几年,随着DAAs的发展,CKD合并CHC患者可供选择的治疗药物也越来越多,但尚无该人群中DAAs疗效、安全性及合适剂量的研究,仍待进一步探索。
作者贡献:吴逸如进行资料收集整理及撰写论文,成文并对文章负责;刘莎进行试验设计与实施;刘文虎进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Elamin S,Abu-Aisha H.Prevention of hepatitis B virus and hepatitis C virus transmission in hemodialysis centers:review of current international recommendations[J].Arab J Nephrol Transplant,2011,4(1):35-47.
[2]Fissell RB,Bragg-Gresham JL,Woods JD,et al.Patterns of hepatitis C prevalence and seroconversion in hemodialysis units from three continents:the DOPPS[J].Kidney Int,2004,65(6):2335-2342.
[3]Fabrizi F,Dixit V,Messa P.Impact of hepatitis C on survival in dialysis patients:a link with cardiovascular mortality? [J].J Viral Hepat,2012,19(9):601-607.
[4]Alter MJ.Epidemiology of hepatitis C virus infection[J].World J Gastroenterol,2007,13(17):2436-2441.
[5]European Association for Study of Liver.EASL Clinical Practice Guidelines:nlanagement of hepatitis C virus infection[J].J Hepatol,2014,60(2):392-420.
[6]Matsuura K,Tanaka Y.Natural history of hepatitis C virus infection[J].Nihon Rinsho,2015,73(2):195-200.
[7]Ascione A,De Luca M,Tartaglione MT,et al.Peginterferon alfa-2a plus ribavirin is more effective than peginterferon alfa-2b plus ribavirin for treating chronic hepatitis C virus infection[J].Gastroenterology,2010,138(1):116-122.
[8]Manns M,Marcellin P,Poordad F,et al.Simeprevir with pegylated interferon alfa 2a or 2b plus ribavirin in treatment-naive patients with chronic hepatitis C virus genotype 1 infection(QUEST-2):a andomized,double-blind,placebo-controlledphase 3 trial[J].Lancet,2014,384(9941):414-426.
[9]Sulkowski MS,Gardiner DF,Rodriguez-Torres M,et al.Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection[J].N Engl J Med,2014,370(3):211-221.
[10]Lawitz E,Sulkowski MS,Ghalib R,et al.Simeprevir plus sofosbuvir,with or without ribavirin,to treat chronic infection with hepatitis C virus genotype 1 in non-responders to pegylated interferon and ribavirin and treatment-naive patients:the COSMOS randomized study[J].Lancet,2014,384(9956):1756-1765.
[11]Fontanges T.Management of treatment with direct-acting antiviral(DAA) in clinical practice[J].Clin Res Hepatol Gastroenterol,2011,35(Suppl 2):S64-68.
[12]Patel PR,Thompson ND,Kallen AJ,et al.Epidemiology,surveillance,and prevention of hepatitis C virus infections in hemodialysis patients[J].Am J Kidney Dis,2010,56(2):371-378.
[13]Espinosa M,Hernàndez J,Arenas MD,et al.Pegylated interferon(alone or with ribavirin) for chronic hepatitis C in haemodialysis population[J].Kidney Blood Press Res,2015,40(3):258-265.
[14]Okuda K,Yokosuka O.Natural history of chronic hepatitis C in patients on hemodialysis:case control study with 4-23 years of follow up[J].World J Gastroenterol,2004,10(15):2209-2212.
[15]Trevizoli JE,de Paula Menezes R,Ribeiro Velasco LF,et al.Hepatitis C is less aggressive in hemodialysis patients than in nonuremic patients[J].Clin J Am Soc Nephrol,2008,3(5):1385-1390.
[16]Fabrizi F,Messa P,Martin P.Impact of hemodialysis therapy on hepatitis C virus infection:a deeper insight[J].Int J Artif Organs,2009,32(1):1-11.
[17]Rostaing L,Peres C,Tkaczuk J,et al.Ex vivo flow cytometry determination of intracytoplasmic expression of IL-2,IL-6,IFN-gamma and TNF-alpha in monocytes and Tlymphocytes,in chronic hemodialysis patients[J].Am J Nephrol,2000,20(1):18-26.
[18]Kidney Disease:Improving Global Outcomes(KDIGO).KDIGO clinical practice guidelines for the prevention,diagnosis,evaluation,and treatmentof hepatitis C in chronic kidney disease[J].Kidney Int Suppl,2008(109):S1-99.
[19]中华人民共和国卫生部.血液净化标准操作规程2010版[M].北京:人民军医出版社,2010.
[20]Fabrizi F,Ganeshan SV,Lunghi G,et al.Antiviral therapy of hepatitis C in chronic kidney diseases:meta-analysis of controlled clinical trials[J].J Viral Hepat,2008,15(8):600-606.
[21]Gordon CE,Uhlig K,Lau J,et al.Interferon for hepatitis C virus in hemodialysis-an individual patient meta-analysis of factors associated with sustained virological response[J].Clin J Am Soc Nephrol,2009,4(9):1449-1458.
[22]Alavian SM,Tabatabaei SV.Meta-analysis of factors associated with sustained viral response in patients on hemodialysis treated with standard or pegylated interferon for hepatitis C infection[J].Iran J Kidney Dis,2010,4(3):181-194.
[23]Fabrizi F,Dixit V,Messa P,et al.Pegylated interferon monotherapy of chronic hepatitis C in dialysis patients:meta-analysis of clinical trials[J].J Med Virol,2010,82(5):768-775.
[24]Fabrizi F,Dixit V,Martin P,et al.Combined antiviral therapy of hepatitis C virus in dialysis patients:meta analysis of clinical trials[J].J Viral Hepat,2011,18(7):e263-269.
[25]Fabrizi F,Dixit V,Messa P,et al.Antiviral therapy(pegylated interferon and ribavirin) of hepatitis C in dialysis patients:meta-analysis of clinical studies[J].J Viral Hepat,2014,21(10):681-689.
[26]Lawitz E,Mangia A,Wyles D,et al.Sofosbuvir for previously untreated chronic hepatitis C infection[J].N Engl J Med,2013,368(20):1878-1887.
[27]Durmortier J,Guillaud O,Gagnieu MC,et al.Anti-viral triple therapy with telaprevir in haemodialysed HCV patients:is it feasible?[J].J Clin Virol,2013,56(2):146-149.
[28]Treitel M,Marbury T,Preston RA,et al.Single-dose pharmacokinetics of boceprevir in subjects with impaired hepatic or renal function[J].Clin Pharmacokinet,2012,51(9):619-628.
[29]Ghany MG,Nelson DR,Strader DB,et al.An update on treatment of genotype 1 chronic hepatitis C virus infection:2011 practice guidelines by the American Association for the Study of Liver Diseases[J].Hepatology,2011,54(4):1433-1444.
(本文编辑:陈素芳)
Research Progress of Chronic Kidney Disease Combined With Chronic Hepatitis C
WUYi-ru,LIUSha,LIUWen-hu.
DepartmentofNephrology,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China
【Abstract】Infection with hepatitis C virus(HCV) is highly prevalent among chronic kidney disease(CKD) patients.In developed countries,the infection rate of HCV is 7%-40% among CKD patients.HCV infection in CKD patients is associated with an increase in mortality,so antiviral treatment may improve the prognosis of this kind of patients.However,the diagnosis and treatment of CKD combined with chronic hepatitis C(CHC) are complicated and there is a lack of experience in its diagnosis and treatment.The paper made a review of the diagnosis and treatment of CKD combined with CHC.
【Key words】Kidney diseases;Hepatitis C,chronic;Antiviral agents;Review literature as topic
基金项目:国家自然科学基金资助项目(81300607);北京市科技计划课题(D131100004713001)
通信作者:刘文虎,100050北京市,首都医科大学附属北京友谊医院肾内科,首都医科大学肾病学系;E-mail:liuwenhu2013@163.com
【中图分类号】R 692 R 512.6
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.15.019
(收稿日期:2015-07-24;修回日期:2016-01-07)
