含人干细胞白血病基因慢病毒载体转染Cajal样间质细胞的效果研究
2016-06-07于建超王勤章王江平李应龙王新敏
于建超,王勤章,王江平,钱 彪,李应龙,王新敏,倪 钊,李 强
·论著·
含人干细胞白血病基因慢病毒载体转染Cajal样间质细胞的效果研究
于建超,王勤章,王江平,钱 彪,李应龙,王新敏,倪 钊,李 强
832000 新疆石河子市,石河子大学医学院附属第一医院泌尿外科
【摘要】目的观察携带增强绿色荧光蛋白(GFP)的含人干细胞白血病(SCL)基因慢病毒载体转染体外培养的豚鼠膀胱Cajal样间质细胞(ICC)的效果。方法2014年10月—2015年8月,选取普通级成年健康豚鼠16只。构建含人SCL基因的慢病毒载体,并标定病毒滴度;采用随机数字表法选取健康豚鼠4只,采用颈椎脱臼方法将其杀死,体外培养豚鼠膀胱ICC。设置不同感染复数(MOI)(0.5、1.0、5.0、10.0、50.0、100.0),利用含人SCL基因的慢病毒载体转染ICC,在激光共聚焦显微镜下观察ICC生长状态并计算转染效率,确定最佳MOI。采用随机数字表法将ICC分为正常对照组、空白质粒对照组与慢病毒转染组,其中正常对照组加入1%磷酸盐缓冲液(PBS),空白质粒对照组加入空慢病毒,慢病毒转染组按最佳MOI加入含人SCL基因的慢病毒载体,计算各组转染效率,确定最佳转染时间。采用反转录-聚合酶链式反应(RT-PCR)法检测SCL mRNA表达情况。上述实验均独立重复4次。结果经测定,病毒滴度为5×108 TU/ml。倒置显微镜下发现一些特征性梭形细胞,其两侧有显著外凸分枝,细胞核较大,其外形规则,有序地实现细胞贴壁,而其他未贴壁细胞则呈现与ICC不一样的形态,胞体多为椭圆形,细胞两极无突起,整体形状扁平。激光共聚焦显微镜下可以发现酪氨酸蛋白激酶生长因子受体(c-kit)受体成功表达,证实培养的细胞是膀胱ICC。观察各组ICC生长状态,当MOI为0.5、1.0、5.0、10.0时,细胞生长状态较好,无细胞死亡,当MOI为50.0、100.0时,可见部分细胞死亡,细胞活性降低;MOI为1.0、5.0、10.0、50.0、100.0时的转染效率高于MOI为0.5时(P<0.05);MOI为5.0、10.0、50.0、100.0时的转染效率高于MOI为1.0时(P<0.05);MOI为10.0、50.0、100.0时的转染效率高于MOI为5.0时(P<0.05);MOI为50.0、100.0时的转染效率高于MOI为10.0时(P<0.05);综合ICC生长状态及转染效率,确定含人SCL基因慢病毒载体转染ICC的最佳MOI为10.0。正常对照组、空白质粒对照组ICC中无GFP表达;慢病毒转染组转染3 d时ICC中GFP表达强度高于转染2 d、转染5 d时,确定含人SCL基因慢病毒载体转染ICC的最佳转染时间为3 d。慢病毒转染组中扩增产物大小与目的片段大小1 036 bp一致,而正常对照组及空白质粒对照组均未见特异性条带表达,表明SCL基因成功导入ICC。结论利用含人SCL基因慢病毒载体能高效转染体外培养的ICC,并成功介导SCL基因在ICC中的表达,为下一步研究利用SCL基因进行体内转染实验奠定基础。
【关键词】转染;干细胞白血病基因;慢病毒载体;Cajal样间质细胞
于建超,王勤章,王江平,等.含人干细胞白血病基因慢病毒载体转染Cajal样间质细胞的效果研究[J].中国全科医学,2016,19(15):1796-1802.[www.chinagp.net]
Yu JC,Wang QZ,Wang JP,et al.Effect of transfecting human SCL gene lentiviral vectors into Cajal-like cells[J].Chinese General Practice,2016,19(15):1796-1802.
糖尿病膀胱异常病症(DCP)是糖尿病末期出现频率最高的并发症之一,在糖尿病患者中的发病率为19%~84%[1-2]。DCP在发病末期会出现尿路感染、肾炎等,之后发展成尿毒症[3-4]。相关研究发现,神经生长因子(nerve growth factor,NGF)水平下降、氧化自由基形成、糖代谢异常、前列腺素E2(PGE2)水平下降、线粒体氧化应激产物(reactive oxygen species,ROS)增多、血管的供应减少等可能导致DCP的发生[5-7],但其具体发病机制目前尚不明确。近年研究发现,在人类、豚鼠等很多动物的膀胱逼尿肌中存在着一种与胃肠道Cajal样间质细胞(interstitial cells of Cajal,ICC)形态类似的特殊细胞,称之为膀胱ICC[8-9]。膀胱逼尿肌会出现一系列自发性收缩,此收缩现象完全受到ICC的调节,而膀胱起搏细胞即为ICC[10-11]。对于DCP患者而言,由于高血糖的诱导,ICC不断萎缩或消失,造成干细胞因子(SCF)/酪氨酸蛋白激酶生长因子受体(c-kit)信号通路传输功能受损[12],进而导致膀胱感觉降低、尿储存量升高、排尿阶段逼尿肌收缩性减弱、膀胱剩余尿量变多等不适,致使膀胱功能完全瘫痪甚至失效。ICC存在两个关键受体,分别是特异性蛋白受体c-kit和其配体SCF,c-kit和SCF特异性结合后启动SCF/c-kit信号通路。研究发现,干细胞白血病(SCL)基因属于c-kit上端的必不可少的调控遗传基因,能够增强c-kit 基因表达,进而促进DCP中ICC表型及功能的恢复[13]。因此,SCF/c-kit信号通路传输功能的好转,对推动ICC功能的逆转发挥关键性作用,对于DCP的临床治疗发挥重要的引导作用。本研究组设想,可将含人SCL基因慢病毒载体通过细胞转染技术感染形态和功能被破坏的ICC,进而促进ICC数量及功能恢复。为此,本研究利用含人SCL基因慢病毒载体转染体外培养的ICC,并研究其转染效果及SCL基因在ICC中的表达情况,为进一步利用含人SCL基因慢病毒载体进行体内转染实验及DCP治疗提供新的思路。
1材料与方法
1.1实验动物2014年10月—2015年8月,选取普通级成年健康豚鼠16只,雌雄不限,鼠龄6~12个月,体质量250~400 g。购自新疆医科大学动物实验中心。
1.2实验材料DMEM培养基、胎牛血清(FBS)、Lipofectamine 2000转染试剂盒(Invitrogen公司);反转录-聚合酶链式反应(RT-PCR)试剂盒(Fermentas公司);携带增强绿色荧光蛋白(GFP)的含人SCL基因慢病毒载体(由上海吉凯基因化学技术有限公司协助合成)。
1.3含人SCL基因慢病毒载体的构建及鉴定
1.3.1含人SCL基因质粒的PCR扩增对含人SCL基因质粒进行PCR扩增,上游引物为5′-GAGGATCCCCGGGTACCGGTCGCCACCATGACCGAGCGGCCGCCGAG-3′,下游引物为5′-TCACCATGGTGGCGACCGGCCGAGGGCCGGCTCCATC-3′,由上海吉凯基因化学技术有限公司合成。PCR反应条件:94 ℃变性30 s,55 ℃退火40 s,72 ℃延伸1 min,共30个循环,最后1个循环72 ℃延伸10 min。
1.3.2构建含人SCL基因慢病毒载体将含人SCL基因质粒的PCR扩增产物提纯,通过In-Fusion转换酶的催化将含人SCL基因质粒的PCR扩增产物与GV287-EGFP结合,形成重组质粒GV287-EGFP/SCL,即含人SCL基因慢病毒载体。
1.3.3筛选含人SCL基因慢病毒载体提取重组质粒GV287-EGFP/SCL阳性克隆菌落PCR模板上的交换转化产物,长出菌落后加入到10 μl培养基混匀,抽取1 μl混合物设置模板,通过PCR法实现基因扩增,与阳性转化子对接后分装测序。
1.3.4包装含人SCL基因慢病毒载体并测定病毒滴度以293T细胞为包装细胞,制备编码慢病毒的重组病毒质粒及其2种辅助包装原件载体质粒,3种质粒分别进行高纯度无内毒素抽提,按Lipofectamine 2000转染试剂盒使用说明共转染293T细胞,转染8 h后更换为完全培养基,培养48 h,收集含人SCL基因慢病毒载体的细胞上清液,对其浓缩后得到高滴度的含人SCL基因慢病毒载体浓缩液,用荧光法在293T细胞中测定病毒滴度。
1.4豚鼠膀胱ICC体外培养及鉴定
1.4.1体外培养ICC采用随机数字表法选取健康豚鼠4只,采用颈椎脱臼方法将其处死,在无菌环境中取出膀胱组织,于显微镜下用眼科剪把膀胱组织捣碎至1 mm3,并放置在1.0 mg/ml胰蛋白酶里,于37 ℃下消化15 min,加入DMEM培养基(内含1.0 mg/ml V型胶原酶、100 U/ml青霉素、100 g/ml链霉素),于37 ℃ 5% CO2培养箱内消化90 min。超净台下严格无菌操作,将消化好的絮状液过滤,1 500 r/min离心5 min(离心半径13 cm)。过滤上清液并丢弃,采用1%磷酸盐缓冲液(PBS)漂洗,1 500 r/min离心5 min(离心半径13 cm),重复离心3次,过滤溶液中的残渣、酶和已污染的微生物;通过移液管全面吹打单细胞悬液,接种到6孔培养皿中,加入含有10% FBS、1%双抗(100 U/ml青霉素、100 g/ml链霉素)的低糖DMEM培养基,37 ℃ 5% CO2培养箱内培养。接种24 h后,采用倒置显微镜观察细胞,把未贴壁的平滑肌细胞过滤掉,将已贴壁的ICC放置在培养皿中,72 h后通过ICC特异性标志物c-kit抗体做免疫测试鉴定。
1.4.2免疫测试鉴定ICC在6孔培养板各孔中放置无菌消毒的载玻片,采用移液器将ICC悬液移至载玻片中间位置,加入约1 ml培养基,接种8 h后再加入1 ml培养基;培养48 h后用镊子取出细胞爬片,用抗体稀释液分别稀释特异性一抗(大鼠抗小鼠的单克隆c-kit抗体)和二抗(异硫氰酸荧光素标记的兔抗大鼠抗体),使其工作浓度达1∶100;1% PBS漂洗3次,15 min/次;室温条件下用100%丙酮溶液固定15 min,风干后再次1% PBS漂洗3次,15 min/次;采用0.03% H2O2溶液将内源性过氧化物酶密封处理约0.5 h;1% PBS漂洗3次,5 min/次;室温条件下用1% FBS清蛋白开展孵化实验,共0.5 h;缓慢吸取孵化液,与经过稀释的1 μl一抗(大鼠抗小鼠的单克隆c-kit抗体,1∶100)融合,湿盒内室温孵育2 h后置于-4 ℃冰箱继续孵育48 h;1% PBS漂洗3次,5 min/次;室温条件下,与二抗(FITC标记荧光兔抗大鼠抗体)避光孵育60 min;1% PBS漂洗3次,5 min/次;在细胞爬片上滴加50%甘油溶液,用盖玻片封闭,吸去周围渗出的甘油,风干3~5 min后在激光共聚焦显微镜下观察c-kit受体表达情况。
1.5确定含人SCL基因慢病毒载体转染ICC的最佳感染复数(multiplicities of infection,MOI)参照慢病毒转染手册(由上海吉凯基因化学技术有限公司提供),设置不同MOI(0.5、1.0、5.0、10.0、50.0、100.0),ICC中加入5×108TU/ml的含人SCL基因慢病毒载体,同时加入10 μg/ml的聚凝胺(Polybrene);置于温箱中,培养8~12 h后在显微镜下观察各MOI下的细胞状态,弃去培养基,加入新鲜配制的完全培养基;继续培养48 h后,在激光共聚焦显微镜下观察ICC生长状态并计算转染效率〔转染效率=(表达GFP的细胞数/总细胞)×100%〕,确定最佳MOI。
1.6确定含人SCL基因慢病毒载体转染ICC的最佳转染时间以3×104~5×104个/ml将ICC接种于96孔培养板中,体积为90 μl。采用随机数字表法将ICC分为正常对照组、空白质粒对照组与慢病毒转染组,其中正常对照组加入1% PBS,空白质粒对照组加入空白慢病毒,慢病毒转染组按最佳MOI加入含人SCL基因慢病毒载体,同时加入10 μg/ml的聚凝胺。培养24 h后用移液器吸去培养基,1% PBS漂洗2次,加入1 ml新鲜配制的含10% FBS的DMEM培养液继续培养。分别在转染2、3、5 d时,采用激光共聚焦显微镜,沿单孔板垂直于水平连续视野(约0.77 mm2/视野),连续观测20个视野(×200),通过观察GFP表达强度来确定最佳转染时间。
1.7RT-PCR法检测SCL mRNA表达情况分别在转染2、3、5 d时提取ICC总RNA,采用RT-PCR法分析SCL mRNA的表达情况。SCL上游引物为5′-GAGGATCCCCGGTACCGGTCGCCACCATGCGAGCGGCCGCCGAG-3′,下游引物为5′-TCACCATGGTGGCGACCGACCGGCCGAGGGCCGGCTCCATC-3′,大小约为1 036 bp;GAPDH上游引物为5′-ACCACAGTCCATGCCATCAC-3′,下游引物为5′-TCCACCACCCTGTTGCTGTA-3′,大小约为456 bp。PCR反应条件:94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,共30个循环,最后1个循环72 ℃延伸10 min。行琼脂糖凝胶电泳,采用凝胶分析系统进行凝胶成像及灰度分析,检测各组ICC中SCL mRNA表达情况。
上述实验均独立重复4次。
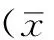
2结果
2.1病毒滴度经测定,病毒滴度为5×108TU/ml。
2.2ICC体外培养及鉴定结果
2.2.1ICC体外培养结果倒置显微镜下发现一些特征性梭形细胞,其两侧有显著外凸分枝,细胞核较大,细胞质中存在一些黑色糖原粒子,其外形规则,有序地实现细胞贴壁(见图1,本文图1~5彩图见本刊官网www.chinagp.net电子期刊相应文章附件),而其他未贴壁细胞则呈现与ICC不一样的形态,胞体多为椭圆形,细胞两极无突起,整体形状扁平(见图2)。
2.2.2ICC鉴定结果激光共聚焦显微镜下可以发现c-kit受体成功表达,证实培养的细胞是膀胱ICC(见图3)。
2.3ICC生长状态及转染效率比较观察各组ICC生长状态,当MOI为0.5、1.0、5.0、10.0时,细胞生长状态较好,无细胞死亡,当MOI为50.0、100.0时,可见部分细胞死亡,细胞活性降低(见图4)。不同MOI下转染效率比较比较,差异有统计学意义(P<0.05);其中MOI为1.0、5.0、10.0、50.0、100.0时的转染效率高于MOI为0.5时,差异有统计学意义(P<0.05);MOI为5.0、10.0、50.0、100.0时的转染效率高于MOI为1.0时,差异有统计学意义(P<0.05);MOI为10.0、50.0、100.0时的转染效率高于MOI为5.0时,差异有统计学意义(P<0.05);MOI为50.0、100.0时的转染效率高于MOI为10.0时,差异有统计学意义(P<0.05,见表1)。综合ICC生长状态及转染效率,确定含人SCL基因慢病毒载体转染ICC的最佳MOI为10.0。
2.4GFP表达强度比较正常对照组、空白质粒对照组ICC中无GFP表达;慢病毒转染组转染3d时ICC中GFP表达强度高于转染2d、转染5d时(见图5),确定含人SCL基因慢病毒载体转染ICC的最佳转染时间为3d。
2.5SCLmRNA表达情况慢病毒转染组中扩增产物大小与目的片段大小1 036bp一致,而正常对照组及空白质粒对照组均未见特异性条带表达,表明SCL基因成功导入ICC(见图6)。
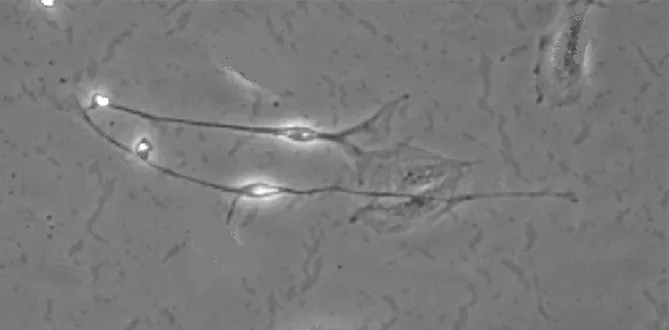
图1细胞接种24h后,倒置显微镜下可见梭形细胞,其两侧有显著外凸分枝(×200)
Figure 124 h after cellinoculation,pindle cells were observed under inverted microscope,both sides had significant convex branches
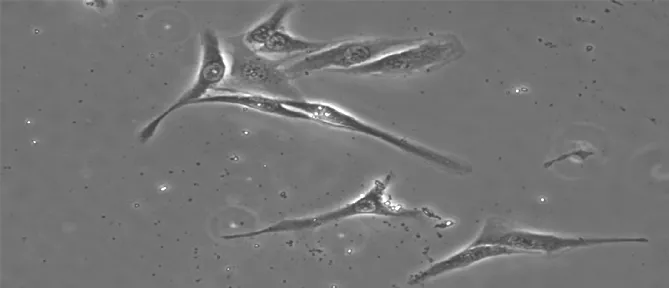
图2平滑肌细胞胞体多为椭圆形,细胞两极无突起,整体形状扁平(×200)
Figure 2The soma of smooth muscle cells was oval,two polar of the cell had no protuberance,overall shape was flat
图3 c-kit受体免疫荧光实验阳性(×200)
注:A为MOI=0.5,B为MOI=1.0,C为MOI=5.0,D为MOI=10.0,E为MOI=50.0,F为MOI=100.0
图4不同MOI下ICC生长状态(×200)
Figure 4The growth state of ICC at different MOI values
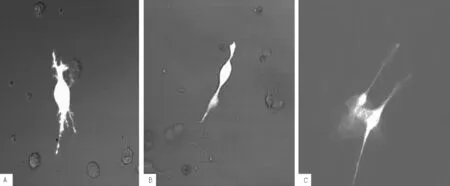
注:A为转染2 d,B为转染3 d,C为转染5 d
图5慢病毒转染组GFP表达强度
Figure 5Expression intensity of GFP in lentivirus transfection group
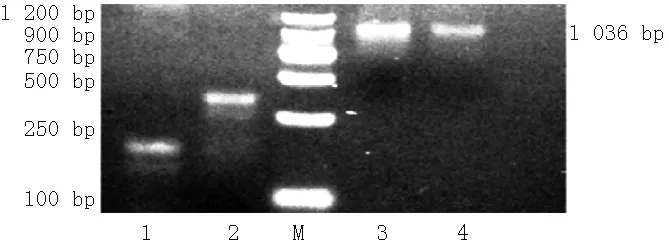
注:1为正常对照组,2为空白质粒对照组,3、4为慢病毒转染组,M为Marker
图6 琼脂糖凝胶电泳图
注:MOI=感染复数;与MOI=0.5比较,aP<0.05;与MOI=1.0比较,bP<0.05;与MOI=5.0比较,cP<0.05;与MOI=10.0比较,dP<0.05
3讨论
研究发现,ICC可以控制膀胱逼尿肌的自发性兴奋与收缩,运用膜片钳方法检测到膀胱ICC可自发性产生动作电位,阻断ICC动作电位后,逼尿肌细胞的收缩明显被抑制[14]。有学者认为,ICC具有起搏膀胱活动和传导神经信息的功能[14-16]。而在糖尿病患者膀胱逼尿肌中,ICC水平较低,并出现不正常分布或自发兴奋减弱,进而促进DCP形成[17]。相关研究发现,ICC的表达与其特异性酪氨酸激酶受体c-kit密切相关,成功激活SCF/c-kit信号通路之后,该信号通路能够维持ICC的外形和生理特性[18]。SCL属于一个转录因子,能够调节c-kit的表达及其功能,并不会和DNA进行对接[19]。鉴于SCL在ICC发育中的关键作用,本研究组设想,可通过基因技术构建含人SCL基因慢病毒载体,然后转染体外培养的ICC,增加SCL的表达,逆转ICC表型和功能的恢复,为进一步探究DCP的基因治疗提供相关资料。
本研究组根据膀胱平滑肌细胞与膀胱ICC贴壁的时间不同,收获目的细胞。接种24 h后,可以发现ICC已经开始贴着培养板底壁,而在培养板底壁未发现膀胱平滑肌细胞,此时把未贴壁的平滑肌细胞过滤掉,可得到相对纯化的膀胱ICC。倒置显微镜下发现一些特征性梭形细胞,其两侧有显著外凸分枝,细胞核较大,其外形规则,有序地实现细胞贴壁,而其他未贴壁细胞胞体多为椭圆形,细胞两极无突起,整体形状扁平。激光共聚焦显微镜下可以发现c-kit受体成功表达,证实培养的细胞是膀胱ICC。采用差速贴壁法提取的膀胱ICC数量相对较多、纯度较高,但仍可观察到平滑肌细胞。此方法操作简单,时间相对较短,能为后续的实验提供足够的细胞。
随着基因工程的不断发展,基因转染的实验工具日趋增多,如质粒、脂质体、慢病毒和腺病毒。慢病毒作为一种常用的基因载体,是经人类免疫缺陷病毒-1(HIV- 1)改造而成,其生物活性仍然存在而其毒性已被灭活,且免疫原性低,生物安全性较好[20]。病毒载体经基因重组技术能高效地整合目的基因于宿主细胞中,不易引起插入突变,目的基因能够持续、稳定表达,并对分裂期和非分裂期的细胞均有较高的感染率,是一种理想的基因工具,能够用来开展体内、外转染相关实验。本实验慢病毒是通过三质粒系统进行包装,此包装系统含有编码慢病毒的重组病毒质粒及其2种辅助包装原件载体质粒,对于编码质粒和辅助质粒而言,二者具有反正式互补的功能,同时辅助包装质粒的结构由pHelper1.0载体和pHelper2.0载体质粒构成。此操作方法相对简单,慢病毒重组率、产率均不低,同时可以较高水平表达目的基因。经测定,病毒滴度为5×108TU/ml,此滴度保证了本研究及后续实验的需求[21]。慢病毒虽已被剔除毒性基因,但其生物学危害并未完全丧失,属于“自杀”性病毒,仍具有一定的细胞毒性。研究发现,慢病毒转染效果与MOI密切相关,MOI过高可导致部分细胞死亡[22],因此适当的MOI很重要。本研究结果显示,当MOI为0.5、1.0、5.0、10.0时,细胞生长状态较好,无细胞死亡,当MOI为50.0、100.0时,可见部分细胞死亡,细胞活性降低;MOI为1.0、5.0、10.0、50.0、100.0时的转染效率高于MOI为0.5时,MOI为5.0、10.0、50.0、100.0时的转染效率高于MOI为1.0时,MOI为10.0、50.0、100.0时的转染效率高于MOI为5.0时,MOI为50.0、100.0时的转染效率高于MOI为10.0时;综合ICC生长状态及转染效率,确定含人SCL基因慢病毒载体转染ICC的最佳MOI为10.0。GFP是一种对细胞没有生物毒性的荧光蛋白,能够在激光共聚焦显微镜下受蓝色激光激发而产生持续稳定的绿色荧光,通常作为标志物或报告基因来检测细胞或者活体组织。本研究结果显示,正常对照组、空白质粒对照组ICC中无GFP表达;慢病毒转染组转染3 d时ICC中GFP表达强度高于转染2 d、转染5 d时,确定含人SCL基因慢病毒载体转染ICC的最佳转染时间为3 d。因此MOI为10.0、转染72 h时,含人SCL基因慢病毒载体转染ICC的转染效率最高、生物活性最高、安全性最高。RT-PCR结果表明,慢病毒转染组中扩增产物大小与目的片段大小1 036 bp一致,而正常对照组及空白质粒对照组均未见特异性条带表达,表明SCL基因成功导入ICC。
本研究尚存在一定的局限性,本实验细胞离体培养导致其脱离机体的内环境,可能失去了细胞维持或辅助信号,或者失去了与其他细胞或者蛋白之间的联系与反应,体外实验的结果可能不能完全解释体内的情况,所以利用含人SCL基因慢病毒载体转染DCP豚鼠膀胱或者其他在体实验,能否取得相同的的结果,还有待进一步研究。
综上所述,利用含人SCL基因慢病毒载体能高效转染体外培养的ICC,并成功介导SCL在ICC中的表达,为下一步研究利用SCL基因进行体内转染实验奠定基础。
作者贡献:于建超进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;王江平、钱彪、李应龙、王新敏、倪钊、李强进行实验实施、评估、资料收集;王勤章进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Xu Y,Wang L,He J,et al.Prevalence and control of diabetes in Chinese adults[J].JAMA,2013,310(9):948-959.
[2]Liu G,Daneshgari F.Diabetic bladder dysfunction[J].Chin Med J,2014,127(7):1357-1364.
[3]Lin TL,Chen GD,Chen YC,et al.Aging and recurrent urinary tract infections are associated with bladder dysfunction in type 2 diabetes[J].Taiwan J Obstet Gynecol,2012,51(3):381-386.
[4]Gomez CS,Kanagarajah P,Gousse AE.Bladder dysfunction in patients with diabetes[J].Curr Urol Rep,2011,12(6):419-426.
[5]Oberbach A,Jehmlich N,Schlichting N,et al.Molecular fingerprint of high fat diet induced urinary bladder metabolic dysfunction in a rat model[J].PLoS One,2013,8(6):e66636.
[6]Li Y,Sun Y,Zhang Z,et al.Cannabinoid receptors 1 and 2 are associated with bladder dysfunction in an expenrimental diabetic rat model[J].BJU Int,2013,112(2):E140-150.
[7]Leiria LO,Mónica FZ,Carvalho FD,et al.Functional,morphological and molecular characterization of bladder dysfunction in streptozotocin-induced diabetic mice:evidence of a role for L-type voltage-operated Ca2+channels[J].Br J Pharmacol,2011,163(6):1276-1288.
[8]Briggs Boedtkjer D,Rumessen J,Baandrup U,et al.Identification of interstitial Cajal-1ike ceils in the human thoracic duct[J].Cells Tissues Organs,2013,197(2):145-148.
[9]Wang JP,Ding GF,Wang QZ.Interstitial cells of Cajal mediate excitatory sympathetic neurotransmission in guinea pig prostate[J].Cell Tissue Res,2013,352(3):479-486.
[10]Yin Z,Yang JR.Bladder interstitial cells and pathophysiology[J].Journal of Central South University(Medical Science),2014,39(6):644-648.(in Chinese)
尹焯,杨金瑞.膀胱间质细胞与膀胱病理生理[J].中南大学学报:医学版,2014,39(6):644-648.
[11]Zhang YG,He XW,Zhang W,et al.Excitability change and significance of interstitial cells of Cajal in rat bladder with detrusor hyperreflexia[J].Journal of Clinical Urology,2015,254(2):168-171.(in Chinese)
张永革,何晓伟,张伟,等.逼尿肌反射亢进大鼠膀胱ICC细胞兴奋性变化及意义[J].临床泌尿外科杂志,2015,254(2):168-171.
[12]Wang QZ,Ji SQ,Zhu GD,et al.The morphologic changes and significance of interstitial cells of Cajal-like cells in the bladder of diabetic guinea pig[J].Chinese Journal of Clinical and Experimental Pathology,2009,25(6):631-634.(in Chinese)
王勤章,纪世琪,朱国栋,等.糖尿病豚鼠膀胱Cajal样间质细胞形态学变化及意义[J].临床与实验病理学杂志,2009,25(6):631-634.
[13]Kart Y,KarakuOZ,AteO,et al.Altered expression of interstitial cells of Cajal in primary obstructive megaureter[J].J Pediatr Urol,2013,9(6 Pt B):1028-1031.
[14]Zuo DC,Choi S,Shahi PK,et al.Inhibition of pacemaker activity in interstitial cells of Cajal by LPS via NF-κB and MAP kinase[J].World J Gastroenterol,2013,28(8):1210-1218.
[15]Lee J,Kim YD,Park CG,et al.Neurotensin modulates pacemaker activity in interstitial ceils of Cajal from the mouse small intestine[J].Mol Cells,2012,33(5):509-516.
[16]Han S,Kim JS,Jung BK,et al.Effects of ginsenoside on pacemaker potentials of cultured interstitial cells of Cajal clusters from the small intestine ofmice[J].Mol Cells,2012,33(3):243-249.
[17]Sanders KM,Koh SD,Ward SM.Interstitial cells of cajal as pacemakers in the gastrointestinal tract[J].Annu Rev Physiol,2006,68:307-343.
[18]Ward SW,Sanders KM.Physiology and pathophysiology of the interstitial cell of Cajal:from bench to bedside.I.Functional developmentand plasticity of interstitial cells of Cajal networks[J].Am J Physiol Gastrointest Liver Physiol,2001,281(3):G602-611.
[19]Li F,Zhang L,Li C,et al.Adenovirus-mediated stem cell leukemia gene transfer induces rescue of interstitial cells of Cajal in ICC-loss mice[J].Int J Colorectal Dis,2010,25(5):557-566.
[20]Rusu MC,Pop F,Hostiuc S,et al.Extrahepatic and intrahepatic human portal interstitial Cajal cells[J].Anat Rec(Hoboken),201l,294(8):1382-1392.
[21]Kubo S,Kataoka M,Tateno C,et al.In vivo stable transduction of humanized liver tissue in chimeric mice via high-capacity adenovirus-lentivirus hybrid vector[J].Hum Gene Ther,2010,21(1):40-50.
[22]Wang X,Mani P,Sarkar DP,et al.Ex vivo gene transfer into hepatocytes[J].Methods Mol Biol,2009,481:117-140.
(本文编辑:崔丽红)
Effect of Transfecting Human SCL Gene Lentiviral Vectors Into Cajal-like Cells
YUJian-chao,WANGQin-zhang,WANGJiang-ping,etal.
DepartmentofSurgicalUrology,theFirstAffiliatedHospitaloftheMedicalCollege,ShiheziUniversity,Shihezi832000,China
【Abstract】ObjectiveTo transfect the lentiviral vector containing human stem cell leukemia(SCL) gene and enhanced green fluorescent protein(GFP) into Cajal-like cells cultured in vitro.MethodsDuring October 2014 to August 2015,16 CV adult healthy guinea pigs were selected as study subjects.To construct human SCL gene lentiviral expression vectors and determine virus titers,4 healthy guinea pigs were selected by random number table method and killed by cervical dislocation method,Cajal-like cells were cultured in vitro by differential adherence method.Different MOI(0.5,1.0,5.0,10.0,50.0,100.0) was set,the lentiviral vector containing human SCL gene was used to transfect into Cajal-like cells in vitro,the growth state of the Cajal-like cells was observed under laser scanning confocal microscope,and transfection efficiency was calculated,so as to determine the best MOI.The Cajal-like cells were divided into normal control group,empty plasmid control group and lentivirus transfection group by random number table method,cells in normal control group were treated with 1% phosphate buffered saline(PBS),cells in empty plasmid control group were treated with blank lentivirus,cells in lentivirus transfection group were treated with lentiviral vector containing the human SCL gene according to the best MOI,the transfection efficiency of each group was calculated respectively,the optimal transfection time was determined.The expression of SCL mRNA was measured by RT-PCR method.The above experiment was independently repeated 4 times.ResultsIt was examined that virus titers was 5×108 TU/ml.Some characteristic spindle cells were found under inverted microscope,both sides of the cells have significant convex branches,the cell nucleus was large and had regular shape,the cultured cells grew against the wall well,and other non-adherent cells presented some different shapes compared with Cajal-like cells,the overall shape of most cells was oval and flat,the two polar of cells had no protuberance.The c-kit receptor successfully expressed under laser scanning confocal microscope,it confirmed that the cultured cells were bladder Cajal-like cells.The growth state of cells in each group was observed,when MOI reached 0.5,1.0,5.0 or 10.0,the growth state was good,no cell died,when MOI reached 50.0 or 100.0,some cells died and cell activity decreased.The transfection efficiency when MOI reached 1.0,5.0,10.0,50.0 or 100.0 was higher than that when MOI reached 0.5(P<0.05).The transfection efficiency when MOI reached 5.0,10.0,50.0 or 100.0 was higher than that when MOI reached 1.0(P<0.05).The transfection efficiency when MOI reached 10.0,50.0 or 100.0 was higher than that when MOI reached 5.0(P<0.05).The transfection efficiency when MOI reached 50.0 or 100.0 was higher than that when MOI reached 10.0(P<0.05).According to Cajal-like cells growth state and transfection efficiency,to transfect lentiviral vector containing human SCL gene into Cajal-like cells,the best MOI was 10.0.No GFP expression was found in cells in normal control group and empty plasmid group.The GFP expression intensity in Cajal-like cells in lentivirus transfection group 3 days after transfection was higher than that 2 days and 5 days after transfection,respectively,thus it was determined that to transfect lentiviral vector containing human SCL gene into Cajal-like cells,the optimal transfection time was 3 days.The amplified product size was 1 036 bp,and it was consistent with the size of target fragments in lentivirus transfection group,while the normal control group and empty plasmid control group showed no expression of specific bands,which showed SCL gene was successfully transmited into Cajal-like cells.ConclusionThe lentivirus vector containing human SCL gene can efficiently transfect into Cajal-like cells in vitro,and can successfully mediated the expression of SCL gene in Cajal-like cells,the findings laid the foundations for transfection experiments using SCL gene in vivo.
【Key words】Transfection; Stem cell leukemia gene; Lentiviral vector; Cajal-like interstitial cells
基金项目:国家自然科学基金资助项目(81360120)
通信作者:王勤章,832000 新疆石河子市,石河子大学医学院附属第一医院泌尿外科;E-mail:wqz1969@sina.com
【中图分类号】R 37
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.15.012
(收稿日期:2015-10-19;修回日期:2016-03-16)
