糖尿病大鼠阴茎海绵体GSH、GGSSSSGG和GSH//GGSSSSGG 对eeNNOOSS表达的影响*
2016-06-07曹会峰胡存利罗振国杜从林桂士良佳木斯大学附属第一医院泌尿外科黑龙江佳木斯154007
曹会峰 马 龙 胡存利罗振国 杜从林 桂士良佳木斯大学附属第一医院泌尿外科(黑龙江佳木斯 154007)
糖尿病大鼠阴茎海绵体GSH、GGSSSSGG和GSH//GGSSSSGG 对eeNNOOSS表达的影响*
曹会峰 马 龙 胡存利**罗振国 杜从林 桂士良
佳木斯大学附属第一医院泌尿外科(黑龙江佳木斯 154007)
摘要目的 探究在糖尿病大鼠阴茎海绵体中还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)和GSH/ GSSG对内皮型一氧化氮合酶(eNOS)表达的影响。方法 30只SD级8周龄健康雄性大鼠,8只作为正常对照组(C组),剩余22只作为糖尿病实验组(D组);D组大鼠高脂高糖喂养4周后腹腔注射链脲佐菌素(40mg/kg)建DM模型;C组大鼠未作特殊处理。继续喂养8周后,注射阿扑吗啡(apomorphine,APO),观察阴茎勃起情况;所有大鼠测定阴茎海绵体内压/平均颈动脉压(ICPmax/MAP)后处死,采集血液、阴茎组织,测定GSH、GSSG、睾酮含量,免疫组化和 Western 印迹法检测eNOS的表达。结果 与C组相比较,D组大鼠阴茎组织中GSH含量、GSH/ GSSG比值、eNOS含量明显降低(P<0.05),而GSSG的含量明显升高(P<0.05)。结论 糖尿病大鼠阴茎海绵体中GSH和GSSG、GSH/GSSG影响eNOS的表达,在糖尿病性阴茎勃起功能障碍机制中起重要作用。
关键词糖尿病;勃起功能障碍;谷胱甘肽;一氧化氮合酶
**通讯作者,E-mail:jmsdxhcl@163.com
Key woorrddss diabetes mellitus ;erectile dysfunction;Glutathione;Nitric Oxide Synthase
勃起功能障碍(erectile dysfunction,ED)是指阴茎不能达到和(或)维持足以进行满意的性交,病程持续3个月以上。而ED患者中有35%~75%是糖尿病(DM)患者[1]。由DM诱发的ED称之糖尿病性勃起功能障碍(diabetes mellitus induced erectile dysfunction,DMED)[2]。流行病学临床调查显示,与同年龄阶段非DM男性相比,DM男性罹患ED的平均年龄要早10~15年[3]。糖尿病患者的慢性高血糖状态,过多的活性氧(reactive oxygen species,ROS)、谷胱甘肽水平下降,引起内皮受损,使内皮型一氧化氮合酶(eNOS)活性和产量降低是DMED的重要发病机制[4]。还原型谷胱甘肽(reduced glutathione,GSH)及氧化型谷胱甘肽(oxidized glutathione,GSSG)是细胞内最重要的氧化还原缓冲对之一,参与ROS介导的细胞信号通路的多个环节。本研究通过测定糖尿病大鼠阴茎中的GSH、GSSG、GSH/GSSG 与eNOS,探究GSH、GSSG、GSH/GSSG对eNOS的影响,及在DMED中的作用。
材料及方法
一、主要试剂及仪器
链脲佐菌素(streptorotocin,STZ,Sigma公司),阿扑吗啡(apomorphine,APO,Sigma公司),血糖仪及试纸(三诺生物技术传感股份有限公司),GSH 和GSSG检测试剂盒(上海碧云天生物技术有限公司),兔抗大鼠NOS3 IgG(Santa Cruz Biotechnology公司),HRP标记的鼠抗兔IgG(Santa Cruz Biotechnology公司),BCA蛋白浓度测定试剂盒(增强型)(上海碧云天生物技术有限公司),bio-tek多功能酶标仪(美国Biotek公司),转移电泳槽(上海天能科技有限公司),数显式稳压稳流电泳仪(上海天能科技有限公司),eNOS生物素-链霉卵白素免疫组化检测试剂盒(北京中杉金桥生物技术有限公司),Pclab-UE生物医学信号采集系统。
二、实验动物及饲料
8周龄健康SD雄性大鼠30只(哈尔滨医科大学动物实验中心),体质量为(233±12)g。高脂高糖饲料,配方:5%蔗糖+10%猪油+1.5%胆固醇(江苏省协同医药生物工程有限公司)。
三、动物分组及2型糖尿病模型建立
1.SD雄性大鼠适应性喂养2周后分组;随机选取8只,为对照组(C组),普通大鼠饲料喂养;剩余22只大鼠作为实验组(D组),给予高脂高糖饲料饮食。所有大鼠充足饮水,室温(26±2)℃,湿度(60±5)%,半天光照,半天黑暗。
2.STZ的配置及注射 柠檬酸用双蒸水配成A液,柠檬酸钠用双蒸水配成B液;注射前将A、B液按1:1.32的比例配成0.1mmol/L的缓冲液,调节pH=4.35;称取STZ,于暗处冰浴中配成1%STZ溶液。按40mg/kg,30min内腹腔注射完毕;注射后禁食4h并给予5%葡萄糖皮下注射;3d后测血糖,未成模者半剂量追加给药;注射一周后测定空腹血糖,以血糖>16.7mmol/L为DM造模成功。
四、AAPPOO实验
大鼠建模8w后,暗室适应10min,颈项部皮肤松软处注射APO(浓度40μg/mL),剂量100μg/kg,观察30min内大鼠阴茎勃起次数。以阴茎头充血及阴茎体增长为勃起1次。每组阴茎勃起者所占百分比为该组阴茎勃起率。
五、阴茎海绵体内压(IICCPP)及平均动脉压(MMAAPP)测定
大鼠成模8周后,用1 0 %的水合氯醛(0.35mL/100g)腹腔注射麻醉,仰卧固定在解剖板上。于大鼠下腹部做一正中切口,逐层打开腹腔,用玻璃针充分暴露前列腺后外侧。在前列腺和输精管之间找到盆腔神经丛,并小心剥离出阴茎海绵体神经。游离坐骨海绵肌,暴露阴茎脚,用充满肝素的头皮针穿刺阴茎海绵体,测定海绵体内压。在大鼠颈部正中切口,逐层分离找到气管,于气管左侧用玻璃针分离左颈动脉1cm及迷走神经;用充满肝素的硬膜外麻醉导管(Size:1.0)插入颈动脉并固定,勿使滑脱。设置参数(刺激电压5V,频率15Hz,波幅5ms,持续时间50s),连接传感器,阻断三通与大气相连,排尽空气,软件调零,观察并记录测定结果。
六、样本采集
大鼠测压完毕后,心脏采血5mL,4 000×g,离心10min,取上清,分装,-80℃贮存。阴茎去掉白膜、阴茎头、血管、尿道,并将组织于PBS液中漂洗3次,漂洗掉组织中的血液,-80℃贮存待用。
七、GSSGG、GGSSHH测定
阴茎样品GSSG、GSH测定液氮下研磨阴茎组织,每10mg研碎组织加入30μL M试剂(为GSH、GSSG、GSH/GSSG测定试剂盒中的蛋白去除试剂M溶液),充分旋转震荡,4℃静置10min,4℃下11 180×g,离心10min,取上清液。使用96空板,用酶标仪测定A412吸光度,并计算含量。
八、T测定
取血2mL,测定血清T。
九、免疫组化(SSPP法)检测阴茎组织eeNNOOSS表达
石蜡切片,常规脱蜡至水;3% H2O2去离子水孵育,PBS冲洗;滴加试剂A,室温孵育10~15min,倾去;滴加一抗,37℃孵育2.5h,PBS冲洗,3min×3次;滴加试剂B,室温孵育15min,PBS冲洗,3min×3次;滴加试剂C室温孵育15min,PBS冲洗,3min×3次;DAB显色;自来水充分冲洗;封片;显微镜下观察eNOS的表达分布。
十、Western BBlloott法检测大鼠阴茎中eeNNOOSS的含量
阴茎组织称重后,液氮下研磨,将研碎组织移入玻璃匀浆器中,冰浴下充分匀浆研磨。将匀浆液于4℃下22 912×g,离心5min,提取上清液分装,-20℃下保存待用。BCA法测定蛋白浓度。煮样,样品冷却后-20℃贮存待用。制备浓缩胶、分离胶,上样,电泳,转膜,封闭,一抗(1:500稀释)孵育过夜,二抗(1:5000稀释)孵育,显色曝光,扫描胶片,结果以eNOS/β-actin进行分析。
十一、统计学分析
数据以x±s表示,采用SPSS 19.0统计软件对各组数据进行独立样本t检验;P<0.05为差异具有统计学意义。
结 果
一、各组大鼠血糖、体质量及生长状况变化
1只大鼠注射STZ时因操作不当死亡,注射STZ后第2天有5只大鼠因低血糖死亡,第三天空腹检测血糖,有5只大鼠未成模,经追加半剂量STZ后有2只大鼠血糖达标。实验组共有12只大鼠血糖持续大于16.7mmol/L。成模后大鼠逐渐出现糖尿病典型的“三多一少”症状,随着病情的进展,DM大鼠逐渐表现出毛色干枯萎黄、体质量下降、反应迟钝等现象。
二、各组大鼠AAPPOO实验、血清睾酮(T)、海绵体内压/平均颈动脉压(IICCPPmmaaxx//MMAAPP)
注射APO后,可见阴茎勃起的大鼠,用双前爪抓住阴茎,并舔舐阴茎头;两组大鼠都有不同程度的打呵欠。勃起功能测评,D组明显低于C组,测定结果见表1。

表1 糖尿病组正常对照组勃起次数、勃起率、T和CIPmax/MAPP((55VV))比较(xx±ss)
三、各组大鼠阴茎组织中GSSG、GSH、GGSSHH// GGSSSSGG及血清睾酮含量比较
GSSG含量D组较C组明显升高(P<0.05);GSH含量D组明显比C组大鼠血浆内含量低(P<0.05)。C组GSH/GSSG比值高于D组(P<0.05)。血清睾酮D组明显低于C组(P<0.05)。见图1。
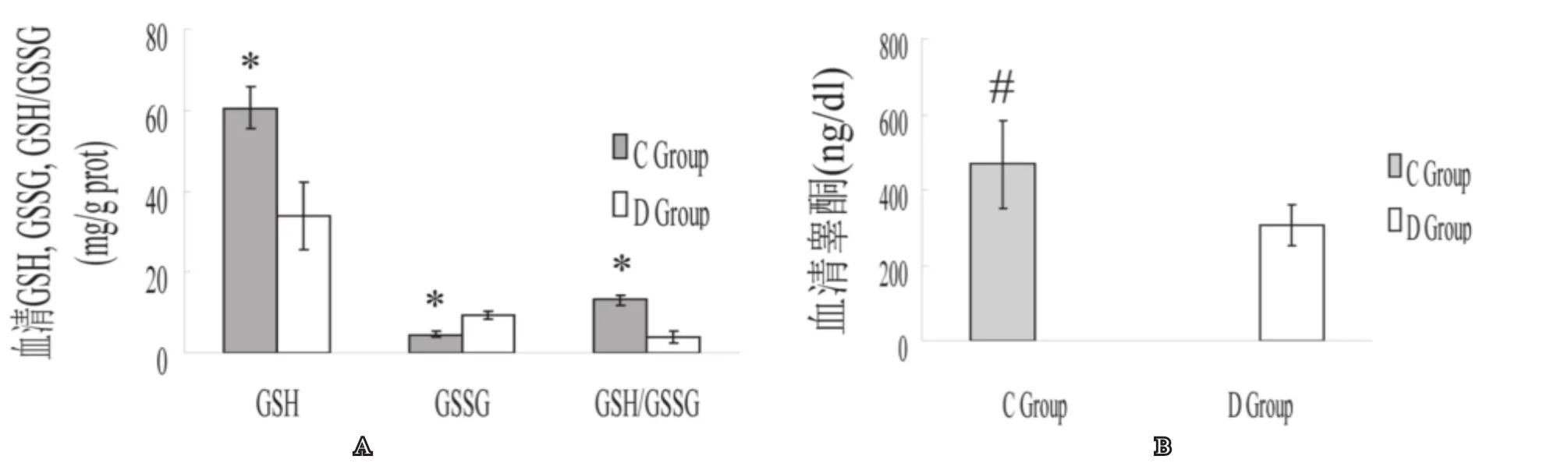
图1 两组大鼠阴茎组织中 GSH,GSSG.GSH/GSSSGG 及血清中T水平A:与D组比较,*:P<0.05;B:与D组比较,#:P<0.05
四、eeNNOOSS在阴茎海绵体表达情况
eNOS主要在阴茎海绵体血管平滑肌细胞内表达,与正常组相较,糖尿病组表达量明显降低(P<0.05)。见图2。
五、 GSH,GSSG,GSH/GSSG 与eeNNOOSS相互关系
实验数据采用pearson相关性分析,结果显示GSH与eNOS表达含量呈正相关(r=0.773,P=0.003);GSH/GSSG与eNOS呈正相关(r=0.757,P=0.004)而eNOS与GSSG呈负相关(r =-0.831,P=0.001)。
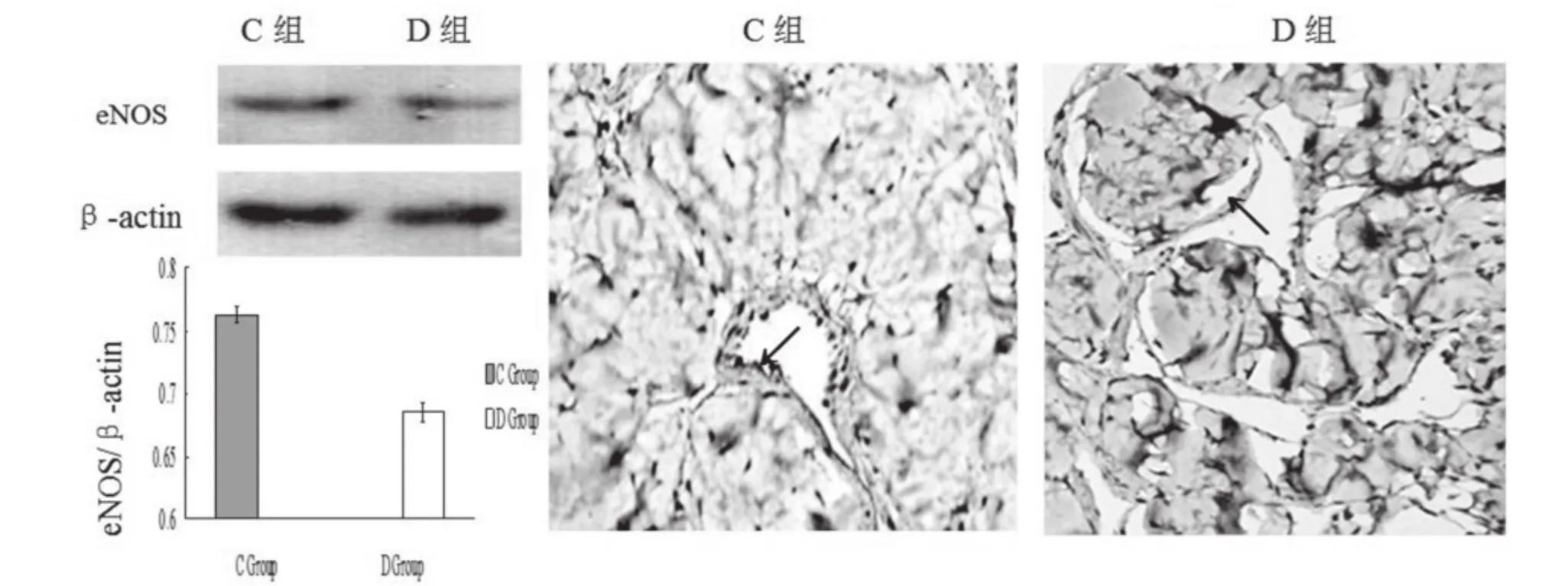
图2 eNOSS在两组大鼠阴茎组织的表达免疫组化观察(×400)示:eNOS主要表达于阴茎血管内皮细胞,在海绵体平滑肌细胞内也有少量表达。Western蛋白印迹检测eNOS表达,eNOS表达量D组较C组显著降低(P<0.05);箭头表示蛋白质eNOS表达位置
讨 论
我国一项纳入5 477例2型糖尿病患者的研究[5]发现2型糖尿病患者ED的患病率为75.2%。虽然糖尿病是ED发生的重要原因之一,但尚未得到临床医师和患者本人的充分重视,其发病机制也有待进一步研究。
NO-cGMP信号通路是ED分子机制的核心通路,当性刺激信号传导至阴茎海绵体时,非胆碱能神经末梢和阴茎海绵体血管内皮细胞释放nNOS和eNOS[6]。eNOS在二聚体状态下可发生下列反应:。NO以弥散的方式进入相邻的平滑肌细胞内,并与细胞内的可溶性鸟苷酸环化酶(soluble guanylate cyclase,sGC)上的血红素(Heme)结合,激活sGC;在sGC 的作用下三磷酸鸟苷(GTP)转化为环磷酸鸟苷(cGMP),cGMP作用于蛋白激酶G(protein kinase G,PKG),进而抑制细胞膜上的L型钙离子通道(L-Ca2+)的活性,阻止钙离子内流[7],同时促进细胞质内钙离子进入内质网,使胞质内钙离子浓度降低。胞质内的Ca2+浓度降低后,一方面使胞质内的肌球蛋白轻链激酶(myosin light chain kinase,MLCK)失活,磷酸化的肌球蛋白轻链(myosin light chain,MLC)在肌球蛋白轻链磷酸酶(myosin light chain phosphatase,MLCP)的作用下脱磷酸化,导致平滑肌舒张;另一方面抑制细胞模上钙离子激活的氯离子通道(CaCCs),减少胞质内氯离子外流[8],活细胞膜上的大电导钾离子通道(BKCa)和ATP依赖性钾离子通道(KATP),使胞内钾离子外流,导致细胞内形成超级化电位,最终使海绵体平滑肌细胞肌球蛋白轻链(MLC)去磷酸化而舒张,引发阴茎勃起[9]。同样nNOS亦作用于L-精氨酸,经NO-cGMP信号通路,在阴茎舒张时起作用。而通路任何一个环节出现问题, 都会导致ED的发生。
本研究中,D组大鼠出现典型的2型糖尿病“三多一少”症状,血糖持续大于16.7mmol/L,2型糖尿病造模成功。检测中发现糖尿病大鼠阴茎勃起次数、勃起率、阴茎海绵体内压均明显低于正常组,出现勃起功能障碍;进一步检测发现阴茎海绵体内压、血清睾酮均低于对照组,证实阴茎海绵体内压、血清睾酮与阴茎勃起有直接关系。
糖尿病进程中的eNOS解偶联,NO产生减少和ROS增加,继发血管内皮损伤是DMED重要机制[10]。解偶联机制主要包括:辅助因子四氢生物蝶呤(BH4)、底物L-Arg的耗竭和eNOS二聚体的破坏。在糖尿病的高血糖状态下,eNOS的解偶联是由NAD(P)H产生的超氧化物触发的。解偶联的状态,电子通常是从一个亚基的还原酶区域流向另一个亚基的氧化酶区域;激活的eNOS不能催化L-Arg氧化生成L-胍氨酸和NO,但是eNOS仍然能够接受来自NADPH的电子并传递给另一底物O2,导致最终的产物为O2-[11]。在高血糖下eNOS解离为单体,介导下列反应公式为:。ONOO-使 BH4氧化,是BH4减少的主要原因,促进eNOS的解偶联,使内皮细胞合成释放NO减少,这一病理生理是导致DMED重要致病机制。
实验结果发现,糖尿病大鼠阴茎组织中GSH含量、GSH/GSSG比值均低于正常组,GSSG含量高于正常组,而且统计发现eNOS与GSH、GSH/GSSG正相关,与GSSG负相关。GSH是维持细胞内氧化还原状态和蛋白质功能和完整性的重要物质,能够调制氧化还原信号的转导,能够延缓DMED的发生[12]。GSH可以抑制NADPH及细胞色素P450还原酶的活性,减少ROS的产生。研究发现[Ca2+]随着GSSG水平的高低成比例地升高,其主要原因是GSSG可直接与IP3受体/通道结合,引起细胞内Ca2+升高[13]。GSH/GSSG比值反映蛋白巯基化程度,是细胞内氧化还原状态变化的主要影响因素[14]。GSH、GSSG以修饰参与信号传导蛋白分子中的巯基改变其分子结构及活性的方式参与细胞内的信号转导,不仅参与eNOS解偶联,还影响着钙离子通道的活性及含量,参与DMED的多个环节。高血糖下氧自由基增多和NADPH水平降低,GSH耗竭,致使NO减少,GSSG增加,进一步加重血管内皮的损伤,导致海绵体舒张功能障碍[15]。Zweier和Chen等[14,16]发现,谷胱甘肽参与“氧化应激”相关的一种修饰,即“蛋白质谷胱甘肽化”(S-glutathionylation),可将eNOS从形成NO换成形成过氧化物。细胞内GSSG高水平是触发谷胱甘肽化修饰的eNOS解偶联重要因素[17]。而蛋白质的谷胱甘肽化在eNOS的解偶联中起着重要作用;能够复位这一氧化-还原分子开关,从而恢复eNOS功能的药物,对治疗DMED有重要帮助。本研究虽然证实GSH、GSH/GSSG、GSSG与eNOS具有相关性,是影响eNOS表达的因素之一;但其间的复杂关系并不是简单的因果关系,其机制仍有待进一步细化研究。
参考文献
1 胡剑麟,陈斌.血管性勃起功能障碍的诊疗现状及进展.中国男科学杂志 2009;21(1):56-59
2 Thorve VS,Kshirsagar AD,Vyawahare NS,et al.Diabetes-induced erectile dysfunction:epidemiology,pathophysiology and management.J Diabetes Complic 2010;25(2):129-136
3 Chitaley K.Type1 and Type2 diabetic-erectile dysfunction:same diagnosis (ICD-9),different disease.J Sex Med 2009;6 Suppl 3:262-268
4 Tomoya Katao Ka,Yuji Hotta,Yasuhiro Maeda,et al.Assessment of androgen replacement therapy for erectile function in rats with type 2 diabetes mellitus by examining nitric oxide-related and infl ammatory factors.J Sex Med 2014;11(4):920-929
5 Yang G,Pan C,Lu J.Prevalence of erectile dysfunction among Chinese men with type 2 diabetes mellitus.Int J Impot Res 2010;22(5):310-317
6 Zhang Y,Huang C,Liu S,et al.Effects of quercetin on intracavernous pressure and expression of nitrogen synthase isoforms in arterial erectile dysfunction rat model.Int J Clin Exp Med 2015;8(5):7599-7605
7 Shimizu S,Tsounapi P,Honda M,et al.Effect of an angiotensinⅡ receptor blocker and a calcium channel blocker on hypertension associated penile dysfunction in a rat model.Biomed Res 2014;35(3):215-221
8 Lau LC,Adaikan PG.Possibility of inhibition of calciumactivated chloride channel rescuing erectile failures in diabetes.Int J Impot Res 2014;26(4):151-155
9 Gonzalez-Corrochano R,La Fuente J,Cuevas P,et al.Ca2+-activated K+channel (KCa) stimulation improves relaxant capacity of PED5 inhibitor in human penile arteries and recovers the reduced efficacy of PED5 inhibition in diabetic erectile dysfunction.Br J Pharmacol 2013;169(2):449-461
10 姚乐申,李燕,陈赟,等.还原型谷胱甘肽对糖尿病大鼠阴茎海绵体氧化损伤的影响.中国男科学杂志 2009;23(10):5-9,17
11 Chen CA,Druhan LJ,Varadharaj S,et al.Phosphorylation of endothelial nitric oxide synthase (eNOS) regulates superoxide generation from the enzyme.J Biol Chem 2008;283(40):27038-27047
12 Yang YM,Huang A,Kaley G,et al.eNOS uncoupling and endothelial dysfunction in aged vessels.Am J Physiol Heart Circ Physiol 2009;297(5):H1829-H1836
13 Kurilova LS,Krutestkaia ZI,Lebedev OE,et al.The effect of oxidized glutathione and its pharmacological analogue,glutoxim,on intracellular Ca2+concentration in macrophages.Tsitologiia 2008;50(5):452-461
14 Zweier JL,Chen CA,Druhan LJ.S-glutathionylation reshapes our understanding of endothelial nitric oxide synthase uncoupling and nitric oxide/reactive oxygen species-mediated signaling.Antioxid Redox Signal 2011;14(10):1769-1675
15 Tagliabue M,Pinach S,Di Bisceghlile C,et al.Glutathione levels in patients with erectile dysfunction,with or without diabetes mellitus.Int J Androl 2005;28(3):156-162
16 Chen CA,De Pascali F,Basye A,et al.Redox modulation of eNOS by glutaredoxin-1 through reversible oxidative post-translational modifi cation.Biochemistry 2013;52(38):6712-6723
17 Galougahi KK,Liu CC,Gentile C,et al.Glutathionylation mediates angiotensiⅡ-induced eNOS uncoupling,amplifying NADPH oxidase-dependent endothelial dysfuntion.J Am Heart Assoc 2014;3(2):e000731
(2015-09-05收稿)
*基金项目资助: 黑龙江省自然科学基金(H2015073);黑龙江省教育厅科学研究项目(12521542);佳木斯大学科学技术重点项目(Zc2013-005)
The effect of GSH,GSSG and GSH/GSSG on eNOS expression in the penile corpus cavernosum of DMED rats*
Cao Huifeng,Ma Long,Hu Cunli**,Luo Zhenguo,Du Conglin,Gui Shiliang
Department of Urology,The fi rst Affi liated Hospital to Jiamusi University,Jiamusi 154007,Heilongjiang,China
Corresponding author:Hu Cunli,E-mail:jmsdxhcl@163.com
AbstractObjectivee To investigate effects of GSH,GSSG and GSH/GSSG on the expression of eNOS in the penile corpus cavernosum of DMED rats.Metthhooddss Thirty healthy male Sprague Dawley (SD) rats aged 8 weeks were randomly divided into the control group (C group,8 rats) and diabetes mellitus (DM) model group(D group,22 rats).The rats in D group were fed with high calorie and high sugar diet for 4 weeks,then intraperitioneally injected with streptozotocin (STZ,40mg/kg) to establish diabetes mellitus rat models.The rats in C group were given normal diet.At eighth weeks after STZ injection,the rats were injected with apomorphine,and their penile erections were observed to evaluate their erectile function.All rats were killed after detection of the maximal intracavernous pressure/mean arterial blood pressure(ICPmax/ MAP) using electrostmulation,levels of GSH,GSSG and testosterone in plasma and penis were measured,and the expression of eNOS in the penile corpus cavernosum was examined by immunohistochemistry and Western blot.Resultss Compared with those of the controls (C group),the expression levels of GSH,GSH/GSSG in the plasma and eNOS in the penile tissue of the model rats with diabetes mellitus were all decreased markedly(P<0.05),whereas GSSG level was signifi cantly increased(P<0.05).Concluussiioonn The low level of GSH and GSH/GSSG in the plasma and high concentration of GSSG in the penile corpus cavernosum of the diabetic rats will downregulate the expression of eNOS,which may be an important pathological mechanism for diabetes mellitus erectile dysfunction.
doi:10.3969/j.issn.1008-0848.2016.01.003
中图分类号R 698.1;R 587.1
