ω-3脂肪乳剂用于危重患者肝功能损伤的临床研究
2016-06-05许振琦周国庆陈黎新
许振琦, 黄 强, 周国庆, 陈黎新
中国人民解放军第九四医院急诊科,江西 南昌 330001
ω-3脂肪乳剂用于危重患者肝功能损伤的临床研究
许振琦, 黄 强, 周国庆, 陈黎新
中国人民解放军第九四医院急诊科,江西 南昌 330001
目的研究ω-3脂肪乳剂在危重患者肝功能损伤治疗中的应用价值。方法56 例合并肝功能损伤的危重患者随机分为治疗组和对照组,治疗组治疗中应用ω-3脂肪乳剂,对照组应用非ω-3脂肪乳剂。分别于治疗第0、1、4、7天监测患者当日最高体温、呼吸频率、心率和氧合指数,并使用酶联免疫吸附方法(ELISA)检测血中 TNF-α、IL-6及IL-10水平,并统计两组患者的肝功能指标(ALT、AST、TBIL、γ-GT)、预后指标(ARACHEⅡ评分、ICU时间、住院时间、28 d病死率)。结果治疗后4 d、7 d对照组的呼吸频率、心率高于治疗组(P<0.05);治疗后7 d对照组的体温高于治疗组(P<0.05);治疗后4 d、7 d对照组氧合指数低于治疗组(P<0.05);治疗后1 d、4 d、7 d治疗组的血TNF-α、IL-6和IL-10均低于对照组(P<0.05);治疗后1 d、4 d、7 d治疗组的血ALT、AST均低于对照组(P<0.05);治疗后4 d、7 d治疗组的血TBIL和γ-GT均低于对照组(P<0.05)。治疗后,两组ARACHE Ⅱ评分均降低,治疗后7 d治疗组的APACHE Ⅱ评分低于对照组(P<0.05);对患者的预后随访发现两组的ICU时间、住院时间、28 d病死率差异无统计学意义(P>0.05)。结论ω-3脂肪乳剂能改善合并有肝功能损伤的危重患者的机体免疫状态,减轻炎症反应,对肝脏有一定的保护作用,具有较好的临床应用价值。
危重患者;肝功能损伤;ω-3脂肪乳
危重患者普遍存在营养不良及肝功能损伤。营养不良导致患者出现糖、脂肪、蛋白质及水盐代谢异常,组织器官功能低下及体液细胞免疫功能低下,感染难以控制,从而病情恶化。药物性肝损害(drug-induced liver injury,DILI)是危重病治疗过程中最常见的毒副反应,常常使治疗中断或方案更改,直接影响危重病治疗效果[1]。对于危重患者肝功能损伤的情况,由于胃肠道功能障碍,肠内营养往往无法满足其能量需求,需要给予肠外营养(parenteral nrtrition,PN)支持治疗[2]。随着肠外营养的不断深入研究,由植物油、乳剂和等渗剂等组成的脂肪乳剂已经成为PN中重要的非蛋白质能源之一[3],其中ω-3脂肪酸应用于危重患者已引起人们极大的关注[4]。本研究通过观察肝功能损伤的危重患者应用ω-3脂肪酸及ω-6脂肪酸配方的PN制剂的临床效果,为危重病肝功能损伤的患者的PN支持方案提供临床证据。
1 资料与方法
1.1 一般资料收集2014年5月-2015年6月我院急诊ICU及重症医学科收治的危重患者继发肝功能损伤56例,随机分为治疗组28例及对照组28例。治疗组患者男15例,女13例;年龄25~54岁,平均年龄(34.43±10.32)岁;疾病分布:疾病构成包括:消化道穿孔、破裂修补术后12例;肠梗阻术后22例;重症胆管炎9例;严重多发伤20例;重症胰腺炎13例。对照组患者男14例,女14例;年龄23~55岁,平均年龄(34.12±11.04)岁;疾病分布: 消化道穿孔、破裂修补术后12例;肠梗阻术后22例;重症胆管炎9例;严重多发伤20例;重症胰腺炎13例。两组治疗前一般情况、疾病分布差异无统计学意义(P>0.05),具有可比性。临床实验方案得到医院伦理委员会批准,患者及家属均签署实验知情同意书。
1.2 纳入及排除标准
1.2.1 纳入标准:(1)年龄15~75岁;(2)营养不良,需要完全胃肠外营养(total parenteral nrtrition,TPN)支持;(3)血流动力学稳定,APACHEⅡ评分35分;(4)伴有肝功能不全,既往无肝病史;(5)患者或患者委托人自愿参与实验,签署知情同意书。
1.2.2 排除标准:(1)妊娠或哺乳期妇女;(2)患有急性肺水肿、心肺功能不全的肠外治疗禁忌证;(3)对大豆蛋白、脂肪乳剂过敏者;(4)严重凝血功能障碍休克;(5)APACHE Ⅱ评分>35分;(6)肾功能异常;(7)脂质代谢异常或高甘油三酯血症。
1.3 研究方法
1.3.1 治疗方法:两组患者完善相关检查,诊断明确后立即给予常规治疗,如常规原发病治疗、补液、制酸、抗感染、止血、呼吸机支持等对症治疗,24 h不间断给予TPN营养支持治疗,输注葡萄糖、氨基酸、脂肪乳剂、维生素和微量元素,调节水电解质酸碱失衡,营养支持等。两组都给予能量补充25~30 kcal·kg-1·d-1,能量供给按照糖脂比为1.5∶1。治疗组给予含有ω-3脂肪酸的脂肪乳剂供能:0.2 g鱼油与0.8 g大豆油配方制剂;对照组给予非ω-3脂肪酸的脂肪乳剂供能:不含鱼油的1.0 g大豆油。
1.3.2 检测方法:分别于治疗第0、1、4、7天无菌操作原则采取肘静脉血2~4 ml作为标本,立即以1 000 r/min速度离心5 min后将血清置于-20 ℃冰箱保存。采用双抗夹心酶联免疫吸附法(ELISA)统一测定血清TNF-α、IL-6及IL-10水平,使用BIO-RAD全自动酶标仪测定450 nm处的OD值,分别绘制标准品曲线,计算待测样品TNF-α、IL-6、IL-10的浓度。
1.3.3 疗效评价方法:治疗后,对以下指标进行评价:(1)治疗1 d、4 d、7 d时两组患者的生命体征指标变化:呼吸、心率、PaO2和氧合指数;(2)治疗1 d、4 d、7 d时的肝功能指标:谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBil)、γ-GT;(3)治疗1 d、4 d、7 d时的炎症因子比较(血浆TNF-α、IL-6、IL-10);(4)预后:ARACHE Ⅱ评分(采用APACHE Ⅱ评分软件)、ICU转出(参照SIRS的评分标准[5]评分<2分即转出ICU);住院时间(指创伤临床痊愈时间,不包括其康复时间)、28 d病死率。
1.4 统计学处理采用SPSS 21.0统计软件进行处理,定量数据比较用两独立样本的t检验,各时间点比较采用单样本重复测量方差分析,各组数值经Kolinogorov-smimov法检验服从正态分布。定性资料采用四格表检验进行组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者不同时间生命体征参数变化治疗后,两组患者的呼吸、心率、体温、氧合指数均逐渐改善;治疗前两组间各生命体征参数比较差异无显著统计学意义(P>0.05);治疗后4 d、7 d对照组的呼吸、心率、高于治疗组(P<0.05);治疗后7 d对照组的体温高于治疗组(P<0.05);治疗后4 d、7 d对照组氧合指数低于治疗组,差异有统计学意义(P<0.05,见表1)。
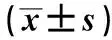
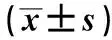

组别例数呼吸(次/min)心率(次/min)体温(℃)氧合指数(mmHg)治疗组28 治疗前33.28±4.22126.11±17.2838.95±0.73193.39±35.15 治疗后1d28.11±4.57114.11±16.1838.65±0.71292.26±42.11 治疗后4d23.11±4.57*104.11±13.41*38.25±0.66353.26±43.66* 治疗后7d17.11±4.57*81.93±8.78*37.09±0.46*424.51±50.19*对照组28 治疗前33.54±4.41126.11±17.2838.98±0.74213.26±41.61 治疗后1d30.01±4.57117.11±16.2138.47±0.69283.59±41.61 治疗后4d26.11±4.57111.11±14.3738.06±0.63313.21±43.59 治疗后7d23.11±4.5798.79±11.4637.79±0.46361.75±48.26
注:与同时期对照组比较,*P<0.05。
2.2 两组患者肝功能指标的比较治疗后,两组ALT、AST、TBIL和γ-GT均降低;治疗前,两组间四项肝功能指标差异无统计学意义(P>0.05);治疗后1 d、4 d、7 d治疗组的ALT、AST均低于对照组(P<0.05);治疗后4 d、7 d治疗组的TBIL和γ-GT均低于对照组,差异有统计学意义(P<0.05,见表2)。
2.3 治疗后两者患者的炎症因子水平比较治疗后,两组IL-6和IL-10均降低,TNF-α在对照组反而上升;治疗前,两组间三项炎性因子差异无显著统计学意义(P>0.05);治疗组治疗后1 d、4 d、7 d治疗组的血TNF-α、IL-6和IL-10均低于对照组(P<0.05,见表3)。
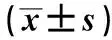
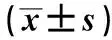
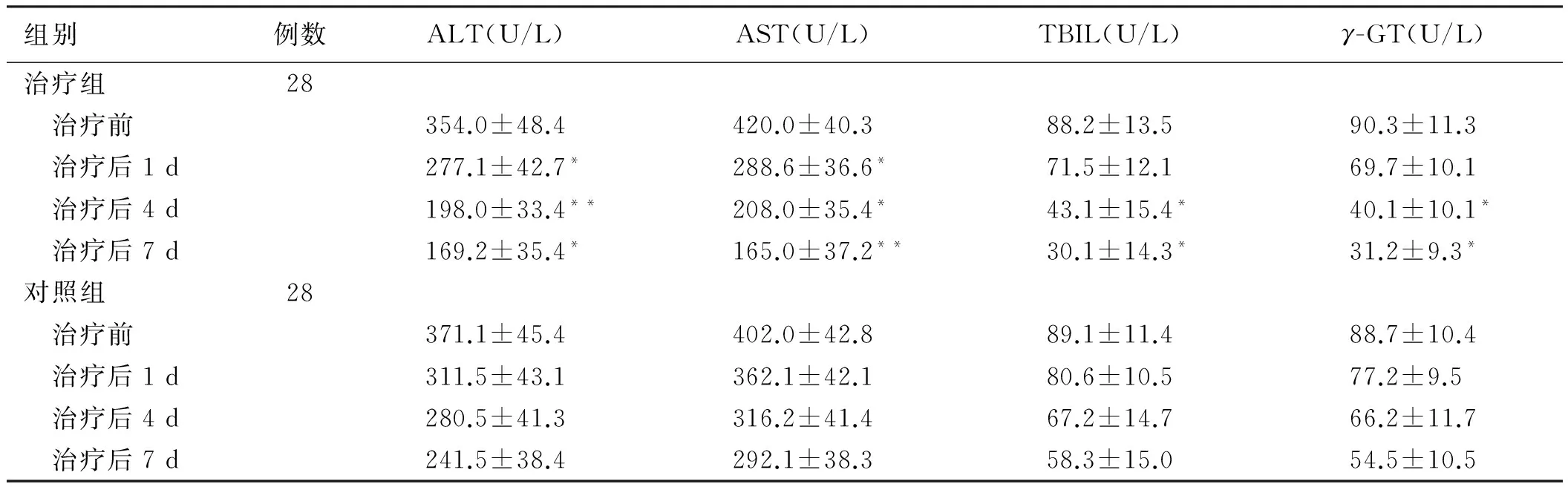
组别例数ALT(U/L)AST(U/L)TBIL(U/L)γ-GT(U/L)治疗组28 治疗前354.0±48.4420.0±40.388.2±13.590.3±11.3 治疗后1d277.1±42.7*288.6±36.6*71.5±12.169.7±10.1 治疗后4d198.0±33.4**208.0±35.4*43.1±15.4*40.1±10.1* 治疗后7d169.2±35.4*165.0±37.2**30.1±14.3*31.2±9.3*对照组28 治疗前371.1±45.4402.0±42.889.1±11.488.7±10.4 治疗后1d311.5±43.1362.1±42.180.6±10.577.2±9.5 治疗后4d280.5±41.3316.2±41.467.2±14.766.2±11.7 治疗后7d241.5±38.4292.1±38.358.3±15.054.5±10.5
注:与同时期对照组比较,*P<0.05,**P<0.01。
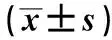
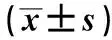
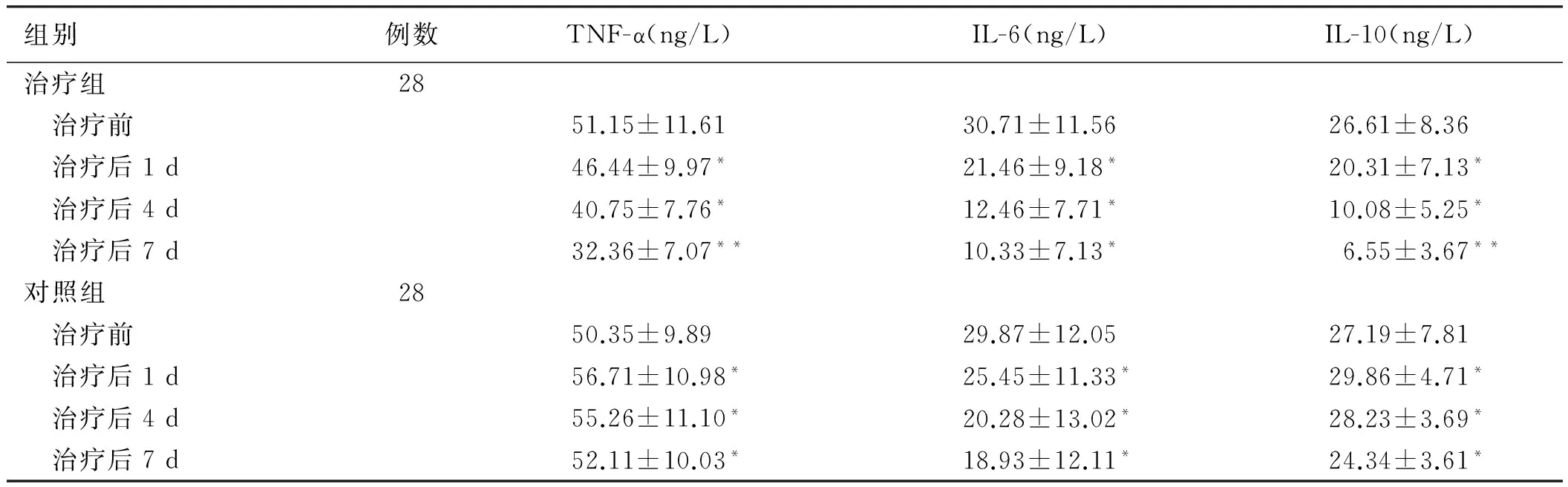
组别例数TNF-α(ng/L)IL-6(ng/L)IL-10(ng/L)治疗组28 治疗前51.15±11.6130.71±11.5626.61±8.36 治疗后1d46.44±9.97*21.46±9.18*20.31±7.13* 治疗后4d40.75±7.76*12.46±7.71*10.08±5.25* 治疗后7d32.36±7.07**10.33±7.13*6.55±3.67**对照组28 治疗前50.35±9.8929.87±12.0527.19±7.81 治疗后1d56.71±10.98*25.45±11.33*29.86±4.71* 治疗后4d55.26±11.10*20.28±13.02*28.23±3.69* 治疗后7d52.11±10.03*18.93±12.11*24.34±3.61*
注:与同时期对照组比较,*P<0.05,**P<0.01。
2.4 两组患者预后情况比较治疗后,两组ARACHE Ⅱ评分均降低,治疗后7 d治疗组的ARACHE Ⅱ评分低于对照组(P<0.05);对患者的预后随访发现治疗组的ICU 时间、住院时间、28 d 病死率差异无统计学意义(P>0.05,见表4)。
表4 两组患者预后情况比较
Tab 4 Comparison of patients prognosis between two groups

组别例数ARACHEⅡ评分(x±s)治疗前治疗后1d治疗后4d治疗后7dICU时间(d)住院时间(d)28d病死率(%)治疗组2825.03±7.9513.57±5.377.12±2.153.52±2.0310.21±2.2319.97±2.8171.4对照组2824.76±7.9815.24±5.628.82±4.235.21±4.17*9.01±2.1422.08±2.9014.3
注:与同时期对照组比较,*P<0.05。
3 讨论
危重患者在应激状态下,机体的分解代谢明显高于合成代谢。这可迅速导致营养不良、免疫功能下降,并发多器官功能障碍。重症患者肝功能损伤的治疗除了相应的护肝、预防感染等措施,营养治疗具有举足轻重的作用,随着疾病的持续进展,脂类分解氧化加强,脂肪营养是营养治疗的关键部分,因此,在PN过程中需要适当增加脂肪乳剂以提供足够热量[6],其在患者的PN支持中发挥了重要的作用。然而目前国内外针对危重患者肝功能损伤的PN使用选择仍然缺乏大规模的随机对照试验。本研究通过随访观察应用ω-6及ω-3脂肪酸配方的PN制剂缓和临床特征及临床效果,为明确存在肝功能损伤的危重患者PN制剂的选择提供有效的临床证据。
以大豆油为基础的脂肪乳剂富含大量ω-6长链脂肪乳,安全性高,未见严重不良反应,长期以来作为PN的应用标准。但ω-6脂肪乳剂在病理和免疫方面一直不甚满意,主要是其代谢中间产物花生四烯酸在一系列生物性酶的作用下产生的血栓素(TXA2)、前列腺素(PG2)和白三烯B4(LTB4)等炎性物质,可导致血管收缩、血小板聚毛细血管通透性增加、组织水肿,应激性剧增,尤其当机体ω-6过量时产生氧化自由基,影响细胞运动,对缺血/再灌注产生应答诱导细胞凋亡,免疫功能将受损,加重器官功能损伤,不利于肝功能的恢复[7]。因此,ω-3多不饱和脂肪酸因其抗炎、抗血栓及调节免疫的功能,能有效弥补ω-6的缺陷,这主要归于其富含二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)。ω-3通过竞争性抑制环氧化酶对细胞膜上磷脂中的不饱和脂肪酸-AA的氧化作用,减少AA产物的生成,并减少LTB4及TXA2的生成。ω-3脂肪酸在修饰白细胞的活性、调节细胞因子的释放方面更佳[8]。另外,ω-3脂肪酸还可以通过改变细胞的信号转导途径,激活核因子κB(NF-κB)和过氧化物酶,减轻炎症反应,维持较好的免疫功能,避免器官功能的损伤。因此在免疫力低下、肝功能受损的危重患者的治疗上取得较好的疗效,表现出在重症患者营养治疗的优越性,达到营养和药理的联合作用。
研究[9]报道ω-3脂肪酸对肿瘤患者的肝功能具有保护作用,能显著降低ALT、AST、胆红素、脂肪酶。ω-3脂肪酸可以显著抑制患者的炎症反应并降低术后血栓形成的风险[10]。本研究表明对于肝功能受损的危重患者补充富含ω-3脂肪酸的脂肪乳剂后患者生命体征逐渐平稳,应激反应逐渐控制。主要是由于ω-3脂肪酸有利于调节患者的免疫功能,炎性细胞因子IL-6、IL-10、TNF-α水平降低,机体炎性反应程度下降,细胞增殖得到控制,有利于肝功能的恢复。另外,本研究通过对两组患者的预后进行观察对比,发现治疗组患者的评分更低、ICU转出时间、住院时间更短,28 d死亡率相对更低,但差异无统计学意义(P>0.05)。Mertes等[11]指出混合有大豆油和鱼油的SMOF具有更好的抗炎和改善免疫的作用,并可显著缩短住院时间。可能与研究对象及疾病的选择有关,有待进一步更大样本的研究。总之,ω-3脂肪酸在重症患者的肠外营养中具有重要的应用价值,但需注意给予脂肪乳剂时应该合理掌握ω-3与其他脂肪乳及营养素的配比,与各种矿物质、维生素C、维生素E等抗氧化剂的充足供应。最好是合于营养液中混合输注。
综上所述,ω-3脂肪酸应用于肝功能受损的危重患者的营养支持安全有效,能有效降低炎性反应,调节免疫功能,降低对肝脏的进一步损伤,对肝脏有保护作用,但对其转归影响不大,ω-3脂肪乳是严重应激状况下更理想的能源物质。
[1]林峰, 王春燕, 汤丽娜, 等. 大剂量甲氨蝶呤治疗骨肉瘤导致肝功能损伤的危险因素分析[J]. 肿瘤, 2014, 34(5): 450-453. Lin F, Wang CY, Tang LN, et al. Risk factor associated with liver damage induced by high-dose methotrexate treatment of osteosarcoma [J]. Tumor, 2014, 34(5): 450-453.
[2]洪军, 杨向红. 肠内肠外营养对急性重症胰腺炎患者术后的影响[J]. 全科医学临床与教育, 2011, 9(3): 280-282. Hong J, Yang XH. Influence of enteral nutrition or parenteral nutrition in patients with severe acute pancreatitis postoperation [J]. Clinical Education of General Practice, 2011, 9(3): 280-282.
[3]李亚红, 王青青. 结构脂肪乳剂对危重症患者肝肾功能和蛋白质、脂肪代谢的影响[J]. 山东医药, 2011, 51(10): 111-112. Li YH, Wang QQ. The influence of structural fat emulsion on liver and kidney function and protein and fat metabolism of critically ill patients [J]. Shandong Medicine, 2011, 51(10): 111-112.
[4]Jones ML, Mark PJ, Waddell BJ. Maternal omega-3 fatty acid intake increases placental labyrinthine antioxidant eapaeity but does not protect against fetal growth restriction induced by placental is chiemia-reperfusion injury [J]. Reproduetion, 2013, 146(6): 539-547
[5]徐建国, 徐敏, 潘娅静. ω-3鱼油脂肪乳剂对严重创伤患者血白细胞介素-6及肿瘤坏死因子-α的影响[J]. 实用医学杂志, 2009, 25(11): 1782-1784. Xu JG, Xu M, Pan YJ. Influence of ω-3 fish oil fatty emulsion on serum interleukin-6 and tumor necrosis factor-alpha in patients with severe injury [J]. The Journal of Practical Medicine, 2009, 25(11): 1782-1784.
[6]蔡常洁. 外科危重病人代谢改变及其对临床营养指导意义[J]. 中国实用外科杂志, 2012, 32(2): 125-127. Cai CJ. Changes of metabolism in surgical critically ill patients and the significance for clinical nutrition [J]. Chinese Journal of Practical Surgery, 2012, 32(2): 125-127.
[7]刘敏杰. ω-3脂肪酸对重症监护中外科术后患者炎症及护理策略的影响[J]. 河北医学, 2014, 20(8): 1384-1387. Liu MJ. The influence of Omega-3 fatty acids on surgical postoperative inflammation and nursing strategies of patients under the intensive care [J]. Hebei Medicine, 2014, 20(8): 1384-1387.
[8]刘成. ω-3多不饱和脂肪酸在重度颅脑外伤并发肺部感染的临床研究[D].安徽医科大学,2011. Liu C. The clinical research on Omega-3 fatty acids in severe craniocerebral trauma complicated with lung infection [D]. Anhui Medical University, 2011.
[9]Heller AR, Rössel T, Gottschlich B, et al. Omega-3 fatty acidosis proveliverand panereas functionin posto perativeeaneer patients [J]. Int J Caneer, 2004, 111(4): 611-616.
[10]Kojuri J, Ostovan MA, Rezaian GR, et al. Effete of omega-3 on brain natriuretic peptide and echocardiographic findings in Heart failure: Double-blind placebo-controlled randomized trial [J]. J Cardiovasc Dis Res, 2013, 4(1): 20-24.
[11]Mertes N, Grimm H, Fürst P, et al. Safety and efficacy of a new parenteral lipid emulsion (SMOF lipid) in surgical patients: a randomized, double-blind, multicenter study [J]. Ann Nutr Metab, 2006, 50(3): 253-259.
(责任编辑:王豪勋)
The clinical study of omega-3 fat emulsion for critically ill patients with liver function damage
XU Zhenqi, HUANG Qiang, ZHOU Guoqing, CHEN Lixin
Department of Emergency, the 94th Hospital of Chinese People’s Liberation Army, Nanchang 330001, China
Objective To study the application value of omega-3 fat emulsion in treatment of critically ill patients with liver function damage. Methods Fifty-six critically ill patients with liver function injury were randomly divided into treatment group and control group, patients in treatment group were treated with omega-3 fat emulsion. In the treatment of 0, 1, 4, 7 days, respectively, the highest temperature, breathing rate, heart rate and oxygenation index were monitored, the levels of blood TNF-α, IL-6 and IL-10 were detected by enzyme-linked immunosorbent assay (ELISA) and liver function index (ALT, AST, TBIL), prognostic indicators (ARACHE Ⅱ score, length of ICU stay and length of hospital stay, 28-day mortality were detected. Results The breathing rate and heart rate in the control group were higher than those in the treatment group after treatment of 4 days and 7 days, while the oxygenation index was lower than that in the treatment group (P<0.05), the temperature was lower than that in the treatment group after treatment of 7 days (P<0.05). after treatment of 1 day, 4 days and 7 days, the levels of blood TNF-α, IL-6 and IL-10 in treatment group were lower than those in control group (P<0.05); after treatment of 1 day, 4 days and 7 days, the levels of ALT and AST in treatment group were lower than those in the control group (P<0.05), and the TBIL andγ-GT blood levels in treatment group were lower than those in control group after treatment of 4 days and 7 days (P<0.05). APACHE Ⅱ score in treatment group was lower than the that in control group after treatment of 7 days (P<0.05). The difference of lengths of ICU stay and hospital stay and 28-day mortality rate were not statistically significant between two groups (P>0.05). Conclusion The omega-3 fat emulsion can improve the immune status of critically ill patients with liver function damage, reduce inflammation, and protect the liver to a certain extent, which has good clinical application value.
Critically ill patients; Liver function damage; Omega-3 fat emulsion
10.3969/j.issn.1006-5709.2016.09.015
R575.3
A 文章编号:1006-5709(2016)09-1022-04
2015-10-12
