阿尔巴斯绒山羊iPSCs诱导及培养体系的优化
2016-06-03邰大鹏乃门塔娜诺明途刘东军
邰大鹏,乃门塔娜,诺明途,王 潇,梁 浩,刘东军
(内蒙古大学 哺乳动物生殖生物学及生物技术教育部重点实验室,内蒙古 呼和浩特 010021)
阿尔巴斯绒山羊iPSCs诱导及培养体系的优化
邰大鹏,乃门塔娜,诺明途,王潇,梁浩,刘东军
(内蒙古大学 哺乳动物生殖生物学及生物技术教育部重点实验室,内蒙古 呼和浩特010021)
摘要:阿尔巴斯绒山羊多潜能干细胞(giPSCs)在遗传育种方面有重要的应用价值,然而目前还没有完善的giPSCs诱导及培养体系。为了获得稳定的giPSCs诱导及培养体系,根据培养基中添加的血清和小分子化合物的不同,构建了5组不同的培养基体系,分别观察了giPSCs在不同培养基中的生长状态、增殖能力以及重编程效率,并检测了不同组giPSCs的多潜能性,最后分析了不同小分子化合物的组合对giPSCs重编程效率和干细胞标记基因表达的影响。结果发现,血清的添加更适合giPSCs的诱导培养,小分子化合物Vc、VPA和LiCL能有效促进giPSCs的生成和自我更新。这为完善而稳定的绒山羊iPSCs诱导培养体系的建立奠定了基础,并且为阿尔巴斯绒山羊胚胎干细胞的建系提供了试验平台。
关键词:阿尔巴斯绒山羊;iPSCs;诱导及培养基体系;小分子化合物
诱导性多潜能干细胞(Induced pluripotent stem cells,iPSCs)是指把胚胎干细胞特异性转录因子导入成体细胞,使细胞重编程为类似于胚胎干细胞(Embryonic stem cells,ESCs)的多潜能干细胞[1]。iPSCs的诱导效率非常低,极易分化,因此对培养环境的要求非常高,需要饲养层细胞和细胞因子的辅助[2]。一个完善的诱导培养体系可有效提高iPSCs的诱导效率,并能维持其自我更新和增殖能力[3-4]。而其中添加的血清以及细胞因子是决定培养基功效的关键因素,极大地影响着培养基的功能,例如,培养基中添加LIF才能维持小鼠iPSCs的自我更新;无bFGF培养基不能维持人iPSCs的多潜能性[5-6]。但这些并不能解决重编程效率低的问题。
随着iPS技术的迅猛发展,研究发现一些小分子化合物不仅可以提高iPSCs的重编程效率,而且能促进其自我更新和增殖能力[7]。它们有些是通过抑制组蛋白甲基化、促进乙酰化等途径改变细胞的表观遗传状态而促进细胞重编程;有些是通过调节胞内信号通路而促进细胞重编程。总之,他们使重编程细胞更接近ESCs,更好地激活内源的多能性基因,使得培养条件更加完善[8-10]。
阿尔巴斯绒山羊是我国优良家畜品种,建立稳定的阿尔巴斯绒山羊iPSCs体系不但可以为相关学科的发展提供理论依据,同时在其遗传育种方面也具有十分重要的应用价值。然而,绒山羊iPSCs(Goat iPSCs,giPSCs)的诱导及建系非常困难,对其培养条件的探究也较少,所获得的细胞或增殖速度过于缓慢,或很难维持多能性,且还没有嵌合体的产生[11-13]。目前,人们普遍把人或小鼠ESCs培养体系直接应用于山羊ESCs和iPSCs中,但并没有研究证实过这些培养体系完全适用于giPSCs的生成,更没有验证过giPSCs上是否有培养基中添加的细胞因子(例如:LIF、bFGF)的受体。这些因子是否有作用以及起什么作用都没有被验证过[14-15]。本试验参考Vc(Vitamin C)、VPA(Valproic acid)和LiCl (Lithium chloride)等[16-19]小分子促进iPSCs重编程的相关报道,在培养基中添加不同的血清和小分子化合物,构建5组不同的培养基体系,优化giPSCs的诱导及培养条件,为建立完善而稳定的giPSCs培养体系提供试验依据。
1材料和方法
1.1阿尔巴斯绒山羊胎儿成纤维细胞(Goat fatal fibroblasts,GFFs)的培养
待阿尔巴斯绒山羊自然受孕40 d后,经手术从子宫中取出完整的羊胎儿(带羊水),将胎儿在75%的乙醇中短暂浸洗消毒后剥除羊膜,用D-PBS(Hyclone)溶液清洗2~3遍。在超净工作台中,从初具雏形的胎儿背部剪下部分组织,在60 mm 培养皿中,用无菌眼科手术剪剪碎,加入0.05% Trypsin-EDTA(Gibco)消化5~7 min,加入含有10% FBS(Hyclone)的DMEM(Hyclone)培养液终止消化。将悬液移入细胞培养皿中,置于恒温细胞培养箱(37 ℃,5% CO2饱和湿度)中培养24 h后换液。后期培养中隔天换液,培养过程中经常观察成纤维细胞生长状态,待细胞长至皿底85%的汇合度时对细胞做传代培养。
1.2饲养层的制备
铺于100 mm培养皿的2~5代的绒山羊胎儿成纤维细胞待覆盖皿底85%时,用终浓度为10 μg/mL的含有丝裂霉素C(MMC)的培养液处理细胞2~5 h。去除培养液,D-PBS清洗细胞5次,再用0.05% Trypsin-EDTA消化1 min,加入完全培养液终止消化,收集细胞悬液,1 000 r/min离心5 min,弃上清,加入完全培养基,制成细胞悬液。对细胞悬液进行计数,调整细胞浓度,将细胞悬液以1.5×104~2.0×104个/cm2的密度接种于铺有0.1%明胶(Sigma)的培养皿中,置于37 ℃恒温细胞培养箱中培养24 h,即可接种干细胞。
1.3慢病毒载体的包装及感染胎儿成纤维细胞
包被病毒的载体系统包括VS3G、gag及主载体(鼠源性的Oct4、Sox2、Klf4、c-Myc)。100 mm培养皿中培养293T细胞,皿中85%的细胞汇合时做脂质体转染。36 h后收集上清液,置于4 ℃冰箱,培养皿中再次加入10 mL 培养基,24 h后第2次收集上清。将2次上清毒液混合后,以1 000 r/min离心5 min,收集上清,用0.45 μm的滤器过滤,以1 mL/管冻存备用。
1.4慢病毒转染阿尔巴斯绒山羊胎儿成纤维细胞
绒山羊胎儿成纤维细胞以5×104/孔的密度接种于24孔板中,加入1 mL 混合病毒培养液(病毒上清液Oct4、Sox2、Klf4和c-Myc各150 μL,加400 μL培养基)培养24 h,重复感染3次。去除病毒混合液,D-PBS清洗细胞3次,0.05% trypsin-EDTA消化细胞后加入完全培养基终止消化,1 000 r/min离心5 min,做细胞计数,按每孔5×104的细胞数接种于铺有饲养层的6孔板中,加入不同ESCs培养基继续培养。
1.5碱性磷酸酶(Alkaline phosphatase,AP)染色鉴定
阿尔巴斯绒山羊iPSCs传代培养后的第8天,将待检测的iPSCs 用PBS漂洗3次,加入4%多聚甲醛固定2~5 min,用PBS冲洗2次后加入预先混合调配好的AP染色工作液,常温避光染色30 min后移去染色工作液,加入一定量的PBS后即可上镜观察。
1.6五组不同giPSCs培养基体系的设计
配置5组不同giPSCs培养基体系,培养基Ⅰ:20% KSR(Gibco)+Knock-out DMEM(Gibco)+0.1 mmol/L β-Mercaptoethanol(Millipore)+1% NEAA(Nonessential amino acid,Gibco)+2 mmol/L glutaMAX(Gibco)+1 ng/mL mLIF;培养基Ⅱ:20% FBS(Gibco)+Knock-out DMEM+0.1 mmol/L β-Mercaptoethanol+1% NEAA+2 mmol/L glutaMAX+1 ng/mL mLIF;培养基Ⅲ:20% FBS+Knock-out DMEM+0.1 mmol/L β-Mercaptoethanol+1% NEAA+2 mmol/L glutaMAX+1 ng/mL mLIF+5 ng/mL Vc(Sigma);培养基Ⅳ:20% FBS+Knock-out DMEM+0.1 mmol/L β-Mercaptoethanol+1% NEAA+2 mmol/L glutaMAX+1 ng/mL mLIF+5 ng/mL VPA(Sigma),病毒感染后的第5~12天用5 mmol/L的LiCL(Sigma)处理细胞;培养基Ⅴ:FBS+Knock-out DMEM+0.1 mmol/L β-Mercaptoethanol+1% NEAA+2 mmol/L glutaMAX+1 ng/mL mLIF+5 ng/mL Vc+5 ng/mL VPA,第5~12天用LiCl处理细胞。28 d后统计酶5×104个细胞中AP阳性克隆数,用第5代的细胞做实时定量PCR检测。
1.7干细胞标志基因的RT-PCR(Reverse transcription-polymerase chain reaction)和qPCR(Quantitative polymerase chain reaction)检测
待新传代的iPSCs生长至第7天,收取阿尔巴斯绒山羊iPSCs于无酶管中,依照“RNeasy Plus Micro Ki”(Qiagen)试剂盒说明书提取总RNA,用“Thermo Scientific”反转录试剂盒对总RNA进行反转录,获得样品的总cDNA。PCR反应体系:取总cDNA 1 μL,上下游引物各1 μL(2 μmol/L);应体系:94 ℃预变性5 min;之后94 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min共计30个循环;最后72 ℃延伸10 min。1.5%琼脂糖凝胶电泳检测扩增产物(表1)。qPCR反应时取反转录物2 μL,正反向引物各,0.5 μL(2 μmol/L),SYBR Premix Ex Taq 10 μL。反应条件为95 ℃预变性30 s,之后95 ℃ 5 s;60 ℃ 31 s,共计40个循环,加溶解曲线(表2)。

表1 RT-PCR基因引物序列表
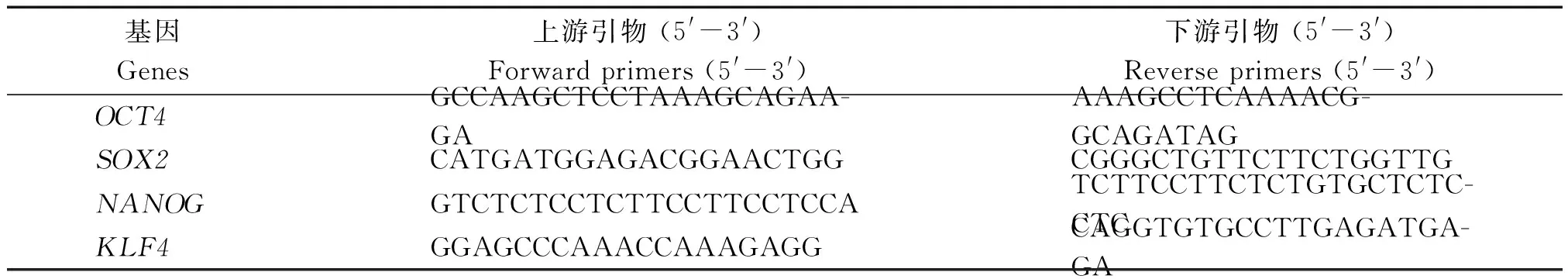
表2 qPCR基因引物序列表
1.8干细胞标记抗原的免疫荧光检测
将iPSCs传代接种于有盖玻片的铺好滋养层的24孔培养板中,待iPSCs生长至第7 天,可见iPSCs贴附于载玻片上生长,用D-PBS洗细胞3遍,4%多聚甲醛固定细胞30 min,再用0.1% Triton-X 100/PBS室温通透10~15 min,然后用0.4% BSA/PBS 漂洗3次,每次6~8 min。每孔加入500 mL山羊封闭血清,30 min后去除封闭上清液,加入已配置好的一抗稀释液(OCT4、SOX2、NANOG、 abcom)于4 ℃孵育过夜,次日去除剩余一抗液体,用0.4% BSA/PBS清洗3次,每次6~8 min。对应一抗分别加入相应的已配置好的二抗稀释液(abcom)于室温孵育1 h,弃去二抗上清,加入0.4% BSA/PBS清洗3次,每次5 min。最后加入DAPI(Sigma)染色剂稀释液染色3 min,弃去剩余稀释液,PBS清洗3次,小心取出盖玻片后扣封盖玻片于载玻片上,共聚焦显微镜下拍片观察。
1.9类胚体形成(Embryoid bodies,EBs)的检测
取生长状态良好的iPSCs,用D-PBS漂洗2~3次,加入Accutase(Stem cell)消化液3~4 min,加入knoc kout DMEM+20% FBS的培养液终止消化,离心再加入培养基悬浮细胞使其形成单细胞悬液。60 mm培养皿盖上滴细胞悬液后扣回皿盖制作成悬滴。皿中添入适当的PBS缓冲液,悬滴培养 8~10 d后,收集悬滴观察是否形成类胚体,并做RT-PCR检测[20]。
2结果与分析
2.1giPSCs的产生及AP染色鉴定
GFFs经病毒3次感染后(即重编程第4 天),接入铺有饲养层的培养皿中,加入5种不同的培养基诱导培养。在培养基Ⅰ、Ⅱ、Ⅲ中,约感染后的第12天,可观察到细胞形态产生改变,增殖速度增快,把细胞消化成单个细胞接种至新的饲养层上,约第18 天可见到山羊ESCs样的克隆,即山羊诱导性多潜能干细胞(giPSCs、giPSCsⅠ、giPSCsⅡ、giPSCsⅢ)。giPSCs克隆呈椭圆,边缘明显,与小鼠ESCs相似。
重编程第23天,可见giPSCs克隆明显增大,挑选部分克隆,Accutase酶消化成单个细胞后传代扩增培养,约9 d传代一次。giPSCsⅠ传代极易分化,只能传至4~5代;giPSCsⅡ传代易分化,可传至7~8代;giPSCsⅢ可以稳定传至15代。对第23 天的giPSCs克隆AP染色后发现,giPSCsⅠ、giPSCsⅡ不易被染色,染色较浅,AP阳性克隆较少;giPSCsⅢ染色较深,AP阳性克隆较多(图1-A、B、C,表3)。
在培养基Ⅳ、Ⅴ中,约重编程第15天,可见细胞形态改变,增殖速度加快,传代换饲养层后,第23 天才可初次见到giPSCs克隆(giPSCsⅣ、giPSCsⅤ)。重编程第28 天,可见细胞克隆明显增大,可挑选克隆并传代扩增培养,约10 d传代一次。对第25 天的giPSCs做碱性磷酸酶染色后发现,giPSCsⅣ、giPSCsⅤ易被染色,染色较深,AP阳性克隆多。giPSCsⅣ和giPSCsⅤ均可传至15代以上,克隆形态清晰,边缘整齐不易分化(图1-D、E、表3)。
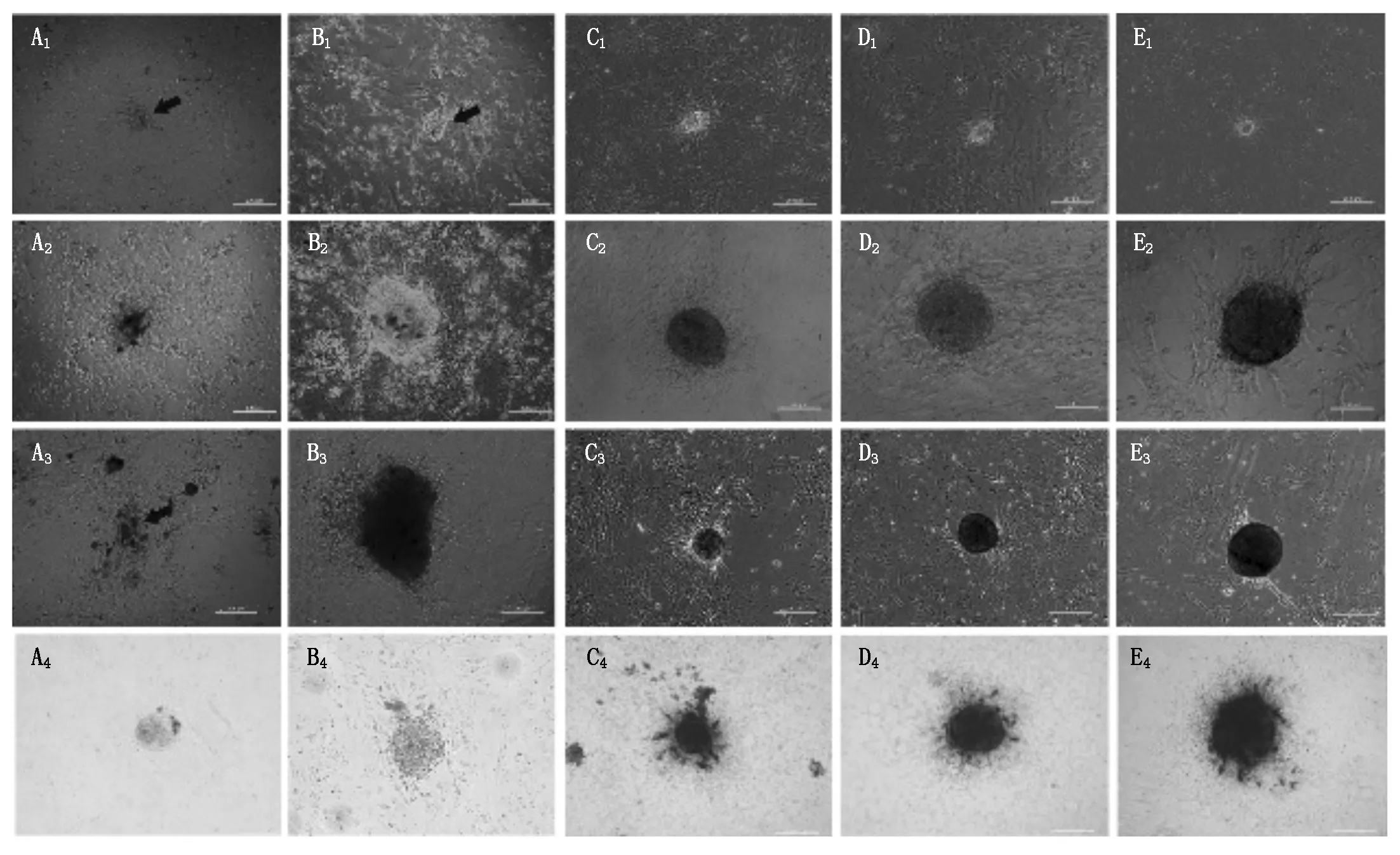
A1.重编程后第18 天的giPSCsⅠ克隆;A2.重编程后第23天的giPSCsⅠ克隆;A3.第5代已分化的giPSCsⅠ克隆;A4.重编程后第23 天的AP阳性giPSCsⅠ克隆;B1.重编程后第18天的giPSCsⅡ克隆;B2.重编程后第23天的giPSCsⅡ克隆;B3.第7代已分化的giPSCsⅡ克隆;B4.重编程后第23天的AP阳性giPSCsⅡ克隆;C1.重编程后第18天的giPSCsⅢ克隆;C2.重编程后第23天的giPSCsⅢ克隆;C3.第15代的giPSCsⅢ克隆;C4.重编程后第23 天的AP阳性giPSCsⅢ克隆;D1.重编程后第23天的giPSCsⅣ克隆;D2.重编程后第28 天的giPSCsⅣ克隆;D3.第15代的giPSCsⅣ克隆;D4.重编程后第28天的AP阳性giPSCsⅣ克隆;E1.重编程后第23天的giPSCsⅤ克隆;E2.重编程后第28天的giPSCsⅤ克隆;E3.第15代的giPSCsⅤ克隆;E4.重编程后第28天的AP阳性giPSCsⅤ克隆。标尺,200 μm。
A1.The reprogrammed giPSCsⅠon day 18;A2.The reprogrammed giPSCsⅠon day 23;A3.The differentiated giPSCsⅠon passage of 5;A4.The AP positive giPSCsⅠon day 23.B1.The reprogrammed giPSCsⅡon day 18;B2.The reprogrammed giPSCsⅡon day 23;B3.The differentiated giPSCsⅡon passage of 7;B4.The AP positive giPSCsⅡon day 23.C1.The reprogrammed giPSCsⅢon day 18;C2.The reprogrammed giPSCsⅢon day 23;C3.The giPSCsⅢon passage of 15;C4.The AP positive giPSCsⅢon day 23.D1.The reprogrammed giPSCsⅣon day 23;D2.The reprogrammed giPSCsⅣon day 28;D3.The giPSCsⅣon passage of 15;D4.The AP positive giPSCsⅣon day 28.E1.The reprogrammed giPSCsⅤon day 23;E2.The reprogrammed giPSCsⅤon day 28;E3.The giPSCsⅤon passage of 15;E4.The AP positive giPSCsⅤon day 28.Scale bars,200 μm.
图1giPSCs的生成
Fig.1The generation of giPSCs
2.2giPSCs克隆形成率的统计
病毒感染后的细胞分别培养于培养基Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ中,28 d后统计每5×104个细胞中AP阳性克隆数。结果发现,培养基Ⅰ中培养的细胞可平均形成(4.6±1.2)个阳性克隆。培养基Ⅱ中培养的细胞可平均形成(10.3±2.1)个阳性克隆。培养基Ⅲ中培养的细胞可平均形成(17.5±1.3)个阳性克隆。培养基Ⅳ的培养的细胞可平均形成(24.8±2.1)个阳性克隆。培养基Ⅴ中培养的细胞可形成平均(28.9±0.8)个阳性克隆(表3、图2)。综合上述结果,培养基Ⅴ比较适合诱导培养giPSCs。
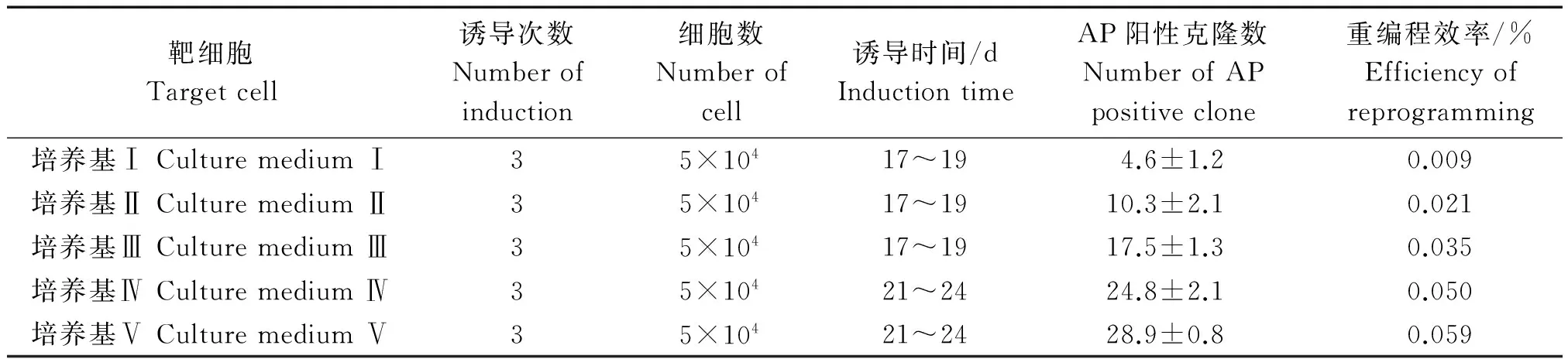
表3 giPSCs生成统计表

图2 不同培养基中AP阳性giPSCs克隆的统计
2.3giPSCs的多潜能性标记基因的RT-PCR及实时定量PCR检测
收集第3代的不同培养基中生成的giPSCs,提取总RNA做RT-PCR检测。结果显示,giPSCsⅠ、giPSCsⅡ、giPSCsⅢ、giPSCsⅣ、giPSCsⅤ中均有外源性基因Oct4、Sox2、Klf4、c-Myc和内源基因OCT4、SOX2、NANOG和KLF4的表达。电泳结果揭示,5组giPSCs中外源基因Oct4、Sox2、Klf4、c-Myc均高表达,每组间的表达差异不大。内源基因的表达上,giPSCsⅠ、giPSCsⅡ中的内源基因OCT4、SOX2、NANOG和KLF4的表达明显低于其他3组(图3)。
对第3代不同组的giPSCs分别做实时定量PCR,检测干细胞标记基因OCT4、SOX2、NANOG和KLF4的表达水平,以GFFs为阴性对照。结果发现,giPSCsⅠ中4种基因的表达量非常低,其中OCT4和NANOG的表达水平特别低,这与其易分化相应。giPSCsⅡ中各基因的表达量虽有提高,但还是处于低表达水平,giPSCsⅡ仍不能长期传代培养。giPSCsⅢ中4种基因的表达量均高于前2组。giPSCsⅣ中各基因的表达量均显著高于iPSCsⅡ中的,并高于giPSCsⅢ中的表达,其中OCT4和SOX2基因的表达水平提高得非常显著。giPSCsⅤ中基因OCT4、SOX2、NANOG的表达量均高于其他4组(图4)。由此认为,培养基Ⅴ适合giPSCs的诱导及培养。

图3 giPSCs的多能性标记基因的RT-PCR检测
2.4giPSCs的免疫荧光检测
采用细胞免疫荧光检测第5代的giPSCsⅡ、giPSCsⅢ、giPSCsⅣ、giPSCsⅤ克隆的胚胎干细胞特性标记蛋白。结果显示,4组giPSCs中,胚胎干细胞特性标记蛋白OCT4、SOX2、NANOG均呈阳性。这表明giPSCsⅡ~Ⅴ均已有ESCs的多能性标记蛋白的表达,具有多潜能性(图5)。

图4 giPSCs的OCT4、SOX2、NANOG和 KLF4等基因的qPCR检测
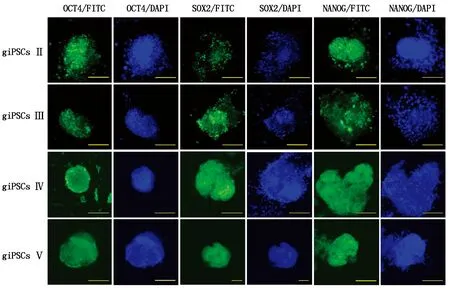
标尺,100 μm。图6同。Scale bars,100 μm.The same as Tab.6.
2.5giPSCs的类胚体形成
用无mLif、Vc、VPA的培养基悬浮培养第5代的giPSCsⅡ、giPSCsⅢ、giPSCsⅣ、giPSCsⅤ,8 d后可见类胚体细胞团(图6)。RT-PCR检测结果显示EBs中分别有内胚层标记基因SOX17,外胚层标记基因MEF2C和中胚层标记基因PAX6的表达。这显示所形成的类胚体具有三胚层分化,即giPSCsⅡ~Ⅴ体外均有多向分化潜能(图7)。
3讨论
体外维持多潜能干细胞的多潜能性和自我更新的分子机制一直是研究热点,也正是对其机制的不了解成为诱导和培养iPSCs的阻碍[21-23]。而且,与其ESCs相似,iPSCs的形态、增殖能力和相应的分子机制也有种属差异[24]。比如人和小鼠的iPSCs的形态和自我更新的分子机制都有明显的差异。相比于人和小鼠,giPSCs比较难获得,其相关分子机制的研究更是甚少。目前还未建立针对绒山羊ESCs和iPSCs的培养基体系。
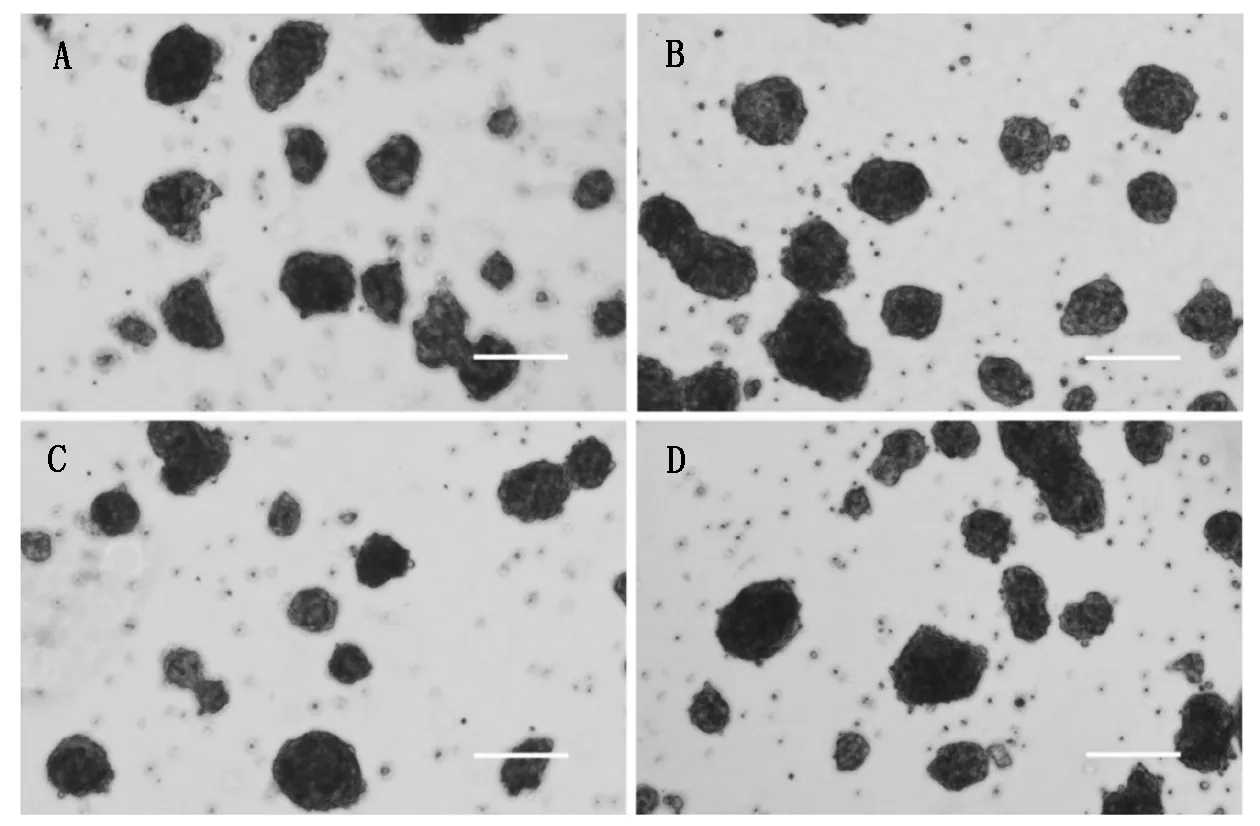
A.giPSCsⅡ自分化形成的EBs;B.giPSCsⅢ自分化形成的EBs;C.giPSCsⅣ自分化形成的EBs;D.giPSCsⅤ自分化形成的EBs。
A.The giPSCs Ⅱ differentiated into Embryoid bodies;B.The giPSCs Ⅲ differentiated into Embryoid bodies;C.The giPSCs Ⅳ differentiated into Embryoid bodies;D.The giPSCs Ⅴ differentiated into Embryoid bodies.
图6giPSCs分化形成三胚层分化的类胚体形成图
Fig.6The giPSCs differentiated into Embryoid
bodies of all three germ layersinvitro
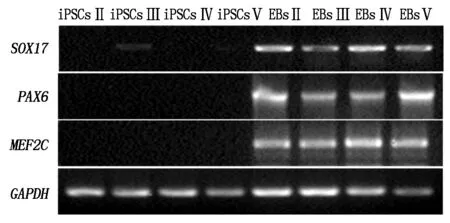
图7 EBs的三胚层标记基因的RT-PCR检测
对于常规细胞的体外培养,血清是不可或缺的培养基成分之一。然而,血清的成分不明确,容易引起多潜能干细胞的分化。这影响着血清在干细胞培养中的应用。目前,人和小鼠的iPSCs诱导培养中大多使用成分明确的无血清培养基。由于对绒山羊ESCs和iPSCs的研究较少,其分子机制不清楚,giPSCs的诱导培养基还不能缺少血清。本试验中也发现,血清替代物或无血清培养基还不能满足giPSCs的体外培养条件,这可能是因为血清中存在不知名成分对iPSCs的诱导培养起到关键作用[12,20]。本研究中所获得的giPSCs形态上与小鼠ESCs相似,同时发现,与小鼠ESCs培养条件相似的培养基体系更适合诱导培养giPSCs。研究发现,giPSCs的培养基体系中必须要添加LIF因子。LIF能有效抑制giPSCs的分化,并维持其自我更新,而bFGF并没有明显的作用。
近年来,越来越多的研究报道一些小分子化合物,如抗氧化剂、甲基化抑制剂及信号通路抑制剂显著提高重编程效率,有效维持iPSCs的多能性[7,25-26]。现有报道只用小分子化合物能够诱导小鼠成纤维细胞重编程形成iPSCs[27]。本研究选择了Vc、VPA和LiCL 3种小分子,对giPSCs的重编程条件进行优化。其中,Vitamin C是有机小分子,可以抗细胞衰老,降低细胞中活性氧的水平[16],从而提高重编程效率;VPA是一种组蛋白去乙酰化酶抑制剂,它可以提高某些基因的乙酰化水平,从而提高基因的表达水平[18];LiCL盐中的Li+是一种治疗神经紊乱疾病的药物,可以调节一些胞内信号通路来提高重编程效率[19]。
本试验中发现,Vc和VPA能有效提高giPSCs的重编程效率,提高内源的干细胞标记基因的表达水平。另外,与Vc相比,VPA能显著提高内源基因OCT4和SOX2的表达水平,而对基因KLF4和c-MYC并没有特别明显的作用。LiCl的作用与VPA相似,对基因OCT4和SOX2的作用明显。因此,将二者协同应用在同一种培养基中,其重编程效果优于只添加Vc的培养基。然而,培养基中添加VPA和LiCL,虽然增强了giPSCs的自我更新能力,却延长了细胞的重编程时间,所幸没有影响到giPSCs的增殖能力。本试验未能解释清楚此类现象的原因。另外,对giPSCs的传代培养过程中,并未撤去培养基中的VPA,这未影响giPSCs的状态及多潜能性。此举有别于Huangfu等[18]的报道。由于LiCL对细胞具有毒性,不能长期添加于培养基中。因此,在诱导培养过程中需要阶段性的添加LiCl,而传代培养过程中并不需要添加。在giPSCs诱导培养基中同时添加 Vc、VPA和LiCL,并未发现3种小分子之间相互抑制现象,三者之间具有较好的协同效果,能有效提高giPSCs的重编程效率。本试验中,我们虽然未能得到Esteben、Huangfu和Wang等[17-19]报道那样如此高的重编程效率,这也许与giPSCs诱导培养基体系远未达到完善的程度有关系,还是明显优化了giPSCs的诱导培养环境,为以后的相关研究提供了有益数据。
参考文献:
[1]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[2]Yu Jun-ying,Vodyanik M A,Smuga-otto K A,et al.Induced pluripotent stem cell lines derived from human somatic cells[J].Science,2007,318(5858):1917-1920.
[3]Evans M J,Kaufman M H.Establishment in culture of pluripotential cells from mouse embryos[J].Nature,1981,292(5819):154-156.
[4]Matsui Y,Zsebo K,Hogan B L.Derivation of pluripotential embryonic stem cells from murine primordial germ cells in culture[J].Cell,1992,70(5):841-847.
[5]Chen Shuibing,Do J T,Zhang Qisheng,et al.Self-renewal of embryonic stem cells by a small molecule[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(46):17266-17271.
[6]Li Yanjun,Mcclintick J,Zhong Li,et al.Murine embryonic stem cell differentiation is promoted by SOCS-3 and inhibited by the Zinc finger transcription factor Klf4[J].Blood,2005,105(2):635-637.
[7]Efe J A,Ding Sheng.The evolving biology of small molecules:controlling cell fate and identity[J].Philosophical Transactions of the Royal Society of London.Series B,Biological Sciences,2011,366(1575):2208-2221.
[8]Mikkelsen T S,Hanna J,Zhang Xiaolan,et al.Dissecting direct reprogramming through integrative genomic analysis[J].Nature,2008,454(720):49-55.
[9]Kelly R D,Sumer H,Mckenzie M,et al.The effects of nuclear reprogramming on mitochondrial DNA replication[J].Stem Cell Reviews,2013,9(1):1-15.
[10]Shi Yan,Do J T,Desponts C,et al.A combined chemical and genetic approach for the Generation of induced pluripotent stem cells[J].Cell Stem Cell,2008,2(6):525-528.
[11]Behboodi E,Bondareva A,Begin I,et al.Establishment of goat embryonic stem cells frominvivoproduced blastocyst-stage embryos[J].Molecular Reproduction and Development,2011,78(3):202-211.
[12]Ren Jiangtao,Pak Y,He Lixiazi,et al.Generation of hircine-induced pluripotent stem cells by somatic cell reprogramming[J].Cell Research,2011,21(5):849-853.
[13]Song Hui,Li Hui,Huang Mingrui,et al.Induced pluripotent stem cells from goat fibroblasts[J].Molecular Reproduction and Development,2013,80(12):1009-1017.
[14]Pant D,Keefer C.4 gene expression in cultures of inner cell masses isolated from in vitro produced andinvivo-derived bovine blastocysts[J].Reproduction Fertility&Development,2005,18(9):110-110.
[15]Keefer C L,Pant D,Blomberg L,et al.Challenges and prospects for the establishment of embryonic stem cell lines of domesticated ungulates[J].Animal Reproduction Science,2007,98(1/2):147-168.
[16]Esteban M A,Wang Tao,Qin Baoming,et al.Vitamin C enhances the Generation of mouse and human induced pluripotent stem cells[J].Cell Stem Cell,2010,6(1):71-79.
[17]Esteban M A,Pei Duanqing.Vitamin C improves the quality of somatic cell reprogramming[J].Nature Genetics,2012,44(4):366-367.
[18]Huangfu Danwei,Osafune K,Maehr R,et al.Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2[J].Nature Biotechnology,2008,26(11):1269-1275.
[19]Wang Quan,Xu Xinxiu,Li Jun,et al.Lithium,an anti-psychotic drug,greatly enhances the Generation of induced pluripotent stem cells[J].Cell Research,2011,21(10):1424-1435.
[20]Li Yang,Cang Ming,Lee A S,et al.Reprogramming of sheep fibroblasts into pluripotency under a drug-inducible expression of mouse-derived defined factors[J].PLoS One,2011,6(1):e15947.
[21]Reya T,Duncan A W,Ailles L,et al.A role for Wnt signalling in self-renewal of haematopoietic stem cells[J].Nature,2003,423(6938):409-414.
[22]Sato N,Meijer L,Skaltsounis L,et al.Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signaling by a pharmacological GSK-3-specific inhibitor[J].Nature Medicine,2004,10(1):55-63.
[23]Butler J M,Nolan D J,Vertes E L,et al.Endothelial cells are essential for the self-renewal and repopulation of Notch-dependent hematopoietic stem cells[J].Cell Stem Cell,2010,6(3):251-264.
[24]Ying Q L,Wray J,Nichols J,et al.The ground state of embryonic stem cell self-renewal[J].Nature,2008,453(7194):519-523.
[25]Zhu Saiyong,Ma Tianhua,Li Jun,et al.Recent advances in chemically induced reprogramming[J].Cell Cycle(Georgetown,Tex.),2011,10(6):871-872.
[26]Chen Shuibing,Takanashi S,Zhang Qisheng,et al.Reversine increases the plasticity of lineage-committed mammalian cells[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(25):10482-10487.
[27]Li Xiang,Zuo Xiaohan,Jing Junzhan,et al.Small-Molecule-Driven direct reprogramming of mouse fibroblasts into functional neurons[J].Cell Stem Cell,2015,17(2):195-203.
Optimization of Induced and Cultivation System of Arbas Cashmere Goat iPSCs TAI Dapeng,Naimentana,NUO Mingtu,WANG Xiao,LIANG Hao,LIU Dongjun
(Key Laboratory of Education Ministry of China for Research of Mammal Reproductive
Biology and Biotechnology,Inner Mongolia University,Huhhot010021,China)
Abstract:The induced pluripotent stem cells of Arbas cashmere goats (giPSCs) have significant values in genetic breeding,however,nowadays there are no compatible induced and cultivation medium systems of giPSCs.In order to establish a stable and complete induced and cultivation medium system,In this study,we showed that five different cultivation medium systems with different combination of serum and small molecules were able to generate the giPSCs.The growth status,subculture ability and reprogramming efficiency of giPSCs which derived from five different cultivation medium systems were observed,and pluripotency of these giPSCs was detected.At last,the influence of different combinations of small moleculars on the reprogramming efficiency and expression of pluripotent genes of giPSCs were analyzed.We found that serum promoted the generation of giPSCs and Vc,VPA and LiCL could accelerate the generation and self renewal of giPSCs.The research provided foundation for further study on stable and complete induced cultivation medium system of Arbas cashmere goat iPSCs,and experimental platform for embryonic stem cell line of Arbas cashmere goats.
Key words:Arbas cashmere goat;iPSCs;Induced and cultivation medium system;Small molecules
doi:10.7668/hbnxb.2016.02.018
中图分类号:S826
文献标识码:A
文章编号:1000-7091(2016)02-0106-08
作者简介:邰大鹏(1984-),男,内蒙古兴安盟人,博士,主要从事哺乳动物生殖生物学与生物技术研究。通讯作者:刘东军(1963-),男,内蒙古乌兰察布人,教授,博士,博士生导师,主要从事哺乳动物生殖生物学与生物技术研究。
基金项目:转基因生物新品种培育重大专项(2011ZX08008-002)
收稿日期:2016-02-16
