T型细胞质雄性不育小麦T763A的败育特点及育性恢复
2016-06-03蒙立颖石晓艺叶佳丽闫鹏娇刘子涵宋喜悦
段 阳,姚 盟,蒙立颖,石晓艺,齐 智,叶佳丽,闫鹏娇,刘子涵,宋喜悦
(西北农林科技大学 农学院,陕西 杨凌 712100)
T型细胞质雄性不育小麦T763A的败育特点及育性恢复
段阳,姚盟,蒙立颖,石晓艺,齐智,叶佳丽,闫鹏娇,刘子涵,宋喜悦
(西北农林科技大学 农学院,陕西 杨凌712100)
摘要:为了明确T型细胞质雄性不育小麦T763A败育的形态特征和细胞学特点及对T763A恢复系的选用提供依据,以不育系T763A,保持系763B,恢复系Tm3315B、Tm504B和TP731B为供试材料,进行外部形态特征观察和花粉粒制片(醋酸洋红、I2-KI和DAPI);并以中国春和黑麦为对照试材,对所有供试材料进行核型鉴定。结果表明:T763A败育类型为典败和圆败,成熟花粉粒皱缩无规则,内含物少,花粉败育,败育主要发生在单核晚期到二核期;所有供试材料均为非1B/1R类型;3个恢复系(Tm3315B、Tm504B和TP731B)恢复能力均较强,其中以Tm504B对T763A的恢复能力相对最好,这可能与T763A的胞质类型及与恢复系所含的恢复基因数量有关。
关键词:小麦;细胞质雄性不育;败育特点;核型鉴定;育性恢复
杂种优势是生物界普遍存在的一种现象,多种作物的杂交种已表现出显著的增产效应[1]。在杂种优势利用的过程中,雄性不育系因其可以省去人工去雄,降低生产成本,提高制种质量而被广泛利用并已取得了举世瞩目的成就。植物雄性不育指雄蕊不能产生具有正常功能的花粉而雌蕊发育正常,能够接受外来花粉而受精结实[2]。据不完全统计,已在多达43科、162属、320个种的617个亚种或种间杂种中发现了雄性不育现象[3]。而植物的雄性不育多为细胞质雄性不育(Cytoplasmic male sterility,CMS),其特点是花粉败育、雌蕊正常和母本遗传[4],是农作物杂种优势利用的基础,也是研究细胞质遗传的重要材料[3]。研究和掌握细胞质雄性不育作物的败育及育性恢复特点,对合理利用雄性不育进行杂交育种具有重要的意义。自1951年Kihara首次将普通小麦的细胞核导入尾形山羊草(Aegilopsacudaat)的细胞质中发现小麦细胞质雄性不育系以来,世界上开始了小麦杂种优势利用的研究[5],而我国杂交小麦的研究始于20世纪60年代[6]。Wilson和Ross在1962年首次育成T型(T.timopheevi)细胞质不育系并完成“三系”配套,为杂交小麦在生产上利用奠定了基础[7]。在众多的小麦细胞质雄性不育系统中,小麦T型雄性不育是研究时间最长,研究最深入的一种[8],其不育系易于保持且不育性状稳定,且具有非常大的应用潜力[9]。但因其存在不育系恢复源少、籽粒皱缩、发芽率低和所需要的恢复基因数目较多等问题,使T型杂种小麦的应用受到了一定程度的限制[10-11]。
但是近年来关于T型细胞质雄性不育小麦的败育特点和育性恢复的研究较少,并且对其有较高恢复度的恢复系研究很有限。为此,本试验以T型细胞质雄性不育小麦T763A为研究对象,通过比较外部形态特征和常规制片技术来观察其败育的生物学特性,利用分子标记和酸性凝胶电泳(Acid-polyacrylamide gel electrophoresis,A-PAGE)方法对其进行核型鉴定,并通过研究3个恢复系对其育性恢复能力来探索不育系T763A的育性恢复特点,旨在为明确T型细胞质雄性不育系败育的特点,选配具有较高恢复度的T型恢复系,进一步利用小麦杂种优势提供一定的理论依据。
1材料和方法
1.1试验材料
本试验选用具有T型细胞质的雄性不育系小麦T763A及其同型保持系763B,恢复系Tm3315B、Tm504B、TP731B以及T763A与3个恢复系的F1。同时,以中国春(Chinese spring,CS)和黑麦(SecalecerealeL.,Rye)作为辅助鉴定材料。所有材料均由西北农林科技大学二系杂交小麦课题组提供。
试验于2013-2015年在陕西杨凌西北农林科技大学实验农场进行。
1.2试验方法
1.2.1T型细胞质雄性不育小麦T763A败育的形态特征观察根据T型细胞质雄性不育小麦三系植株的外部形态选取不同花药发育时期的穗子,用镊子和解剖针小心取出小花,剥出花药。观察小花和花药的形态特征差异,并在显微镜(Nikon SMZ1500)下照相。
1.2.2T型细胞质雄性不育小麦T763A败育的细胞学观察采用I2-KI染色法在显微镜下观察三核期花粉育性并照相[12]。选取不育系、保持系和恢复系的不同发育时期的花药,用醋酸洋红压片,通过镜检确定花药发育的准确时期,并将不同时期花药分开置于FAA(Formalin-acetic acid-alcohol)固定液中,在4 ℃冰箱中保存备用。将固定好的花药置于载玻片上,滴30 μL的DAPI(4,6-联脒-2-苯基吲哚)染色液,盖上盖玻片,遮光处理约10 min后在荧光显微镜下观察照相。
1.2.31BL/1RS易位系的分子鉴定参考李荣华等[13]的方法,用CTAB提取小麦幼嫩叶片的DNA。选用2对特异性引物AF1/AF4(F:5′-GGAGACAT CATGAAACATTG-3′,R:5′-CTGTTGTTGGGCAGAAA G-3′)、Gli-B1(F:5′-GCAGACCTGTGTCATTGGTC-3′,R:5′-GATATAGTGGCAGCAGGATACG-3′)作为1BL-1RS的筛选标记。其中,AF1/AF4位于黑麦1RS上,Gli-B1位于普通小麦1BS上,以上引物均由上海生工生物工程技术公司合成。PCR反应体系为15 μL,其中含0.2 μLTaqDNA聚合酶(5 U/μL)、1.6 μL 10×Buffer(含Mg2+)、1.2 μL dNTPs(2.5 μmol/mL)、2 μL引物(20 μmol/mL)和2 μL模板DNA。AF1/AF4的扩增程序为94 ℃预变性5 min;然后34个循环,每循环为94 ℃变性40 s、56 ℃退火50 s、72 ℃延伸50 s;72 ℃终延伸10 min。Gli-B1引物的PCR退火温度为56 ℃,其余扩增程序同引物AF1/AF4。扩增产物中加入3 μL 1×Loading Buffer,0.8%~2.0%琼脂糖凝胶中加入适量核酸染料(10μL/100mL),在1×TAE缓冲液中电泳检测,胶片用GPS-8000凝胶成像仪扫描并照相。
1.2.41BL/1RS易位系的醇溶蛋白鉴定采用酸性凝胶电泳(Acid-polyacrylamide gel electrophoresis,A-PAGE)对小麦的醇溶蛋白进行电泳分析并照相,记录结果[14]。
1.2.5T型细胞质雄性不育小麦T763A的恢复系和F1育性调查和数据分析试验材料的恢复系和F1抽穗后,且在试材开花前,每个试材随机选取10个主茎穗子,套上自交袋。待小麦成熟后,调查单株有效穗数、有效小穗数、穗粒数,计算套袋穗的自交结实率。
自交结实率=套袋穗有效小穗基部2朵小花的结粒数/(套袋穗有效小穗数×2)×100%[15]。
数据通过Excel 2007软件进行整理和计算,用SPSS 19.0软件进行方差分析。
2结果与分析
2.1T型细胞质雄性不育小麦T763A败育的生物学特性
2.1.1T型细胞质雄性不育小麦T763A败育的外部形态特征不育系T763A、保持系763B以及恢复系Tm3315B的植株外部形态相似,各时期长势也基本相同。旗叶未完全抽出,倒二叶与倒三叶间距<10 cm,小麦穗长约5 cm,为减数分裂时期(图1-A、F、K);当旗叶刚刚完全抽出,穗长>5 cm时,小麦进入单核早期(图1-B、G、L);旗叶与倒二叶间距>3 cm,穗长>10 cm,但麦穗未完全抽出,为单核晚期(图1-C、H、M);小麦麦穗抽出大于一半,至完全抽出<2 cm,穗长>10 cm,为二核期(图1-D、I、N);当麦穗完全抽出>2 cm时,小麦进入三核期,随着小麦继续生长,不育系小麦T763A不开花,败育(图1-E),保持系小麦763B和恢复系小麦Tm3315B开花并散粉(图1-J、O)。
从花和花药上来看,不育系T763A雌蕊正常,花药颜色浅淡,大小不一,弯曲干瘪,上端尖细,基部略有分叉,花药不能正常开裂,不散粉(图2-A、D);保持系763B和恢复系Tm3315B的花药颜色鲜黄,大小略一致,直而饱满,上端和基部均有分叉,花药可正常开裂,散粉(图2-B、C、E、F)。

A~E.T763A;F~J.763B;K~L.Tm3315B;A、F、K.减数分裂期;B、G、L.单核早期;C、H、M.单核晚期;D、I、N.二核期;E、J、O.三核期。
2.1.2T型细胞质雄性不育小麦T763A败育的细胞学特点I2-KI染色结果表明,不育系T763A花粉粒败育,不育类型为典败和圆败,花粉粒大多皱缩无规则,少量为圆形,无内含物,对碘化钾无染色反应(图3-F);保持系763B和恢复系Tm3315B花粉粒经染色后,绝大多数花粉粒为圆形,染色充分而呈棕黑色,只有少数染败(图3-L、R)。
经醋酸洋红压片后观察发现,T763A、763B和Tm3315B的造孢细胞均能正常分裂形成小孢子母细胞,进而进行减数分裂并最终形成四分体(图3-A、G、M)。单核早期,3种材料的小孢子均能正常发育,无明显差异(图3-B、H、N)。T763A有将近一半的花粉粒在单核晚期和二核期皱缩无规则,没有形成核(图3-C、D);而763B和Tm3315B的花粉粒规则,能正常发育形成核,仅有极少数出现不正常形态(图3-I、J、O、P)。三核期,T763A花粉粒大部分不规则,内含物少,2个精核不能正常呈梭形而呈圆形,花粉粒败育(图3-E);763B和Tm3315B的绝大部分花粉粒呈规则的圆形,内含物丰富,能正常形成梭形精核(图3-K、Q)。

A、D.T763A;B、E.763B;C、F.Tm3315B。
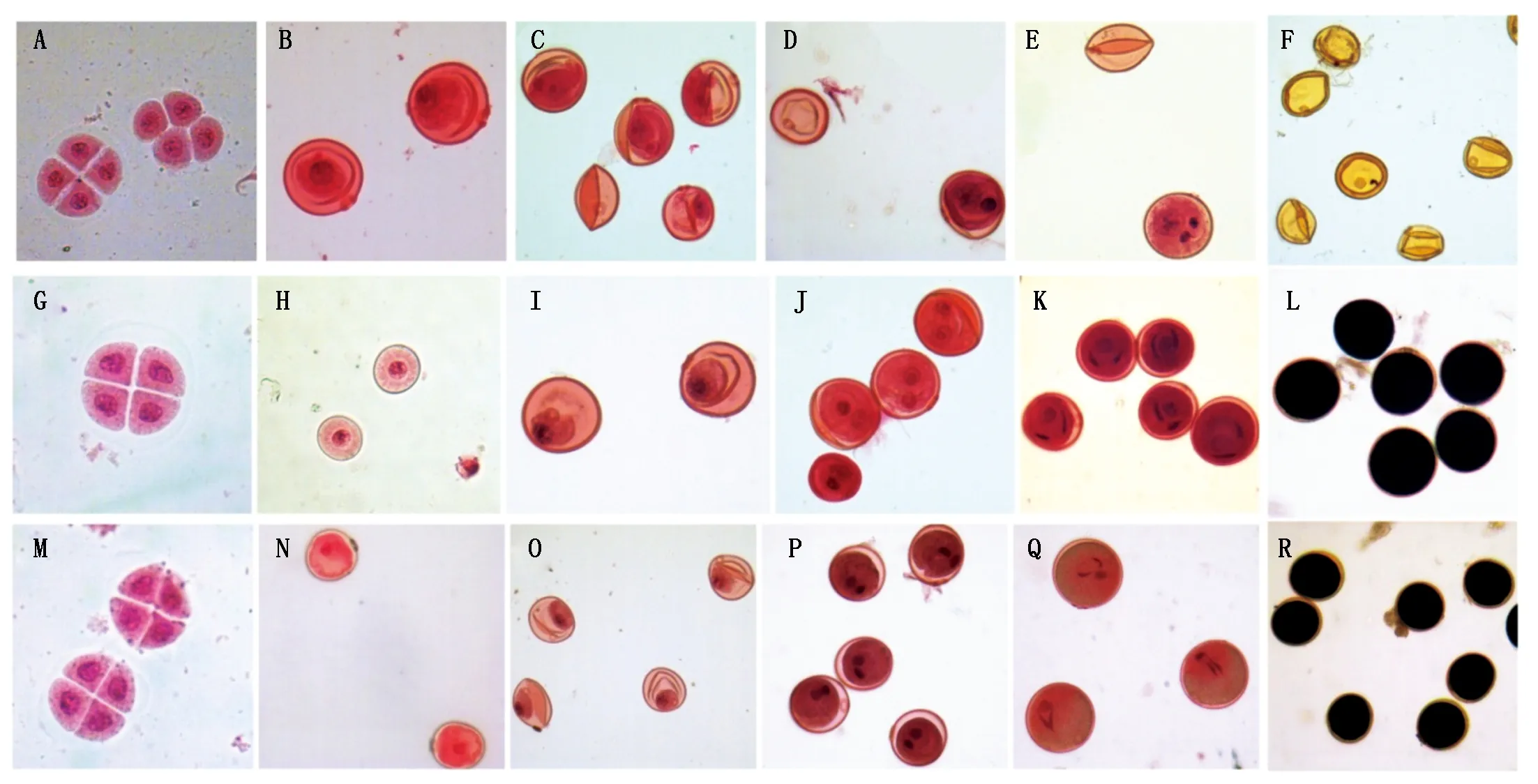
A~F.T763A;G~L.763B;M~R.Tm3315B;A、G、M.四分体时期;B、H、N.单核早期;C、I、O.单核晚期;D、J、P.二核期;E、F、K、L、Q、R.三核期。
经荧光染料(DAPI)染色制片后观察发现,四分体时期和单核早期,3种试材均正常发育,差异不明显(图4-A、B、F、G、K、L)。T761A在单核晚期和二核期,有一部分花粉粒形状不规则,不能正常可形成核(图4-C、D);763B和Tm3315B绝大多数花粉粒呈规则的圆形,可正常发育(图4-H、I、M、N)。三核期,763B和Tm3315B的小孢子能正常发育形成可育花粉,只有极少数不规则(图4-J、O);而T763A的花粉粒大部分皱缩无规则,2个精核呈圆形,不能正常形成梭形精核(图4-E)。
2.2T型细胞质雄性不育系T763A,保持系763B,恢复系Tm3315B的核型鉴定
2.2.11BL/1RS核型的PCR分子鉴定PCR扩增结果显示,除黑麦(Rye)外,中国春(CS)和其他供试材料均可由Gli-B1引物扩增出片段为220 bp的目的条带(图5-A),而只有黑麦可由AF1/AF4引物扩增出片段为1.5 kb大小的条带(图5-B)。AF1/AF4位于黑麦1RS上,Gli-B1位于小麦1BS上,由此初步说明,T型细胞质雄性不育系T763A,保持系763B,恢复系Tm3315B、Tm504B和TP731B均为非1B/1R类型。

A~E.T763A;F~J.763B;K~L.Tm3315B;A、F、K.四分体时期;B、G、L.单核早期;C、H、M.单核晚期;D、I、N.二核期;E、J、O.三核期。
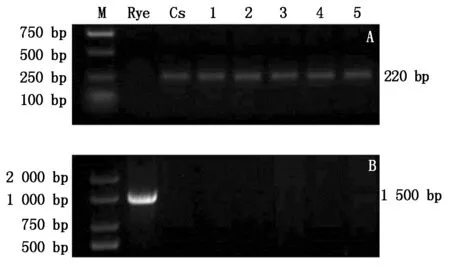
A.Gli-B1;B.AF1/AF4;M.DL2000;Rye.黑麦;CS.中国春。
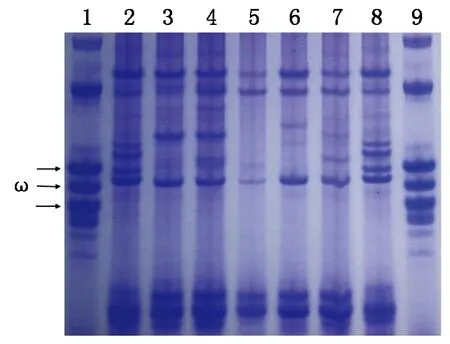
2.2.21BL/1RS核型的醇溶蛋白鉴定与普通小麦相比,黑麦(Rye)在高分子量区(ω区)含有较多的谱带,而中国春(CS)的谱带较少,因此与黑麦ω区谱带相同的为1BL/1RS,其余为非1BL/1RS。 通过酸性凝胶电泳(A-PAGE)方法对所有供试材料以及中国春(CS)和黑麦(Rye)醇溶蛋白进行电泳分析后发现,在ω区的醇溶蛋白,所有供试材料与中国春(CS)相似,而和黑麦(Rye)差异较大,这一结果和1BL/1RS核型的PCR分子鉴定结果相吻合,进一步说明所有供试材料均为非1B/1R类型(图6)。
2.3T型细胞质雄性不育小麦T763A的育性恢复
T型细胞质雄性不育系的3个恢复系育性均没有达到100%,但自交结实率均>90%,其中Tm504B和TP731B的自交结实率>95%,以Tm504B的自交结实率最高,平均值达到97.94%。从方差上来看,Tm504B和TP731B的育性波动较小,而Tm3315B的自交结实率波动最大,说明Tm3315B自身育性相对不太稳定(表1-A)。相比之下,3个恢复系与T型细胞质雄性不育系T763A的异交结实率却较低,均没有达到80%。其中,Tm504B对T763A的恢复能力较高,平均异交结实率为70.78%,而其他2个均接近60%。3个恢复系的异交结实率的变异幅度整体上比自交结实率高,其中以TP731B的变异幅度最大。虽然各恢复系与T763A的异交结实率相对较低,但由于T型细胞质雄性不育小麦不育性稳定,不易被恢复,因此,这3个恢复系对T763A的恢复能力还是较高的(表1-B)。
由表2的显著性差异分析可以看出,3个恢复系间自身的育性没有表现出明显差异(表2-A),而异交结实率间存在显著性差异(表2-B)。其中,Tm504B与其他2个恢复系均存在0.05显著水平的差异,而这2个恢复系间不存在显著性差异。结合表1-B,说明3个恢复系对T763A的恢复能力均较好,其中以Tm504B对T763A的恢复能力最好,且恢复力稳定。
1.黑麦;2.中国春;3.T763A;4.763B;5.Tm504B;

表1 三个恢复系的自交、异交结实率和方差

表2 三个恢复系间恢复力差异显著性比较
注:*.差异达0.05显著水平;表中数值为成对数据平均值的差数。
Note:*.Significant difference at the 0.05 level;The figures in the table are the differences between the averages of paired data.
3讨论与结论
3.1T型细胞质雄性不育小麦T763A败育的生物学特性讨论
多项试验表明,植物的雄性不育材料大多会出现不正常形态的花药和花粉粒。雄性不育的灯盏花管状花长、花丝长及花药长度均小于正常灯盏花,且其开花后花粉量少并均黏附于药壁上,不易被风吹散或昆虫带走;花药外形瘦弱,颜色偏白,无散出花粉[16]。栾兆水等[17]研究的雄性不育大葱(AlliumfistulosumL.)7504A的花粉粒比可育大葱7504B的扁,远极单沟形状不稳定,外壁网状纹饰较细。甘蓝型油菜(BrassicanapusL.)光温敏雄性不育系Huiyou50S的花粉粒少并且畸形,比可育株Huiyou50F的花粉粒明显小,干瘪、形态不规则,花粉壁在萌发沟处内陷,而可育株的花粉粒花粉壁表面呈网状,网眼不规则,具有3条萌发沟[18]。小麦光温敏雄性不育系337S花丝短,开花时花药不外露,有二次开颖现象;花药偏小且成熟后难以破裂,花粉粒少而小,大小不均匀,碘染色反应为不染色或不同程度的浅染色[19]。本试验发现,T型细胞质雄性不育小麦T763A不开花,不散粉,花药开花期大小不一,空瘪畸形,颜色浅淡,不开裂;保持系763B和恢复系Tm3315B正常开花并可散出大量花粉,成熟花药大小均匀,饱满,颜色鲜黄,上下两端均略有分叉。这与钱焕焕等[20]对YS型小麦温敏不育系A731在雄性不育状态下的细胞学研究结果相同。
不同的雄性不育材料有不同的花粉败育时期和败育原因[21],高等植物雄性器官从小孢子母细胞发育到二核花粉粒期间都有可能发生败育[22]。Laser等[23]曾指出,双子叶植物花粉败育多在四分体小孢子时期或小孢子早期发育阶段,而单子叶植物花粉败育则多数达到或接近二核期。陈雪平等[24]对3个茄子(SolanummelongenaL.)雄性不育系655A、679A和704A及其相应保持系655B、679B和704B观察发现,在减数分裂时期的前期Ⅰ,3个不育系的绒毡层细胞液泡化,核被挤向一侧,最终解体坏死,绒毡层以外的药壁细胞增生且排列不整齐,药室缢缩为条带状,孢母细胞被挤压变形而败育,从而推测前期Ⅰ为3种不育材料发生败育的关键时期。和茄子一样,辣椒(CapsicumannuumL.)也是双子叶植物。王兰兰等[25]研究表明,辣椒雄性不育系8A小孢子进入四分体时期之后,绒毡层细胞径向异常膨大高度液泡化进入侵药室,挤压形成不规则的四分体,皱缩凹陷,不能产生正常的小孢子。单子叶植物洋葱(AlliumcepaL.)雄性不育材料8A的绒毡层在花粉母细胞时期就与中层分离,并且不断膨大,最后逐渐解体。到四分体时期已经解体成染色很深的物质,不能供给小孢子发育所需要的营养物质,导致小孢子萎缩变形,最后败育[26]。姚雅琴等[27]提出,T型雄性不育系T-77(2)在单核早期,小孢子发育基本正常,细胞质中有相当于保持系同时期发育的内容物;其败育发生在单核花粉粒后期,败育后的花粉粒细胞器和细胞核均解体,仅剩下花药壁和极少具有ATP酶活性的细胞质。本研究中,T型细胞质雄性不育系T763A在小孢子四分体时期和单核早期与可育的保持系763B和恢复系Tm3315B没有差异,均能正常发育。在单核晚期和二核期,T763A有将近50%的小孢子形状不规则,细胞质被降解变成空壳;763B和Tm3315B能正常发育,只有一小部分小孢子出现不正常现象。T763A仅有一小部分小孢子能发育到三核期,但都不能形成2个正常的呈梭形的精核,花粉粒败育,败育类型为典败和圆败;在三核期,763B和Tm3315B绝大多数的小孢子可正常发育形成含有1个营养核和2个呈梭形精核的花粉粒,只有少数不正常。由此表明,T型细胞质雄性不育小麦T763A的败育时期在单核晚期到二核期。
3.2T型细胞质雄性不育系T763A及保持系和恢复系的核型鉴定分析
普通小麦的1B染色体短臂被黑麦1R染色体短臂取代而形成小麦-黑麦1BL/1RS易位系。其1RS染色体上携带有抗条锈病(Yr9)、叶锈病(Lr26)、秆锈病(Sr31)和白粉病(Pm8)基因[28],因而具有较好的广谱抗病性、适应性和丰产性。非1B/1R类型小麦雄性不育系Tsp3314A、Tsp427-3A和保持系Tsp3314B、Tsp427-3B无单倍体产生,而1B/1R类型小麦雄性不育系K3314A产生大量单倍体植株;非1B/1R类型的Tsp3314A和Tsp427-3A的光合速率也高于1B/1R类型的K43314A[29]。宋喜悦等[30]研究表明,非1B/1R类型的K型不育系KTSP3314A与10个普通小麦品种(系)(259、3665、TB902、F107、J18、R205、L783、503、3380和78115)所组成的组合比1B/1R类型的K型不育系K3314A所组成的组合更具易恢复性。因而快速而准确地对小麦进行核型鉴定,对品质改良和选配小麦杂交育种的强优势组合具有重要意义。目前,鉴定1BL/1RS易位的方法有很多,主要包括细胞学鉴定、凝胶电泳法、分子标记、酶联免疫法、单克隆抗体、高效液相色谱[31]。马小乐等[32]选取小麦甘春20号、甘春22号、甘春23号、甘春24号、武春4号、武春121、永良4号和和尚头8个品种的DNA为模板,采用黑麦碱(ω-secalin)基因引物进行PCR扩增,结果显示,甘春20号、甘春22号、甘春23号、甘春24号、武春4号、武春121均扩增出了1 076 bp的目的条带,初步鉴定它们为1B/1R类型。傅宾孝等[33]在研究中证实醇溶蛋白的A-PAGE具有方便快捷,重现性好,成本低廉,不受鉴定周期和环境影响等优点。
本试验采用PCR的分子鉴定和改良的醇溶蛋白A-PAGE鉴定相结合的办法,以黑麦(Rye)和中国春(CS)作对照。其中PCR分子鉴定选取2对引物AF1/AF4和Gli-B1,分别在黑麦1RS和普通小麦1BS上,双向进行供试材料的核型鉴定;试验结果表明,所有的供试材料均为非1B/1R类型。醇溶蛋白的A-PAGE鉴定结果表明,在ω区,所有供试材料与黑麦的条带均不相同,而与中国春的相似,进一步验证了PCR分子鉴定的结果。
3.3T型细胞质雄性不育小麦T763A的育性恢复特点
不育系植株表现为花粉败育,将含有恢复基因(Rf)的 恢复系与其杂交后,产生的杂交种育性恢复为可育,使杂种优势得以成功利用。关于植物雄性不育系的育性恢复问题,众多学者已展开了一系列研究,并取得了一定的研究成果。水稻、油菜、高粱、向日葵等作物均已大规模应用细胞质雄性不育系统产生杂交种,并取得巨大成功。杂种优势的利用,除了培育出不育系外,还应找到与之相对应的恢复系。石瑜敏等[34]曾指出,恢复系的选育与杂交水稻在产量、米质、抗性及适应性方面的改进和发展密切相关,而强恢复系的选育是进一步提高杂交水稻产量、品质及抗性的主要途径之一。曾俊莉等[35]提出,要想杂交组合具有较高的恢复度,应选育不育系中有显性易恢复基因,或恢复系中有显性恢复基因的亲本。恢复系并非只简单地由主效恢复基因控制,还受微效恢复基因和抑制基因的影响。张改生等[36]认为,异质不育系核内存在2种形式,即单对主效基因(或是1RS片段)和单对主效基因+控制基因;恢复系核内有4种形式,即主效恢复基因、主效恢复基因+微效可育基因、主效恢复基因+抑制基因、仅含微效可育基因。其中,以前者第2个和后者第2个的组配方式具有较高的恢复度。T型细胞质不育系的高恢复系很少,而稳定的恢复系则更少[37]。因而选育恢复力强及农艺性状优良的恢复系仍是T型杂种小麦强优势组合的关键。
本试验中,恢复系Tm3315B、Tm504B和TP731B的自交结实率均较高且稳定,三者间不存在显著性差异。3个恢复系与T763A杂交的F1结实率比恢复系自交结实率低,这可能与T763A的胞质类型和3个恢复系所含的恢复基因数量有关。但对T型细胞质雄性不育小麦来说,3个恢复系的恢复能力还是较高的,其中,Tm504B对T763A的恢复性最好,与其他2个恢复系存在显著性差异,可用来进行恢复基因的精细定位和进一步选育具有更强恢复能力的T型细胞质雄性不育系的恢复系。
T型细胞质雄性不育小麦T763A的败育类型为典败和圆败;败育发生在小孢子单核晚期;T763A和保持系763B、恢复系Tm3315B及其他恢复系均为非1B/1R类型;T763A的不育性稳定,较难恢复,其中对其恢复性较好的恢复系为Tm504B,可用于后期T型细胞质不育系恢复基因的精细定位。
参考文献:
[1]Guo R X,Sun D F,Tan Z B,et al.Two recessive genes controlling thermophotoperiod-sensitive male sterility in wheat[J].Theoretical and Applied Genetics,2006,112(7):1271-1276.
[2]杨莉芳,掉线民.植物细胞核雄性不育基因研究进展[J].植物遗传资源学报,2013,14(6):1108-1117.
[3]Kaul M H.Male sterility in higher plant[Z].1988.
[4]姚盟,叶佳丽,杨智全,等.5种细胞质雄性不育小麦败育的生物学特性及育性恢复[J].麦类作物学报,2015,35(12):1676-1684.
[5]巴青松,张改生,李桂萍,等.小麦线粒体与细胞质雄性不育关系的研究进展[J].麦类作物学报,2015,35(1):16-21.
[6]赵昌平.中国杂交小麦研究现状与趋势[J].中国农业科技导报,2010,12(2):5-8.
[7]鲁成.小麦细胞质雄性不育的研究进展[J].陕西农业科学,2009,55(3):69-73.
[8]关荣霞,郭小丽,刘冬成,等.小麦T型细胞质雄性不育恢复基因Rf6的ISSR标记分析[J].中国农业科学,2002,35(11):1297-1301.
[9]李志宽,祝万万,马守才,等.小麦T型细胞质雄性不育恢复基因Rf1和Rf4的SSR标记分析[J].农业生物技术学报,2014,22(9):1114-1122.
[10]关荣霞,刘冬成,张爱民.小麦T型雄性不育恢复基因的遗传分析及RAPD标记[J].农业生物技术学报,2001,9(2):159-162.
[11]李正德,王成社,杨天章,等.小麦T型雄性不育系及其杂交种种子皱缩问题的研究[J].西北农林科技大学学报:自然科学版,1987,15(2):1-9.
[12]Song X Y,Qian H H,Zhang L L.Cytogenetic analysis of cytoplasmic male sterility in wheatline KTP116A and molecular mapping of two thermo-sensitive restoration genes[J].Euphytica,2014,196(1):129-136.
[13]李荣华,夏岩石,刘顺枝,等.改进的CTAB提取植物DNA方法[J].实验室研究与探索,2009,28(9):14-16.
[14]蒙立颖,石晓艺,胡甘,等.K型温敏雄性不育小麦KTM3315A的鉴定及花粉败育特点的初步分析[J].中国农业大学学报,2015,20(5):1-8.
[15]齐智,石晓艺,蒙立颖,等.K型雄性不育小麦育性恢复基因的遗传特点及育性稳定性研究[J].中国农业大学学报,2015,20(4):12-18.
[16]赵峥,王定康,杨建文,等.灯盏花雄性不育种质鉴定与花药发育的细胞学研究[J].西北植物学报,2013,33(2):287-294.
[17]栾兆水,孔令让,魏佑营,等.雄性不育和可育大葱花粉细胞形态学比较研究[J].山东农业大学学报,1992,23(1):59-66.
[18]葛娟,郭英芬,于澄宇,等.甘蓝型油菜光、温敏雄性不育系Huiyou50S花粉败育的细胞学观察[J].作物学报,2012,38(3):541-548.
[19]程旭东,孙东发,荣德福.新型光温敏小麦不育系337S的组织结构研究[J].武汉植物学研究,2004,22(6):495-499.
[20]钱焕焕,罗钊,李艳丽,等.YS型小麦温敏不育系A731雄性败育的细胞学研究[J].麦类作物学报,2012,32(6):1026-1031.
[21]朱正斌,张宏根,刘超,等.四种细胞质六千辛A粳稻不育系育种利用特性的比较研究[J].作物学报,2010,36(1):1-8.
[22]耿三省,王志源,蒋健箴,等.辣椒雄性不育系小孢子发生的细胞学观察[J].园艺学报,1994,21(2):165-169.
[23]Laser K D,Lersten N R.Anatomy and cytology of microsporogenesis in cytoplasmic male sterile angiospem[J].Botany Review,1972,38:425-454.
[24]陈雪平,罗霜霞,轩淑欣,等.茄子雄性不育系花粉败育的细胞学观察[J].植物遗传资源学报,2013,14(4):754-758.
[25]王兰兰,王晓林,魏兵强,等.辣椒雄性不育系及保持系小孢子发育的细胞学比较[J].西北农业学报,2015,24(1):115-118.
[26]王瑞丽,马荣丽,成妍,等.洋葱细胞质雄性不育系及保持系小孢子发生的细胞学观察[J].中国农学通报,2016,32(1):43-46.
[27]姚雅琴,张改生,刘宏伟,等.K型和T型小麦雄性不育花粉粒形态与细胞化学定位[J].中国农业科学,2002,35(2):123-126.
[28]Mcintosh R A,Gale M D,Hart G E.Catalogue of gene symbols for wheat[C]//Proceedings of the 8th International Wheat Genetics Symposium[M].Beijing:China Agriculutural Science and Technology Press,1993:1330-1550.
[29]马翎健,胡银岗,宋喜悦,等.1B/1R与非1B/1R小麦K型雄性不育系比较研究[J].华北农学报,2006,21(4):5-8.
[30]宋喜悦,方鹏,马翎健,等.非1B/1R类型和1B/1R类型小麦K型雄性不育系比较研究[J].西北农林科技大学学报:自然科学版,2002,30(1):1-4.
[31]任燕,Graybosch R A,王涛.小麦中的1BL/1RS染色体易位[J].麦类作物学报,2006,26(3):152-158.
[32]马小乐,李葆春,孟亚雄,等.甘肃小麦品种1BL/1RS易位系鉴定及面筋熟制特性分析[J].农业生物技术学报,2015,23(6):747-754.
[33]傅宾孝,于光华,王乐凯,等.小麦醇溶蛋白电泳分析的新方法[J].作物学报,1993,19(2):185-187.
[34]石瑜敏,王威豪,刘百龙,等.杂交水稻强恢复系桂362的选育与应用[J].作物杂志,2011,5:126-128.
[35]曾俊莉,拉拉古丽,钱焕焕,等.K型小麦雄性不育系育性恢复及产量相关性状分析[J].麦类作物学报,2013,33(3):461-465.
[36]张改生,赵惠燕,吴兆苏,等.几类异质1B/1R小麦雄性不育系育性稳定性与育性恢复性的研究[J].中国农业科学,1996,29(5):42-51.
[37]Chen Q F.Improving male fertility restoration of common wheat forTriticumtimopheeviicytoplasm[J].Plant Breeding,2003,122(5):401-404.
Abortion Characters and Fertility Restoration of T763A,a Male Sterile Line withT.timopheeviCytoplasm
DUAN Yang,YAO Meng,MENG Liying,SHI Xiaoyi,QI Zhi,YE Jiali,YAN Pengjiao,LIU Zihan,SONG Xiyue
(College of Agronomy,Northwest A&F University,Yangling712100,China)
Abstract:T type male sterile wheat line is a valuable material for heterosis study and utilization.In order to make the morphological and cytological characteristics of T763A clear,as well as provide reliable basis for the selection of restorer lines,we used male sterile line T763A,maintainer line 763B and restorer lines(Tm3315B,Tm504B and TP731B)as materials.The external morphology and pollen grain production(Acetic Acid Magenta,I2-KI and DAPI)were observed;the karyotype of all the materials was identified by molecular marker technology and A-PAGE,with Chinese spring and Secale cereale L. as control materials.The results showed that the pollen sterility type of male sterile line T763A was stained as spherical abortive;the mature pollen grains were shrunk out of shape and had little inclusion,mean while,the pollen grains were infertile;the sterility of T763A occurred between late uninucleate and binucleate stage;all the materials were non 1B/1R;the restoring capability of the three restorer lines was high,and among them,Tm504B was the best restorer line of T763A,the reasons for this might in connection with the type of cytoplasm of T763A and the gene counts of the restorer lines.
Key words:Wheat;Cytoplasmic male sterility;Abortion characters;Karyotyping;Restoration of fertility
doi:10.7668/hbnxb.2016.02.017
中图分类号:S512.03
文献标识码:A
文章编号:1000-7091(2016)02-0098-08
作者简介:段阳(1991-),女,河南新乡人,在读硕士,主要从事小麦雄性不育和分子生物学研究。通讯作者:宋喜悦(1968-),男,内蒙古赤峰人,副教授,博士,主要从事小麦雄性不育和杂种优势利用研究。
基金项目:国家自然科学基金项目(31271792);陕西省农业攻关项目(2014K02-04-01);西北农林科技大学唐仲英育种基金项目
收稿日期:2016-02-04
