重组减蛋综合征病毒KnobS干酪乳杆菌的构建与表达
2016-06-03郭建军邱小忠付锦楠
郭建军,袁 林,曾 静,邱小忠,付锦楠
(江西省科学院 微生物研究所,江西 南昌 330096)
重组减蛋综合征病毒KnobS干酪乳杆菌的构建与表达
郭建军,袁林,曾静,邱小忠,付锦楠
(江西省科学院 微生物研究所,江西 南昌330096)
摘要:以干酪乳杆菌为传递载体,以开发食品级安全的减蛋综合征病毒疫苗为目标,构建了一个温度敏感型自杀型质粒系统pORZP-UKD。将该质粒电转化到干酪乳杆菌L.casei中,经过2次升温处理和5-氟尿嘧啶抗性筛选,挑选阳性克隆,采用 PCR和 SDS-PAGE方法进行鉴定。KnobS基因整合到干酪乳酸杆菌基因组内,并实现融合蛋白KnobS的分泌表达。表明得到了一株具有无任何选择性标记、携带有KnobS表达盒元件的基因组整合的重组干酪乳酸杆菌KnobSΔupp L.casei,且整合的外源基因能够随着细菌的复制而进行表达,为减蛋综合征病毒免疫保护性抗原KnobS疫苗的进一步研制提供了试验数据。
关键词:干酪乳杆菌;减蛋综合征病毒KnobS蛋白;基因组表达
减蛋综合征病毒(Eggdropsyndromevirus,EDSV)是禽腺病毒Ⅲ群中唯一的成员[1]。其宿主范围较广,毒株毒力差异较大,主要引起以群发性产蛋下降、产蛋异常、蛋体畸形、蛋质低劣等为特征的传染病[2]。纤维蛋白是腺病毒的主要结构蛋白,可以识别细胞膜上的特异性受体[3],也可以阻断大分子的合成,抑制病毒的增殖[4],且带有主要的属和亚属特异性抗原决定簇和次要的种特异性抗原决定簇,即减蛋综合征病毒主要免疫保护性抗原纤维蛋白 KnobS就是 EDSV 的主要保护性抗原成分[5]。病毒通过肠道黏膜吸收或感染引起动物发病,以增强黏膜免疫为主的免疫方式是预防该病的有效措施[1-3]。
乳酸菌作为人和动物肠道、呼吸道和泌尿生殖道中的常在益生菌群之一[6],在食品发酵、饮品和饲料等领域有着悠久的应用历史,早被公认为安全级微生物,它能维持动物肠道菌群平衡,促进动物对营养物质的吸收,提高动物机体的免疫力,特别是在提高人和动物的胃肠道黏膜免疫功能方面[7-9]。乳酸菌作为宿主菌表达外源蛋白或抗原的研究取得了一定进展,并已证明重组乳酸菌可有效提高黏膜免疫系统提呈抗原及诱导特异性免疫应答的能力,具有成为新型口服疫苗诱导黏膜免疫应答的潜力[6,10],这为进一步将乳酸菌开发安全级的新型活载体疫苗诱导黏膜免疫奠定了重要的理论和实践基础[11]。目前对于乳酸菌作为抗原传递系统表达外源抗原的研究主要集中在质粒表达的研究方面[10,12]。质粒表达系统存在筛选的抗生素抗性基因,以此作为疫苗可能会使动物产生抗生素耐药性问题[6,13],不符合生物安全标准。而且,质粒表达系统存在不稳定性,质粒容易丢失等缺陷。
本研究以干酪乳杆菌为传递载体,以开发食品级安全的减蛋综合征病毒疫苗为目标,成功构建得到了一株具有无任何选择性标记、携带有KnobS表达盒元件的基因组整合的重组干酪乳酸杆菌,且整合的外源基因能够随着细菌的复制而进行表达,为进一步研究 EDSV纤维蛋白KnobS生物学功能奠定了基础,并对开发预防EDSV的基因工程疫苗的研究具有一定参考作用。
1材料和方法
1.1试验材料
1.1.1菌株、质粒、培养基和生长条件大肠杆菌DH5α、干酪乳杆菌Lactobacilluscasei393-Δupp[13]、质粒 pMG36e-UP/LTB-KnobS和经改造质粒 pORZP[14]由江西省科学院微生物研究所生物工程中心保存和提供;克隆用质粒 pMD18T-simple 购自大连宝生物公司。
干酪乳杆菌常规培养在 MRS培养基,30 ℃静止培养;大肠杆菌常规培养用 LB 培养基,37 ℃振荡培养。干酪乳杆菌感受态制备用培养基以及方法参照文献[8]。
1.1.2主要试剂和材料限制性内切酶、高保真DNA聚合酶、T4DNA连接酶、蛋白质Marker、DL2000 Marker、克隆载体pMD18T-simple均购自大连TaKaRa公司;MRS培养基购自Oxoid公司;基因组DNA提取试剂盒、质粒抽提试剂盒、DNA纯化试剂盒购自爱思进公司;电击杯为BioRad产品;引物委托上海生工公司合成,其余试剂均为国产分析纯。
1.1.3引物设计根据质粒 pMG36e-UP/LTB-KnobS上KnobS基因表达盒的基因序列[4]和 GenBank 中已登陆的干酪乳杆菌slpA基因的全序列[12],设计3对引物分别用于扩增质粒 pMG36e-UP/LTB-KnobS上KnobS基因表达盒片段、含干酪乳杆菌slpA基因的同源重组左右臂slpA-up和slpA-down,在各上下游引物的5′端加入保护碱基和酶切位点(划线部分),各限制性内切酶位点为构建元件定向克隆到构建骨架质粒载体 pORZP而设计。各引物序列见表1。

表1 引物序列及酶切位点
1.2试验方法
1.2.1扩增KnobS基因表达盒KnobS-cassette从质粒pMG36e-UP/LTB-KnobS扩增含启动子P32、分泌信号肽基因序列(ssusp)、具有黏膜免疫佐剂的大肠杆菌不耐热肠毒素B亚单位(LTB)及编码减蛋综合征病毒主要免疫保护性抗原纤维蛋白KnobS基因序列的基因表达盒基因片段,并设计引物K1/K2,以含有KnobS基因表达盒全序列的 pMG36e-UP/LTB-KnobS为模板进行 PCR 扩增,PCR 产物经1.0%琼脂糖凝胶电泳检测并回收。目的片段KnobS-cassette与克隆载体pMD18T-simple连接,转化后,涂布于含有氨苄抗性的 LB培养基,挑选阳性结果,提取质粒用SalⅠ/XmaⅠ酶切初步鉴定,进行测序,所获得质粒命名为pMD18-KnobS。
1.2.2同源重组臂的扩增根据 GenBank(Accession:M60178.1)公布的LactobacilluscaseiATCC 334基因序列和GenBank(Accession:X76884)公布的slpA基因序列设计引物P1/P2和D1/D2,并分别以Lactobacilluscasei393基因组为模板扩增同源重组左右臂slpA-up和slpA-down,引物设计见表1。然后连接到TaKaRa的pMD-18T simple 载体。转入DH5α,蓝白斑筛选,提取质粒PCR扩增鉴定和测序验证,获得质粒分别命名为pMD18-slpA-up和pMD18-slpA-down。
1.2.3同源整合载体 pORZP-UKD 的构建质粒 pORZP 和质粒 pMD18-KnobS分别用限制性内切酶SalⅠ和XmaⅠ进行双酶切,回收酶切过的目的片段,用 T4DNA连接酶将两基因片段连接得到质粒pORZP-K。将质粒pORZP-K和质粒pMD18-slpA-up分别用限制性内切酶PstⅠ和SalⅠ进行双酶切,纯化目的片段,将同源左臂slpA-up基因片段连接到pORZP-K 双酶切得到的较大片段上,获得重组质粒 pORZP-UK。质粒pORZP-UK和质粒pMD18-slpA-down分别用限制性内切酶SacⅠ和XmaⅠ进行双酶切,回收两目的酶切片段。将同源右臂基因片段slpA-down连接到 pORZP-UK双酶切得到的较大片段上,得到最终目的同源整合载体pORZP-UKD。
将以上构建得到的质粒载体转化大肠杆菌DH5α,提取质粒 pORZP-UKD,采用酶切和 PCR 方法鉴定阳性克隆并保存备用。
1.2.4同源整合载体转化干酪乳杆菌将同源整合载体质粒pORZP-UKD电转化入携带有辅助质粒pTRK669的干酪乳杆菌Lactobacilluscasei393-Δupp的感受态细胞中,转化后的干酪乳杆菌涂布于同时含有氯霉素(5 mg/L)和红霉素(5 mg/L)的MRS培养基平板上;挑选出长势较好的菌落,在高温(42 ℃)和含抗性(5 mg/L红霉素) 双重选择压力下连续传代培养3次,使之进行同源重组;然后通过重组菌在含100 μg/L 5-氟尿嘧啶(5-FU)的MRS培养基上,37 ℃培养,反复传代多次,以筛选整合突变体。
1.2.5重组干酪乳杆菌的筛选与鉴定经筛选得到的整合突变体提取基因组DNA,通过 PCR 验证确定基因KnobS是否已经整合到干酪乳杆菌的染色体上。通过 PCR 扩增质粒载体上存在的基因KnobS,以验证载体是否已整合。将选择得到的整合转化子接种至含5-氟尿嘧啶的MRS液体试管中,37 ℃振荡培养过夜,提取其基因组 DNA,用引物K1/K2进行PCR检测,并回收目的片段送上海生工测序。同时将培养后的菌液先离心去除菌体后,取 30%和 80%(NH4)2SO4之间的沉淀物用少量去离子水溶解,进行 SDS-PAGE 电泳。
2结果与分析
2.1KnobS基因表达盒KnobS-cassette的扩增
以pMG36e-UP/LTB-KnobS质粒DNA 为模板进行PCR 扩增,扩增产物经1%琼脂糖凝胶电泳检测,可清晰见到约970 bp的特异性扩增带,与预期结果相符(图1-A)。用凝胶DNA回收试剂盒回收产物经纯化后克隆至 pMD18T-simple,用SalⅠ/XmaⅠ消化后可产生一条约1 000 bp的片段(图1-B),与预计相同。测序结果表明PCR 产物与KnobS-cassette基因序列完全一致。
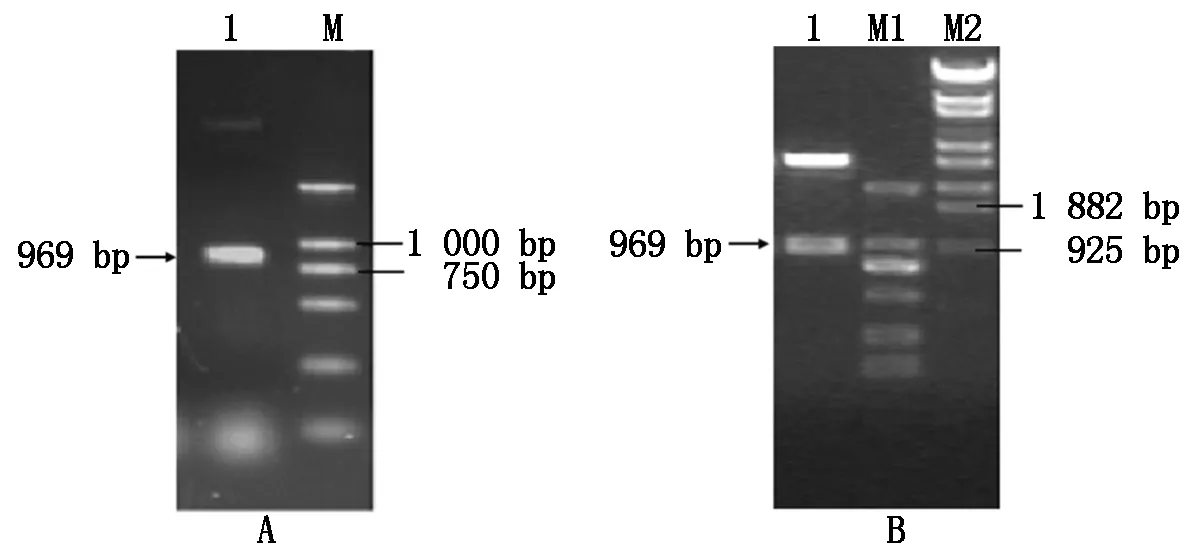
A:1.PCR扩增KnobS-cassette;M.DL2000 DNA Marker。
2.2同源整合载体的构建
以Lactobacilluscasei393基因组DNA 为模板进行PCR 扩增,用 P1/P2 PCR 扩增得到615 bp的slpA-up;引物 D1/D2 PCR扩增得到567 bp的slpA-down;PCR 结果见图2,由图可知,成功获得同源重组臂slpA-up和slpA-down,分别连接到pMD18T-simple载体,用相应的酶进行鉴定,可切出约610 bp 的slpA-up和560 bp 的slpA-down,测序正确,分别命名为 pMD18-slpA-up和pMD18-slpA-down,表明构建成功。
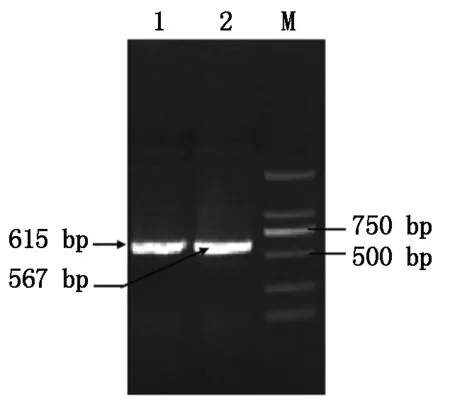
1.同源重组左臂slpA-up;2.同源重组右
依次将克隆得到的KnobS基因表达盒KnobS-cassette(969 bp )、同源重组左臂slpA-up基因(615 bp)和同源重组右臂slpA-down片段(567 bp )构建至质粒pORZP上。 成功构建得到整合表达载体pORZP-UKD,其片段大小为 5 246 bp,整个构建过程见图3。

图3 同源整合载体pORZP-UKD的构建
2.3同源重组及鉴定
同源整合载体pORZP-UKD电转化Lactobacilluscasei393-Δupp感受态细胞,涂布于含红霉素和氯霉素抗性的平板,挑取单菌在含红霉素的MRS平板,42 ℃培养,传代培养3次,使之进行同源重组;然后通过在含5-氟尿嘧啶的MRS培养基上,37 ℃培养,反复传代多次,筛选整合转化子,选取在含100 μg/L 5-氟尿嘧啶的平板上长势较好的单菌落作为突变体,以此作为重组菌株,KnobS基因的整合过程见图4。

图4 同源整合模式
将筛选得到突变体提取基因组DNA,通过PCR扩增同源整合载体上存在的KnobS基因表达盒KnobS-cassette序列,以确定KnobS基因是否已经整合到干酪乳杆菌的染色体上,并以初始菌株Lactobacilluscasei393-Δupp作为阴性对照。 结果见图 5。凝胶电泳检测发现筛选到的 5 个突变体的基因组均扩增出KnobS基因特异性条带,且大小与预计相符,而出发菌株Lactobacilluscasei393-Δupp无此条带,这证明构建的重组质粒载体pORZP-UKD中的KnobS基因已整合到干酪乳杆菌基因组中。

M.DNA Marker DL2000;1.初始菌株;2~6.重组菌株转化子。
2.4同源整合载体的功能验证
收集重组菌培养的菌液,进行SDS-PAGE电泳分析,凝胶经考马斯亮蓝G250染色和甲醇/冰乙酸脱色后,放入凝胶成像系统中分析目的蛋白,结果表明(图6-A),重组蛋白 KnobS以分泌型表达的形式表达,符合预期大小约 33 kDa。利用KnobS抗体对目的蛋白进行免疫印迹分析可见目的条带且无杂带,表达产物重组蛋白KnobS能被阳性血清所识别,也验证了表达产物为蛋白KnobS(图6-B),说明实现KnobS基因同源整合到干酪乳杆菌中,并能够分泌表达具有免疫学活性的重组融合蛋白KnobS。
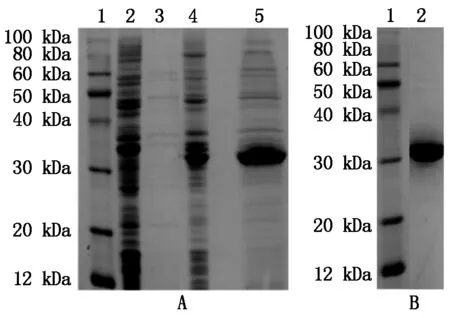
A:1.蛋白分子量标准;2~3.Δupp L. casei细胞及培养液上清;
3讨论
由于乳酸菌是人和动物肠道常在的益生菌[6],所以它的安全是毋庸置疑的,目前已经有些病原体抗原保护性抗原在乳酸菌中进行表达[10,12],通过免疫分析该表达系统不仅能够刺激机体产生细胞免疫还能刺激机体产生体液免疫[8,15],这对于抵抗病原微生物的感染是非常重要的[7]。但是上述表达形式均是以质粒形式进行的,虽然质粒的多拷贝性使得外源基因能够得到高效表达,并产生较强的免疫效果[13],但是,质粒的不稳定性会导致外源基因尤其是抗生素抗性基因的迁移[16],将外源基因构建于质粒载体而获得基因工程菌在疫苗领域中应用受到极大限制,因此,构建生态安全型的基因工程菌株就是将外源基因整合到受体菌基因组上且不带入外源抗性基因。为了构建一株无任何选择性标记的食品级疫苗候选株,笔者选择了温度敏感型载体,当温度升高到42 ℃以上时,该质粒不发生复制,同时还可以通过载体上设计的同源臂序列和宿主染色体DNA发生位点特异性重组,从而获得一株无任何选择性抗性的基因组整合重组菌株。
pORI系统利用了温度敏感型双质粒的复制互补功能,该系统由辅助质粒和主质粒组成,其中辅助质粒携带完整野生型pORI复制子,基因打靶的主质粒即双交换重组的转移载体,携带缺失repA基因的pORI温度敏感型穿梭型缺陷型复制子系统,主质粒只需要转化一次,通过2次同源重组后可获得无痕操作的突变体[13,16],筛选简易方便,不产生假阳性突变体。Douglas等[12]利用pORI系统将gusA3报告基因分别插入到嗜酸乳杆菌NCFM中3个高表达区域和一个低表达区域,每个位点的gusA3表达用ELISA方法测定gusA3的活性。Goh等[17]应用已经构建的pORI-based敲除系统,通过双重组将slpX基因的S层蛋白敲除。Kristich等[18]在粪肠球菌研究中利用5-FU作为阳性/阴性选择性标,构建了srtA突变体。在L.caseATCC 393中,upp基因也是非必需基因[19],如果将该基因缺失该菌株就能获得5-FU抗性,因此,可以将upp基因作为反选择标记基因[20]。
在本研究中,利用upp基因可缺失的特性构建了反选择标记替换系统[20],并构建KnobS表达盒代替upp基因。重组菌通过2次升温之后,涂含5-FU抗性的MRS抗性平板进行筛选。筛选出的单菌落用PCR的方法进行初步鉴定,用Western Blot的方法验证得到目的条带,可以断定其所构建的基因组整合菌株确实能够有效地表达外源蛋白,得到了安全无毒的重组产减蛋综合征病毒主要免疫保护性抗原纤维蛋白KnobS口服活菌疫苗,为减蛋综合征病毒免疫保护性抗原KnobS疫苗的研制奠定了基础。本研究也为构建携带其他病原体抗原的基因组整合重组干酪乳杆菌的研制提供了可靠的技术保障和理论基础。
参考文献:
[1]Fingerut E,Gutter B,GalliliG,et al.A subunit vaccine against the adenovirus egg-drop syndrome using part of its fiber protein[J].Vaccine,2003,21(21):2761-2766.
[2]Gutter B,Fingerut E,Gallili G,et al.Recombinant egg drop syndrome subunit vaccine offers an alternative to virus propagation in duck eggs[J].Avian Pathology,2008,37(1):33-37.
[3]Tomko R P,Johansson C B,Totrov M ,et al.Expression of the adenovirus receptor and its interaction with the fiber knob[J].Experimental Cell Research,2000,255(1):47-55.
[4]郭建军,范汉东,杨一兵.减蛋综合征病毒纤维蛋白主要抗原结构域原核表达及抗原性鉴定[J].畜牧与兽医,2012,44(2):22-25
[5]郑金,陈滔,陆吉虎,等.减蛋下降综合征病毒重组KnobS基因在杆状病毒系统中的表达及其免疫原性鉴定[J].江苏农业学报,2015,31(3):600-603.
[6]史达,宋岩,李一经.乳酸乳球菌作为黏膜免疫活载体疫苗传递抗原的研究进展[J].微生物学报,2006,46(4):680-683.
[7]李超,王春凤,杨桂连.乳酸菌胞外多糖肠道黏附及免疫调节作用研究进展[J].食品科学,2014,35(11):314-318.
[8]董懿樱,陈臣,任婧,等.乳酸菌对肠免疫调节功能研究进展[J].中国微生态学杂志,2014,26(2):221-224.
[9]Mohammed B E D,Gahan C G M,Griffin B T.Lactococcuslactisas a cell factory for delivery of therapeutic proteins.[J].Current Gene Therapy,2010,10(1):34-45.
[10]王相清.共表达猪细小病毒VP2与大肠杆菌不耐热肠毒素B亚单位重组乳酸杆菌构建及其免疫学初步评价[D].哈尔滨:东北农业大学,2009.
[11]Wells J M,Mercenier A.Mucosal delivery of therapeutic and prophylactic molecules using lactic acid bacteria [J].Nat Rev Microbiol,2008,6(5): 349-362.
[12]Douglas G L,Klaenhammer T R.Directed chromosomal integration and expression of the reporter genegusA3 inLactobacillusacidophilusNCFM[J].Appl Environ Microbiol,2011,77(20):7365-7371.
[13]郭建军,袁林,曾静,等.干酪乳杆菌Lactobacilluscasei393upp基因突变株的构建[J].江西科学,2015,33(03):308-311.
[14]郭建军,龚小华,袁林,等.干酪乳杆菌同源整合载体的构建与鉴定[J].江西科学,2015,33(04):491-494,518.
[15]García-Fruitós E.Lactic acid bacteria: a promising alternative for recombinant protein production[J].Microbial Cell Factories,2012,11(1):1-3.
[16]宋佰芬.产气荚膜梭菌α毒素基因在干酪乳杆菌基因组中的表达及免疫效果评价[D].哈尔滨:东北农业大学,2014
[17]Goh Y J,Azcarate-Peril M A,O'Flaherty S,et al.Development and application of a upp-based counterselective gene replacement system for the study of the S-layer protein SlpX ofLactobacillusacidophilusNCFM [J].Appl Environ Microbiol,2009,75(10): 3093-3105.
[18]Kristich C J,Manias DA,Durmy GM.Development of a method for markerless genetic exchange inEnterococcusfaecalisand its use in construction of a srtA mutant[J].Appl Environ Microbiol,2005,71(10):5837-5849.
[19]杨奇.大肠杆菌DH5αupp基因的敲除及其应用研究[D].南京:南京理工大学,2013.
[20]宋丽.乳酸乳球菌upp基因缺陷互补型质粒载体系统的构建及其缺失菌生物学特性研究[D].哈尔滨:东北农业大学,2015.
The Construct and Expression ofKnobSGene ofEggdropsyndromevirusinL.caseiGenome
GUO Jianjun,YUAN Lin,ZENG Jing,QIU Xiaozhong,FU Jinnan
(Institute of Microbiology,Jiangxi Academy of Sciences,Nanchang330096,China)
Abstract:To develop an EDSV(Egg drop syndrome virus) vaccine that live up to the standard of food safety,a temperature-sensitive suicide plasmid pORZP-UKD was constructed using L.casei as a transmitted vector.After transforming it into L.casei using electric shock,two temperature-elevating treatments and a 5-FU screening were performed to get positive clone.Upon the identification of putative clone by PCR and SDS-PAGE,we successfully obtained a recombinant strain,KnobSΔupp L.casei,which has no selective-marker but harbors a KnobS expression box.Any exogenous gene can be integrated into this recombinant strain and express its products as bacteria replicate itself,thus providing the experimental basis for the further development of protective Knobs antigen vaccine against Egg drop syndrome virus.
Key words:Lactobacillus casei;KnobS protein of Egg drop syndrome virus;Genome expression
doi:10.7668/hbnxb.2016.02.014
中图分类号:Q78;S432.4+1
文献标识码:A
文章编号:1000-7091(2016)02-0081-06
通讯作者:袁林(1980-),男,江西德安人,助理研究员,博士,主要从事基因工程与分子生物学研究。
作者简介:郭建军(1984-),男,江西崇仁人,助理研究员,硕士,主要从事有益微生物分子遗传及资源利用研究。
基金项目:江西省科技支撑计划项目(20142BBF60036);江西省自然(青年)科学基金项目(2013BAB214014)
收稿日期:2016-02-15
