肝豆状核变性患者灰质结构MRI形态学初步研究
2016-06-03张春芸王安琴武红利汤岚凤徐春生李传富
张春芸,王安琴,武红利,汤岚凤,徐春生,卢 琦,李传富
(1.安徽中医药大学研究生部,安徽合肥230038;2.安徽中医药大学第一附属医院影像中心,安徽合肥230031)
肝豆状核变性患者灰质结构MRI形态学初步研究
张春芸1,2,王安琴1,武红利1,汤岚凤1,徐春生2,卢琦2,李传富2
(1.安徽中医药大学研究生部,安徽合肥230038;2.安徽中医药大学第一附属医院影像中心,安徽合肥230031)
[摘要]目的:利用基于体素的形态测量学(voxel-based mor phometry,VBM)方法,探讨肝豆状核变性(Wilson’s disease,WD)患者全脑灰质结构变化特点。方法:采集30例WD患者(WD组)及30例健康志愿者(对照组)的大脑3.0 T MRI高分辨力T1WI图像,通过FSL-VBM软件进行数据预处理后,利用AFNI软件行双样本t检验,比较2组全脑灰质体积差异,运算结果经FDR校正(P=0.001,α<0.05)。结果:WD组与对照组比较,双侧的尾状核、苍白球、丘脑背内侧核、小脑半球、中央前后回、岛叶、额中回,脑桥基底部,左侧的后扣带回及丘脑枕灰质体积萎缩;双侧的岛叶及胼胝体,右侧的颞上回、额上回、红核,左侧的颞中回、额内侧回存在灰质体积增生。结论:WD患者灰质核团及大脑皮层存在广泛灰质体积萎缩,而部分皮层区域及少数灰质核团存在灰质体积增生;灰质异常脑区对解释其临床症状具有重要意义。
[关键词]肝豆状核变性;灰质;基于体素的形态测量学;磁共振成像
肝豆状核变性又称Wilson病(Wilson’s disease,WD),1912年由Wilson[1]首先完整报道和描述,是一种常染色体隐性遗传的铜代谢障碍性疾病。既往研究[2-6]显示,WD患者存在广泛的颅脑影像学异常,且可伴不同程度的脑萎缩改变,有些患者可仅表现为脑萎缩改变[3,5]。常规影像学检查对WD患者脑萎缩的变化特点难以进行客观、全面、定量的分析。基于体素的形态测量学(voxel-based morphometry,VBM)是脑形态学研究的一种技术手段[7-9],通过定量计算局部灰质体素的大小及信号强度,实现对全脑及脑结构细微变化的定量体积分析,发现隐匿性脑结构变化,广泛应用于研究脑结构的细微变化及其与疾病之间的相关性,并进行脑部疾病的临床诊断和疗效评估。因此,本研究拟用VBM方法,全面、定量地分析WD患者灰质结构变化的特点和规律。
1 资料与方法
1.1一般资料搜集安徽中医药大学第一附属医院2015年4—8月住院的脑型及肝脑混合型WD 30例(WD组),均符合WD诊断及分型标准[10]。其中男17例,女13例;平均(26.94±6.98)岁。病程10个月~20年,平均(7.8±5.0)年。同时选取30例健康志愿者作为对照组,其中男15例,女15例;平均(26.20±5.62)岁。所有受试者均为右利手,无其他神经系统疾病,无精神疾病史且近期未服用精神药物,无幽闭恐惧症及其他MRI检查禁忌证。详细告知患者实验目的、方法及可能存在的风险,并签署知情同意书。
1.2仪器与方法采用GE Discovery MR 750 3.0 T超导型扫描仪,头部8通道相控阵表面线圈,行脑部常规T2FLAIR及3D T1WI高分辨力结构相扫描。常规T2FLAIR序列用于排除受试者与研究无关的脑部其他基础病变。3D结构相采用3D T1序列行轴位连续166层扫描,范围覆盖全脑。扫描参数:TR/TE 8.2 s/3.2 s,翻转角12°,FOV 256mm×256mm,矩阵256×256,层厚1mm,无间隔。
1.3数据处理3D结构相数据使用FSL(http://fsl. fmrib.ox.ac.uk/fsl/fslwiki/版本:5.04)中基于体素的形态学分析工具包FSL-VBM完成预处理。处理步骤:①对数据进行脑组织提取,得到去除颅骨等非脑组织的影像数据。②将得到的脑组织图像分割成灰质、白质、脑脊液,将所有的灰质图像通过仿射变换和非线性转换后进行平均,在分辨率为2 mm×2 mm×2 mm的标准空间中创建对称的、本研究特定的自定义灰质模板。③将图像重新配准到该自定义灰质模板上;配准得到的图像再乘以变形场的Jacobian矩阵,校正配准过程中由局部缩放所产生的影响;用3 mm的高斯核对调节、转换后的图像进行平滑处理并运行一般线性模型分析(initial GLM analysis)。
1.4统计学分析将上述步骤处理得到的个体数据运用AFNI软件(http://afni.nimh.nih.gov/afni/版本:Linux xorg7 64bit)行双样本t检验,分析WD患者与对照组之间的全脑灰质体积差异。用多重对比校正(FDR校正,P=0.001,α<0.05),提取差异有统计学意义的脑区,每个脑区簇体积>99个体素;将差异有统计学意义的体素叠加于标准化后的3D T1WI生成为彩图,显示结果图像,记录激活区域、激活强度及MNI坐标,并确定灰质相对应的Brodmann分区。
2 结果
2组共发现21个簇存在灰质结构上的体素异常:WD组在双侧的尾状核、苍白球、丘脑背内侧核、小脑半球及脑桥基底部灰质体积明显低于对照组;双侧的中央前后回(BA3、4)、岛叶(BA13)、额中回(BA6),左侧的后扣带回(BA31)、丘脑枕亦发现WD组灰质体积的减少。在双侧的岛叶(BA13)、胼胝体,右侧的颞上回(BA22)、额上回(SMA)、红核,以及的左颞中回(BA21)、额内侧回(BA10)WD组较对照组灰质体积增多(具体激活部位、Brodmann分区及坐标等见表1及图1,2)。
3 讨论
3.1 WD脑萎缩区域本研究中,WD组在双侧的尾状核、苍白球、丘脑背内侧核、小脑半球及脑桥基底部较对照组均有灰质体积的明显减少,与文献[2-6]报道的WD经典的主要损害部位一致。另外,双侧的中央前/后回(BA3/4)、额中回(BA6)、岛叶(BA13),左侧的后扣带回及丘脑枕亦有灰质体积的减少。尽管WD患者随病情进展,异常信号可累及大脑皮层[11],但目前对WD患者大脑皮层结构改变的报道相对较少。因此,基于VBM方法可更好显示出WD患者大脑皮层结构的隐匿性损伤。
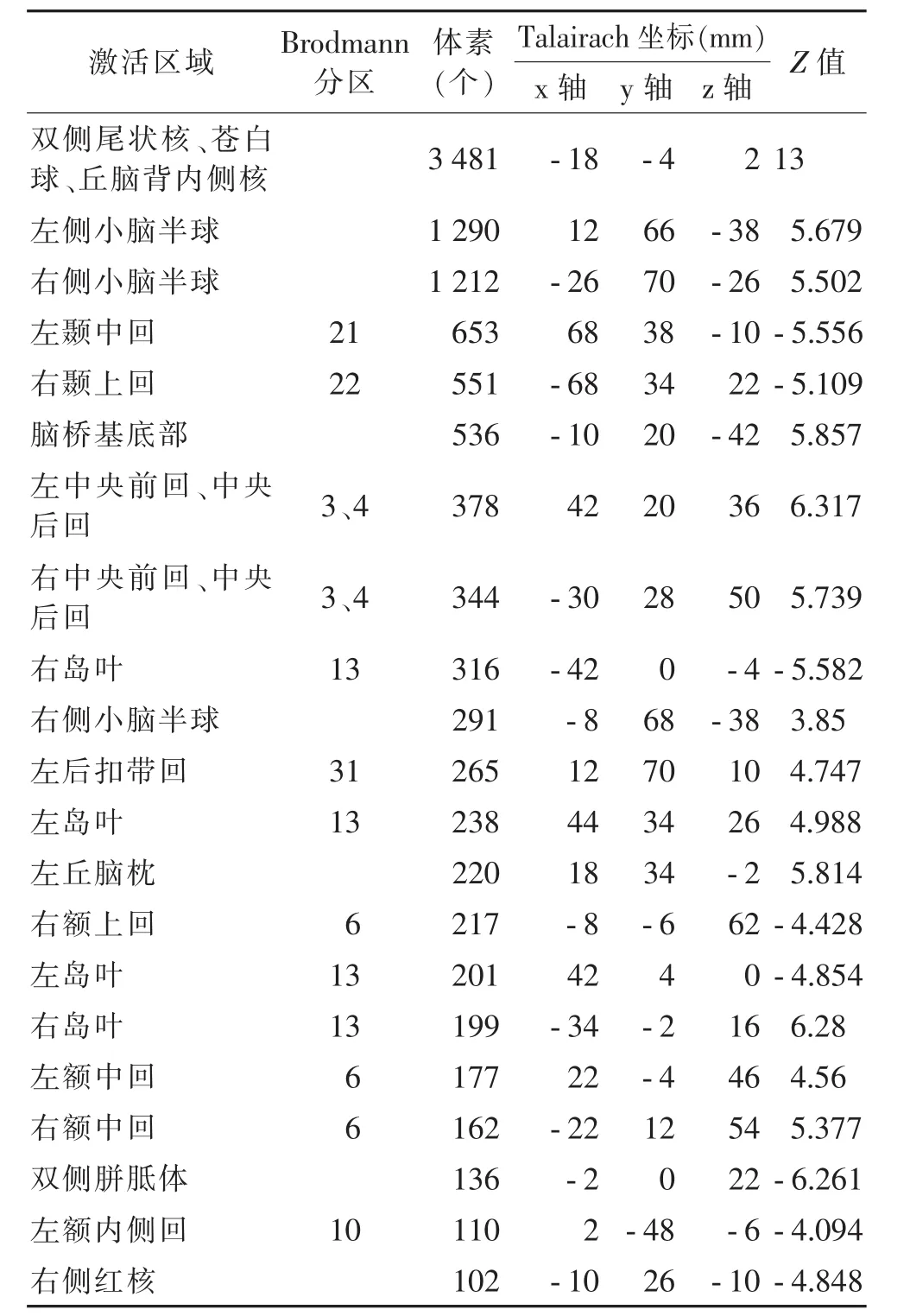
表1 2组VBM组间数据分析
已证实引起WD灰质信号改变的主要原因是由于铜异常沉积于脑血管周围,造成局部缺血性水肿、神经细胞变性、胶质增生及神经元囊性变[12];最终由于神经细胞坏死、神经元丢失引起WD脑形态学的改变。Strecker等[13]推测脑萎缩改变最有可能反映铜诱导的早期、不可逆的神经变性。
WD影像学改变与临床表现具有相关性,已得到广泛认可[2,14]。WD患者的神经症状以姿位性/意向性震颤、肌张力障碍、吞咽困难和构音障碍等最常见。尾状核、苍白球、丘脑背内侧核、小脑半球及脑桥基底部参与了广义锥体外系的组成,尤其尾状核及苍白球是纹状体的重要组成结构,主要参与随意运动的稳定、肌张力的维持,以及肢体姿势的调节活动。双侧中央前/后回(BA3/4)、额中回(BA6)均为与运动功能相关的脑区。中央前/后回(BA3/4)是初级感觉运动皮层,主要接受本体感觉冲动,以感受身体的位置、姿势和运动感觉,并发出纤维支配骨骼肌的随意运动。额中回(BA6)作为锥体外系皮质区,发出纤维至丘脑、基底神经节、红核、黑质,与联合运动和姿势动作协调有关。Sudmeyer等[15]通过分析WD患者MRI基底神经节的损伤与统一帕金森病评分量表(UPDRS)运动震颤评分,发现两者呈显著正相关,并首次证实WD患者震颤与苍白球、尾状核头及黑质的病变相关联。进一步研究[16-17]发现,WD患者的姿位性震颤与包括对侧初级感觉运动皮层(S1/M1)、高级皮质运动区(运动皮质前区PMA,辅助运动区SMA)、后顶叶皮层(PPC)、丘脑及同侧小脑在内的网络有显著一致性,因此推测WD姿位性震颤生成与小脑-丘脑-皮层的网络同步。本研究中小脑、丘脑、中央前后回及额中回的灰质萎缩与Sudmeyer等[15]研究一致,因此笔者推测WD患者锥体外系症状与小脑-丘脑-皮层回路参与的运动功能改变有关。值得一提的是,本研究中纹状体、丘脑同时发现了灰质萎缩,纹状体-丘脑-皮层运动回路是否参与WD患者运动功能改变有待进一步研究证实。
近年来,WD的精神症状及认知损害症状受到广泛关注。扣带回属于边缘系统,与内脏活动及情绪行为的调节紧密相联。有学者[18]提出WD精神障碍的发病机制是额叶-边缘系统环路受损所致。丘脑枕核被证实参与多条加工情绪信息的神经通路,因而在情绪信息加工中具有重要作用[19]。因此,笔者推测扣带回及丘脑枕体积萎缩可能与WD精神症状的产生有一定的相关性。
3.2 WD脑增生区域除萎缩区域外,本研究另外发现了部分灰质增生的区域,主要包括右侧的额上回(SMA)、颞上回(BA22)、红核,左侧的颞中回(BA21)、额内侧回(BA10),以及双侧的岛叶(BA13)、胼胝体。目前尚无有关WD患者灰质增生的相关文献报道。
额上回(SMA)即辅助运动区,位于大脑半球内侧面旁中央小叶前方,为背外侧面运动前区在大脑半球内侧面的延伸,该区有躯体运动和内脏运动功能,发出纤维加入锥体束。在正常情况下,该区域不发挥或仅发挥很少的作用[20]。红核与纹状体、丘脑、小脑核团、大脑皮质等存在广泛的纤维联系,主要通过皮质红核束及小脑红核脊髓束等辅助随意运动[21]。颞上回、颞中回及额内侧回参与感觉及运动功能的整合处理。由于WD患者参与锥体外系组成的脑区存在广泛的灰质萎缩且其相关运动功能受损,笔者推测上述灰质增生脑区可能由于皮层功能重组引起,参与了WD患者运动功能代偿,属于中枢神经系统的一种代偿性调节机制。
岛叶(BA13)在本研究中同时出现了萎缩与增生的结构改变。岛叶现已证实参与厌恶情绪及成瘾的形成、痛觉的调控、抑郁情绪的产生及语言的计划等[22]。岛叶形态学的双向改变是否参与WD精神症状的产生有待进一步研究证实。
3.3影响VBM准确性因素及本研究临床价值VBM方法自2000年由Ashbuner等[23]正式提出后,广泛应用于脑结构研究、精神疾病研究及脑退行性疾病研究等领域。尽管VBM技术不断发展,但其本身存在一定的局限性,数据预处理过程中个体间变异可降低组间差异的灵敏性,数据平滑过程中平滑核不恰当的选择也会增加假阳性率等。笔者认为提高原始图像的分辨力及信号均匀度,图像配准方法的改进,以及更多统计学方法的应用,可有效提高VBM结果的准确性。
本研究通过VBM方法,从体素层面显示WD患者脑灰质结构的变化特点,发现WD患者在常规影像学表现异常的脑区存在显著的灰质萎缩,部分皮层等区域存在常规影像学不易观察到的隐匿性灰质结构损伤;部分皮层区域及少数灰质核团存在灰质增生改变。上述灰质结构改变为临床疗效观察及病情监测提供了另一客观指标。更重要的是,这些灰质结构异常的脑区为解释WD患者临床症状提供了客观依据,为WD神经精神症状的中枢神经机制研究提供了神经解剖基础及新的契机。
本研究存在一定局限性,未将相关临床症状指标与实验结果做相关性分析,导致实验结果与临床症状之间的关系仅处于推测阶段;另外,患者病程持续时间与本实验结果的相关性亦不显著;在以后的研究中,将完善患者相关临床信息采集,并加强随访力度、进行长期纵向比较研究,使研究更加深入、准确。
[参考文献]
[1]Wilson SAK. Progressive lenticular degeneration:a familial nervous disease associated with cirrhosis of the liver[J]. Brain,1912,34:295.
[2]喻绪恩,杨任民.肝豆状核变性132例颅脑MRI扫描分析[J].中风与神经疾病杂志,2007,24(2):30-34.
[3]唐业斌,赵科伕,卢琦.肝豆状核变性的临床特征与颅脑MRI表现的相关性分析[J].临床放射学杂志,2009,28(9):1220-1223.
[4]黎规典,徐萍,周香雪,等.肝豆状核变性头部MRI表现及其与临床症状相关性分析[J].中风与神经疾病杂志,2013,30(8):731-733.
[5]Prashanth LK,Sinha S,Taly AB,et al. Do MRI features distinguish Wilson's disease from other early onset extrapyramidal disorders?An analysis of 100 cases[J]. Mov Disord,2010,25:672-678.
[6]Andersen K,Südmeyer M,Saleh A. Cerebral imaging for Wilson Disease[J]. Rofo,2007,179:225-233.
[7]Wright IC,Mc Guire PK,Poline JB,et al. A Voxel-based method for the statistical analysis of gray and white matter density applied to schizophrenia[J]. Neuroimage,1995,2:244-252.
[8]Ashburner J,Friston KJ. Voxel-based morphometry--the methods[J]. NeuroImage,2000,11:805-821.
[9]陈志晔.基于体素的形态测量学技术及研究进展[J/CD].功能与分子医学影像学(电子版),2012,1(2):62-64.
[10]中华医学会神经病学分会帕金森病及运动障碍学组,中华医学会神经病学分会神经遗传病学组.肝豆状核变性的诊断与治疗指南[J].中华神经科杂志,2008,41(8):566-569.
[11]Algin O,Taskapilioglu O,Hakyemez B,et al. Structural and neurochemical evaluation of the brain and pons in patients with Wilson's disease[J]. Jpn J Radiol,2010,28:663.
[12]Meenakshi-Sundaram S,Mahadevan A,Taly AB,et al. Wilson's disease:a clinico-neuropathological autopsy study[J]. Clin Neurosci,2008,15:409-417.
[13]Strecker K,Schneider JP,Barthel H,et al. Profound midbrain atrophy in patients with Wilson’s disease and neurological symptoms[J]. J Neurol,2006,253:1024-1029.
[14]Wassenaaer-van Hall HN,Heuvel AG,Algra A,et al. Wilson disease:findings at MR imaging and CT of the brain with clinical correlation[J]. Radiology,1996,198:531-536.
[15]Sudmeyer M,Saleh A,Wojtecki L,et al. Wilson’s disease tremor is associated with magnetic resonance imaging lesions in basal ganglia structures[J]. Mov Disord,2006,21:2134-2139.
[16]Sudmeyer M,Pollok B,Hefter H,et al. Postural tremor in Wilson's disease:a magnetoencephalographic study[J]. Mov Disord,2004,19:1476-1482.
[17]Sudmeyer,Pollok,Hefter,et al. Synchronized brain network underlying postural tremor in Wilson’s disease[J]. Movement Disorders,2006,21:1935-1940.
[18]Kaladjian A,Mazzola-Pomietto P,Jeanningros R,et al. Brain structural abnormalities of bipolar disorder[J]. Encephale,2006,32:421-436.
[19]陈珊珊,蔡厚德.丘脑枕核参与情绪信息加工的多条通路[J].心理科学进展,2015,32(2):234-240.
[20]Grefkes C,Nowak DA,Wang LE,et al. Modulating cortical connectivity in stroke patients by rTMS assessed with fMRI and dynamic causal modeling[J]. Neuroimage,2010,50:233-242.
[21]Nioche C,Cabanis EA,Habas C. Functional connectivity of the human red nucleus in the brain resting state at 3T[J]. AJNR Am J Neuroradiol,2009,30:396-403.
[22]沈笠雪,王磊.岛叶的结构与功能[J].国际神经病学神经外科学杂志,2012,39(4):393-395.
[23]Ashburner J,Friston KJ. Voxel-based morphometry:the methods[J]. Neuro Image,2000,11:805-821.
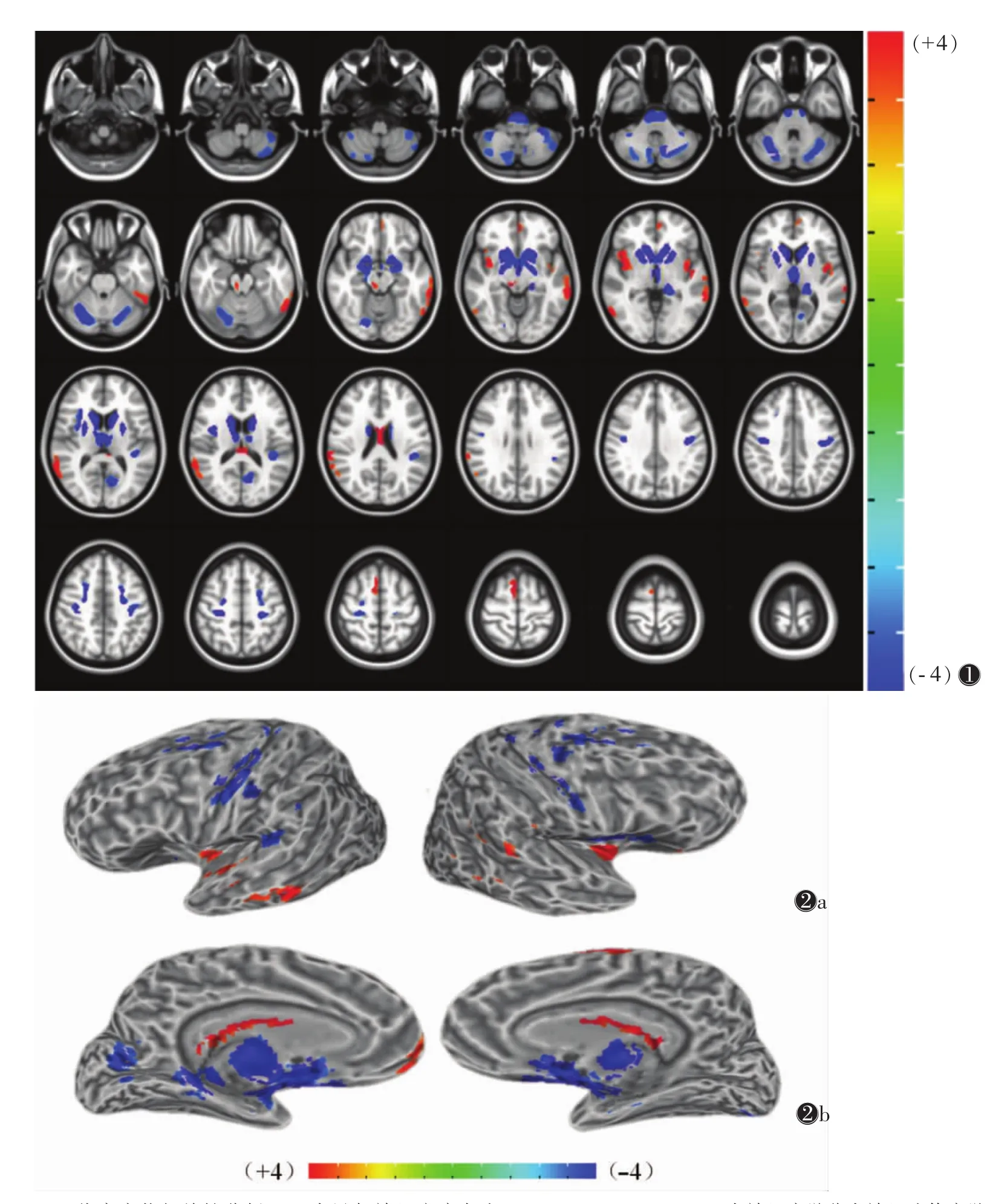
图1 肝豆状核性变(WD)患者基于体素的形态测量学(VBM)脑功能激活区(n=30,P=0.001,α<0.05,cl=99)。蓝色代表萎缩,红色代表增生。双侧的尾状核、苍白球、丘脑背内侧核、小脑半球及脑桥基底部灰质体积明显低于对照组,双侧的中央前后回、岛叶、额中回,左侧的后扣带回及丘脑枕WD组灰质体积减少;在双侧的岛叶、胼胝体,右侧的颞上回、额上回、红核及左侧的颞中回、额内侧回WD组较对照组灰质体积增多图2 WD患者VBM分析结果的3D图方位标记(P=0.001,α<0.05,cl=99) 图2a,2b 分别为表面观和内侧面观。蓝色代表萎缩,红色代表增生。双侧的尾状核、苍白球、丘脑背内侧核、小脑半球及脑桥基底部灰质体积明显低于对照组,双侧的中央前后回、岛叶、额中回,左侧的后扣带回及丘脑枕WD组灰质体积减少;在双侧的岛叶、胼胝体,右侧的颞上回、额上回、红核及左侧的颞中回、额内侧回WD组较对照组灰质体积增多
Preliminary MRI morphology study on cerebral gray matter in Wilson’s disease
ZHANG Chunyun,WANG Anqin,WU Hongli,TANG Lanfeng,XU Chunsheng,LU Qi,LI Chuanfu.
Anhui University of Chinese Medicine,Anhui,230038,China.
[Abstract]Objective:To investigate the cerebral gray matter volume in Wilson’s disease(WD)with voxel-based morphometry (VBM). Methods:30 cases of WD patients and 30 cases of healthy volunteers were recruited to get three-dimensional(3D)brain structures image with GE 3.0 T MRI scanner. The data preprocessing was performed with VBM,and then the differences in volume between two groups were demonstrated by statistical analysis with the program of AFNI,corrected using false discovery rate(FDR)simulations with P=0.001,α<0.05. Results:Compared to controls,WD patients showed decreasing gray matter volume in bilateral caudate nucleus,globus pallidus,thalamus,cerebellum,pons,precentral gyrus,postcentral gyrus,insular lobe,middle frontal gyrus and left posterior cingulated,pulvinar. Besides,increasing gray matter volume were also observed in bilateral insular lobe and corpus callosum,right superior temporal gyrus,superior frontal gyrus,red nucleus and left of middle temporal gyrus,medial frontal gyrus. Conclusion:Decreasing gray matter volume is widespread in brain of WD patients,and increasing gray matter volume in several cerebral regions,which might significantly correlated with the clinical symptoms.
[Key words]Hepatolenticular degeneration;Gray matter;Voxel-based morphometry;Magnetic resonance imaging
收稿日期(2015-12-07)
[通信作者]李传富,E-mail:13956078816@126.com。
[基金项目]国家973计划项目(2010CB530505);安徽中医药大学青年科学研究基金(2015qn016)。
DOI:10.3969/j.issn.1672-0512.2016.03.002
