用电子定域函数研究主族原子的壳层结构
2016-06-02李晓艳曾艳丽孟令鹏郑世钧河北师范大学化学与材料科学学院石家庄050024
李晓艳 曾艳丽 孙 政 孟令鹏 郑世钧(河北师范大学化学与材料科学学院,石家庄 050024)
用电子定域函数研究主族原子的壳层结构
李晓艳 曾艳丽 孙 政 孟令鹏 郑世钧*
(河北师范大学化学与材料科学学院,石家庄 050024)
摘要:采用电子定域函数(ELF)方法对第一到第四周期主族元素的壳层结构进行了研究。计算得到了各壳层半径及壳层内的电荷数,探讨了原子序数与壳层半径间的关系。结果有助于学生更好地理解原子的壳层结构。
关键词:电子密度拓扑分析;电子定域函数;原子壳层
在大学化学教学中,原子壳层是一个很重要的概念[1–4]。原子壳层结构是关于原子内电子排布的一种简化模型。原子内带正电的部分集中于原子核,带负电的电子分布于核外,中性原子的核外电子数等于原子序数Z。Z个电子在核外如何分布是物理学和化学感兴趣的问题。按照量子力学,原子内的电子可处于各种可能的定态,电子的运动状态由n、l、m、ms四个量子数描述。具有相同主量子数n的电子构成一个壳层,对应于n = 0、1、2、…的壳层分别用K、L、M、…表示;每个壳层内可容纳2n2个电子。相同n按不同l又分为若干个支壳层,对应于l = 0、1、2、…的支壳层分别用s、p、d、…表示[1–4]。虽然用这些量子数可以定义原子的壳层结构,原子壳层的概念确实也可以解释原子的一些性质,但这种原子壳层结构(按占据轨道的正则量子数划分的)并不很清晰。
电子定域函数(ELF)是Becke和Edgecombe[5]提出的用于讨论分子和原子中电子定域程度的物理量。ELF定义为,其中。为一个σ电子出现在r时,以其为中心的半径为的球壳上另一个σ电子出现的概率密度,是与当前位置具有相同密度的非相互作用均匀电子气模型下的。按以上定义,ELF值在0–1之间,与电子定域直接相关。当ELF = 1时,电子完全定域;当ELF = 1/2时,电子处于完全离域状态。
电子定域函数的引入可以帮助我们理解从实验总结的电子定域的概念。Kohout和Savin[6]提出,ELF函数不仅能描述原子的壳层结构,而且能给出各壳层半径rs和壳层电荷数qs。其中ELF函数的最大值对应原子的壳层,各个壳层之间由ELF的极小值分开,ELF极小值所对应的r值即为该壳层的半径。对该壳层范围内的电荷密度进行积分,即可得到此壳层内的电荷数。
因ELF函数主要决定于占据轨道的节点性质[7],而计算方法和基组大小对其影响很小,我们采用Gaussian 03[8]程序中的密度泛函方法(B3LYP)[9,10]及6-31G基组对第一周期到第四周期的主族元素进行了计算。在此基础上,采用TOPMOD程序对各原子进行电子密度拓扑分析,得到了各个原子在空间各点的ELF值,各个原子的ELF值与距核距离的关系见图1。对各壳层范围内的电荷密度进行了积分,各原子壳层半径及壳层内的电荷数见表1。
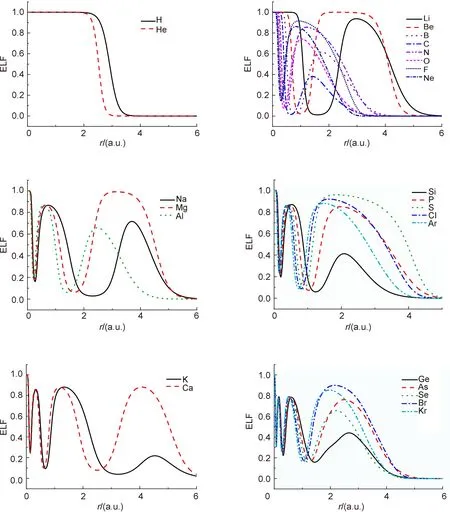
图1 ELF确定的各原子壳层
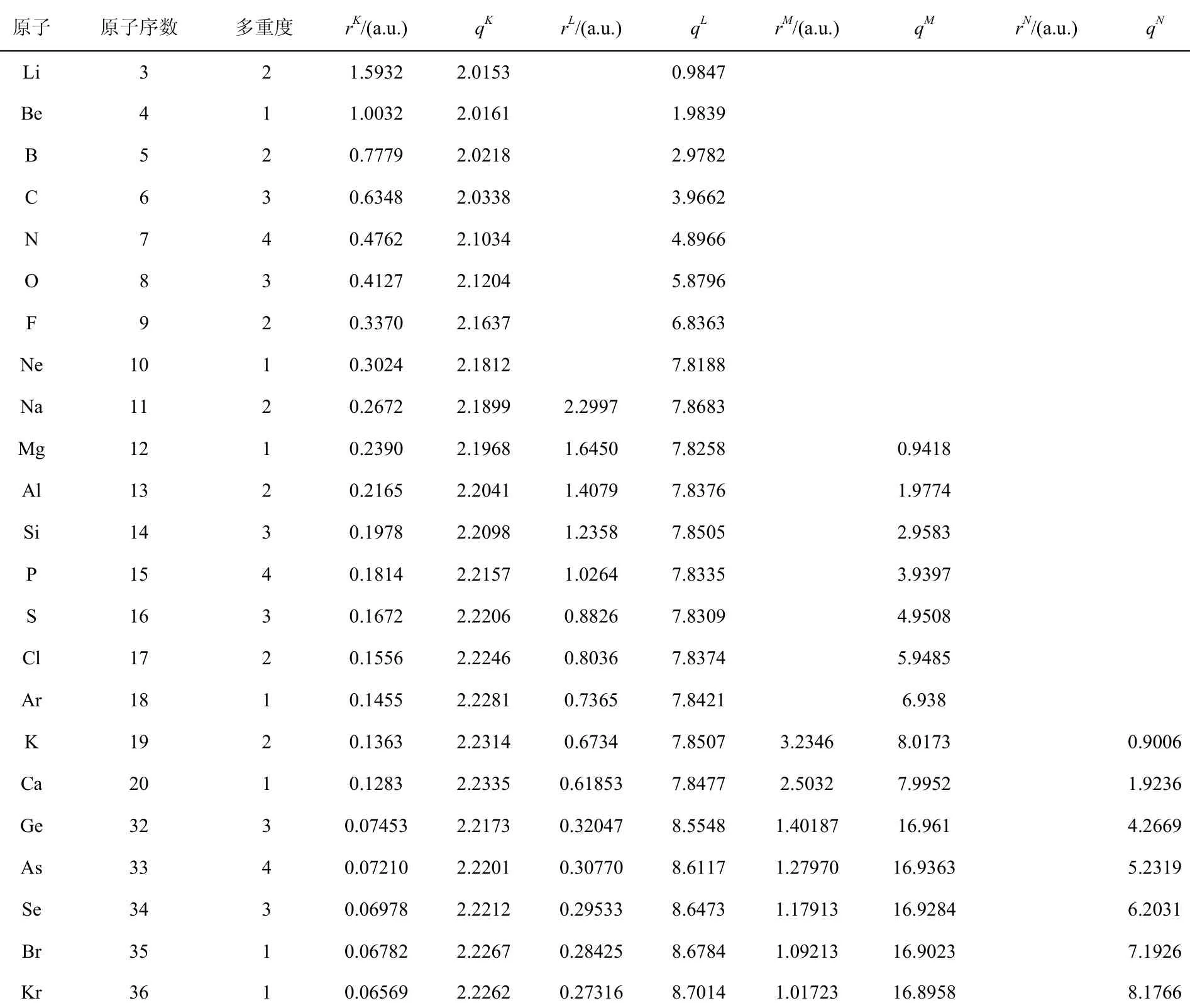
表1 ELF确定的原子壳层半径及电荷数
如图1所示,对于第一周期元素(氢和氦),ELF只有一个极大值,即只有一个原子壳层(K层);且由图1可以看出,H原子的ELF值在r = 3.14 a.u.处接近于0,He原子的ELF值在r = 3.86 a.u.处接近于0,说明He原子的K层半径小于H原子的K层半径。
对第二周期元素,从Li原子到Ne原子,它们的ELF值都有两个极大值,说明第二周期的原子有两个原子壳层。从图1还可以看出,第二周期的ELF都有一个极小值,从Li到Ne,第一个极小值出现的位置离核的距离分别为1.5932、1.0032、0.7779、0.6348、0.4762、0.4127、0.3370和0.3024 a.u.,数值越来越小,说明随原子序数增加,其K壳层的半径逐渐减小。表1列出了各壳层的半径及该壳层内的电荷数。由表1可以看出,对第二周期元素,K壳层内基本上有两个电子,L层的电荷数从Li到Ne分别为1–8。
第三周期和第四周期元素的ELF规律与第二周期元素的函数规律相同: 第三周期的原子有3个壳层,各层(K、L、M层)容纳的电荷数分别为2、8、1–8;且随着原子序数增加,各壳层的半径逐渐减小。第四周期的元素有4个壳层,K、Ca原子的各层电荷数为2、8、8、1–2;Ge到Kr原子的各层电荷数基本为2、8、18、1–8,并且对于从Ge到Kr这几个有d电子的原子来说,M层的电荷数少于标准的18电子,这是由核-壳电子分离,使得M层的电子在K层和L层重新分配造成的。
图2为各壳层半径与原子序数间的关系图。由图2可以看出,原子的外壳层半径大于内壳层半径,即rM> rL> rK;对同一壳层,随着原子序数增加,各壳层半径依次减小。
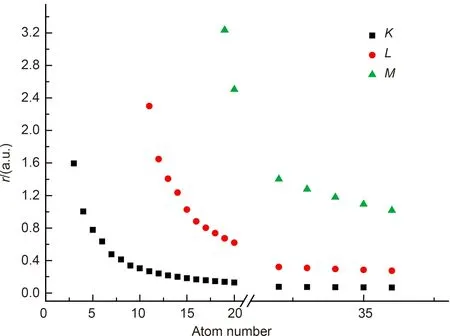
图2 各壳层半径与原子序数间的关系图
参 考 文 献
[1]周公度, 段连运. 结构化学基础. 第3版. 北京: 北京大学出版社, 2002.
[2]徐光宪, 王祥云. 物质结构. 第2版. 北京: 高等教育出版社, 1987.
[3]潘道皑, 赵成大, 郑载兴. 物质结构. 北京: 高等教育出版社, 1995.
[4]李 奇, 黄元河, 陈光巨. 结构化学. 北京: 北京师范大学出版社, 2008.
[5]Becke, A. D.; Edgecombe, K. E. J. Chem. Phys. 1990, 92, 5397.
[6]Kohout, M.; Savin, A. Int. J. Quant. Chem. 1996, 60, 875.
[7]Burdett, J. K.; McCornick, T. A. J. Phys. Chem. A 1998, 102, 6366.
[8]Frisch, M. J.; Trucks, G. W.; Schlegel, H. B.; et al. Gaussion 03, Revision D. 01; Gaussion Inc.: Wallingford CT, 200
[9]Becke, A. D. J. Chem. Phys. 1993, 98, 5648.
[10]Lee, C.; Yang, W.; Parr, R. G. Phvs. Rev. B 1988, 37, 785. 4.
Study of the Atomic Shell Structures of Main Group Atoms by the Electron Location Function
LI Xiao-Yan ZENG Yan-Li SUN Zheng MENG Ling-Peng ZHENG Shi-Jun*
(College of Chemistry and Material Science, Hebei Normal University, Shijiazhuang 050024, P. R. China)
Abstract:The atomic shell structure of the first to the fourth row elements were studied by the electron location function (ELF). The shell radii and population in individual shells were calculated and the relationship between the atom numbers and the atomic radii was discussed. The results could help to understand the atomic shell structure.
Key Words:Topological analysis of electron density; Electron location function; Atomic shell
基金资助:国家自然科学基金(21372062,21371045,21373075);河北省自然科学基金(B2016205042,B2015205210);河北省教育厅重点课题(ZD20131053)
*通讯作者,Email: sjzheng@mail.hebtu.edu.cn
doi:10.3866/pku.DXHX20160179www.dxhx.pku.edu.cn
中图分类号:O641;G64
