从轨道对称守恒原理看Diels-Alder反应区域选择性
2016-06-02袁耀锋王文峰福州大学化学学院福州350108
袁耀锋 王文峰*(福州大学化学学院,福州 350108)
从轨道对称守恒原理看Diels-Alder反应区域选择性
袁耀锋王文峰*
(福州大学化学学院,福州 350108)
摘要:根据轨道对称守恒原理(PCOS),推断出决定Diels-Alder反应的区域选择性的轨道相互作用是双烯体与亲双烯体各自最稳定的价轨道之间的相互作用,这种相互作用形成的是反应产物的两根新σ键中能量更低的σ键,即σ1键。在过渡态中具有更稳定的σ1键的那个区域异构体将是反应的优势产物,本文将这个规则称为σ1规则。本文的量子化学计算结果既证实了σ1规则预测Diels-Alder反应区域选择性主产物的正确性,也证实了σ1键的确来自于双烯体与亲双烯体各自最稳定的价轨道之间的相互作用。
关键词:Diels-Alder反应;轨道对称守恒原理;区域选择性;轨道相互作用
1 介 绍
自从Diels-Alder反应(DA反应)于1928年被发现以来[1],对于该反应的区域选择性的探讨始终是化学家的重要兴趣之一。早期化学家主要采用系数规则进行解释[2–5],认为在正常电子要求下,双烯体提供HOMO,亲双烯体提供LUMO,这两个分子轨道中系数大的两个原子轨道在反应中优先成键。如图1中C4和C6应优先成键,故得到邻位加成产物。系数规则的基础是前线轨道理论,认为DA反应
由两个组分的HOMO与LUMO之间的轨道作用控制。
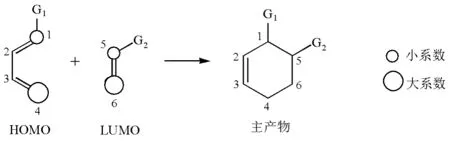
图1 系数规则对DA反应区域选择性问题的解释
1986年,Dewar[6]对如图2所示的Diels-Alder反应既进行了理论计算,也进行了实验合成[7]。理论计算显示C1的系数大于C4,按照系数规则,C1应当优先与C5成键,得到的间位加成物是主产物;但实际的实验结果表明邻位加成产物才是反应的主产物。在总结了许多实验事实后,Dewar认为前线轨道理论过分粗糙,在解释DA反应的区域选择性等方面常常出错,建议用双自由基规则预测和解释DA反应的区域选择性[6]:邻位加成物中间体的两个自由基都可以被羧基或酯基通过共轭效应稳定,而间位加成产物中间体右边的自由基不能被羧基共轭稳定,所以邻位加成是主要产物。

图2 双自由基规则对DA反应区域选择性问题的解释
大量的实验证明,双自由基规则总是能正确地预测DA反应的区域选择性产物,美国的高等有机教科书建议用这种方法来预测DA反应的区域选择性[8]。但由于绝大多数的DA反应不经历双自由基中间体,所以化学家并不认为双自由基规则是对DA反应区域选择性问题的正确解释。在Dewar之后所有的化学家依然采用前线轨道理论来解释DA反应的区域选择性[9–15]。
Domingo[9]于2002年采用福井函数规则解释DA反应的区域选择性问题。其中的福井函数分为亲核福井函数f–和亲电福井函数f+,分别来源于亲核试剂的HOMO和亲电试剂的LUMO。如图3所示,在方程(1)中,戊二烯是亲核试剂,其亲核福井函数f–中C4(0.309)大于C1(0.296);丙烯醛是亲电试剂,其亲电福井函数f+中C5(0.372)大于C6(0.137),所以C4应和C5优先结合,得到邻位加成产物。方程(2)的解释与此类似,只是亲核和亲电的角色互换。
福井函数规则首先遇到的问题是:并不是所有的DA反应都能把双烯体和亲双烯体明确地分为亲核试剂和亲电试剂。例如图2所示的反应中,酯基和羧基都是吸电子基,吸电子能力也相当,这种情况下无法确定丙烯酸是亲电试剂还是亲核试剂。其次,福井函数规则的基础仍然是前线轨道理论,认为DA反应由一个组分的HOMO(f–)与另一个组分的LUMO(f+)之间的相互作用来控制。尽管福井函数规则在解释许多极性的DA反应(在这些反应中,双烯体和亲双烯体容易被清楚地划分为亲电试剂和亲核试剂)的区域选择性方面取得优异结果,但这个理论在本质上与系数规则没有区别,都认为DA反应的区域选择性由HOMO-LUMO相互作用决定。这两个规则无法回应Dewar对前线轨道理论的批评,也无法解释Dewar在图2中所显示的实验结果。本课题组早期已经证明,轨道对称守恒原理在描述DA反应的轨道相互作用方面是比前线轨道理论更精确的理论[16]。本文依据轨道对称守恒原理认为DA反应的区域选择性由两个组分的最稳定的价轨道之间的相互作用决定,这种最稳定的价轨道之间的相互作用形成了产物的σ1轨道,通过比较各区域异构体在过渡态中σ1轨道的稳定性可以判断优势区域异构体。本文将这种依据σ1稳定性来判断DA反应区域选择性的规则称为σ1规则。
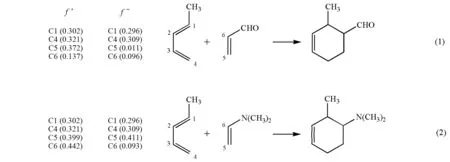
图3 福井函数规则对DA反应区域选择性问题的解释
2 计算方法
采用B3LYP方法,对所有原子采用6-311+G**基组,反应物和产物结构采用全优化计算得到,过渡态结构用QST3方法计算得到,并用频率计算验证,有且仅有一个虚频。
3 结果与讨论
3.1DA反应轨道作用分析
DA反应的区域选择性问题是动力学问题,所以区域选择性问题实际上就是区域异构体的过渡态稳定性问题。在图4中,亲双烯体为了在过渡态中保持尽可能大的共轭效应,总是倾向于用它的C5原子先与双烯体成键。当C5原子优先与双烯体的C4原子成键时,则经历A过渡态并得到邻位加成产物;反之,当C5原子优先与双烯体的C1原子成键时,则经历B过渡态并得到间位加成产物。
A和B这两个过渡态中所有的化学键几乎都相等,只有两个半形成的σ键(即σ1和σ2)有较大差别。我们将过渡态中优先形成的σ键定义为σ1,后形成的σ键定义为σ2。显然,σ1对过渡态稳定性的贡献比σ2大得多,所以A和B的稳定性问题可以转化为哪一个σ1更稳定的问题。要了解哪一个σ1更稳定,首先得分析σ1来自于哪两个轨道之间的相互作用。
图5是依据轨道对称守恒原理制作的丁二烯与乙烯发生DA反应的分子轨道相关图[17]。由图5可见,能量更低的σ键(即σ1)来自于丁二烯的最稳定价轨道(HOMO-1)与乙烯的最稳定价轨道(HOMO)之间的相互作用;而丁二烯的HOMO与乙烯的LUMO相互作用后形成的是σ2。无论丁二烯和乙烯带上什么取代基,由于σ1是产物中最稳定的价轨道,按照轨道对称守恒原理,它必然来自于双烯体和亲双烯体各自最稳定的价轨道的相互作用。

图4 区域异构体的不同成键次序

图5 丁二烯和乙烯在DA反应中的分子轨道相关图
至此,本文的观点已经明确:σ1的稳定性决定了DA反应的区域选择性,而σ1又来自于双烯体和亲双烯体各自最稳定的轨道之间的相互作用。本文称此观点为σ1规则。系数规则和福井函数规则都认为是能量高的σ2键决定了DA反应的区域选择性,而本文的σ1规则认为是能量低的σ1键决定了DA反应的区域选择性,这是本文观点与传统观点的最大区别。下面将进行σ1规则合理性的证实工作。
3.2σ1规则对DA反应区域选择性的预测
1-取代的丁二烯与取代乙烯发生DA反应时,有邻位加成物和间位加成物两种产物。根据σ1规则,如图6所示,邻位加成产物的过渡态将更为稳定,因为C5与C4成键并不会破坏丁二烯上的取代基S与丁二烯之间的共轭效应;相反,间位加成物的过渡态中,丁二烯的取代基S与丁二烯之间的共轭效应被明显破坏。所以可以预测邻位加成产物将是主产物。
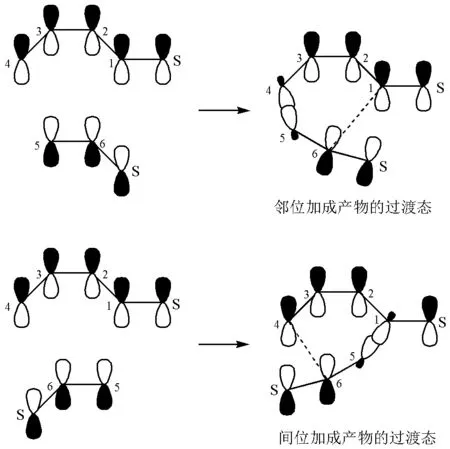
图6 邻位和间位加成物的过渡态中σ1的轨道图
上述预测并没有考虑取代基S是吸电子基还是给电子基,所以根据σ1规则,无论丁二烯在1位上连的是吸电子基还是给电子基,在与取代乙烯发生环加成时,邻位加成产物都是主产物。这个结论与实验上观察到的现象一致,与Dewar的双自由基规则对DA反应的预测也一致,但本文的σ1规则并不需要建议一个不被化学家承认的双自由基中间体。
3.3σ1规则的验证
为了验证σ1规则及其对DA反应的预测是否合理,本文采用量子化学方法计算了如下一些DA反应,如化学反应式(3)所示,括号中的值是各产物的过渡态能量值。其中产物1和9的过渡态结构如图7所示。
反应式(3)显示,无论R1或者R2是吸电子基还是给电子基,邻位加成产物(1,3,5,7,9)都是反应的主产物,表明σ1规则对DA反应区域选择性的预测是正确的。另外,图7则表明亲双烯体在过渡态中的确总是倾向于用C5原子优先与双烯体成键,表明本文前面的假设是正确的,也说明用共轭效应来考虑DA反应的区域选择性问题是合理的。
为了进一步证实σ1的确来自于双烯体和亲双烯体最稳定的价轨道之间的相互作用,本文计算了产物1和2的过渡态(TS1和TS2)的σ1轨道图,如图8所示。
图8显示σ1的确来自于双烯体和亲双烯体各自最稳定的价轨道的相互作用。在TS1中,C5和C4能够顺利成键,因为这种成键不会破坏取代基(氰基)与丁二烯之间的共轭作用;但在TS2中, C5和C1则几乎无法成键,因为C1与C5成键后将破坏丁二烯与氰基之间的共轭效应,所以最终导致TS1比TS2稳定,即邻位加成是反应的主产物。
4 结 论
DA反应的区域选择性由反应中新形成的两个σ键中能量更低的那个σ键(即σ1)决定,因为此键在过渡态中的稳定性是决定区域异构体过渡态稳定性的关键。根据轨道对称守恒原理,此σ键来自于双烯体和亲双烯体各自最稳定的价轨道之间的相互作用。哪一个区域异构体的过渡态中的σ1能保持更多的共轭效应,哪一个区域异构体将是反应主产物,本文称这个规则为σ1规则。根据这个规则,1-取代丁二烯与取代乙烯发生DA反应时总是优先生成邻位加成产物,这与实验上观察到的结果一致。由于σ1规则和Dewar的双自由基规则都采用共轭效应来预测DA反应的区域选择性,所以这两个规则在预测产物方面是一致的,但是σ1规则不需要建议一个不被化学家接受的双自由基中间体。本文的量子化学计算证实了σ1规则的合理性。

图7 化合物1和9的过渡态的结构图
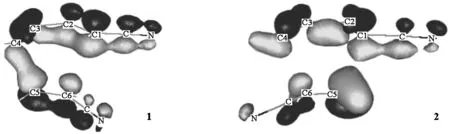
图8 化合物1和2的过渡态中σ1的分子轨道图
参 考 文 献
[1]Diels, O.; Alder, K. Justus Liebigs Ann. Chem. 1928, 460, 98.
[2]Kahn, S. D.; Pau, C. F.; Overman, L. E.; Hehre, W. J. J. Am. Chem. Soc. 1986, 108, 7381.
[3]Houk, K. N. J. Am. Chem. Soc. 1973, 95, 4092.
[4]Sauer, J.; Sustmann, R. Angew. Chem. Int. Edit. Engl. 1980, 19, 779.
[5]Ginsburg, D. Tetrahedron 1983, 39, 2095.
[6]Dewar, M. J. S. J. Mol. Struct. (Theochem.)1989, 200, 301.
[7]Dewar, M. J. S.; Olivella, S.; Stewart, J. J. P. J. Am. Chem. Soc. 1986, 108, 5771.
[8]Bernard, M. 高等有机化学——反应和机理. 第2版. 吴范宏, 荣国斌,译. 培生教育出版集团, 2005: 69.
[9]Domingo, L. R.; Aurell, M. J.; Perez, P.; Contreras, R. J. Phys. Chem. A 2002, 106, 6871.
[10]Mohajeri, A.; Shahamirian, M. J. Iran. Chem. Soc. 2010, 7, 554.
[11]Bansal, R. K.; Gupta, N.; Kumawat, S. K. Tetrahedron 2006, 62, 1548.
[12]Domingo, L. R.; Picher, M. T.; Aaez, Z. A. J. Org. Chem. 2009, 74, 2726.
[13]Brasca, R.; Kneeteman, M. N.; Mancini, P. M. E.; Fabian, W. M. F. J. Mol. Struct. (Theochem.)2009, 911, 124.
[14]Lipinska, T. Tetrahedron 2005, 61, 8148.
[15]Domingo, L. R.; Aurell, M. J.; Perez, P.; Contreras, R. Tetrahedron 2002, 58, 4417.
[16]陈鸿章, 王文峰, 李俊篯. 化学学报, 2007, 65, 2577.
[17]Hoffmann, R.; Woodward, R. B. J. Am. Chem. Soc. 1965, 87, 2046.
• 自学之友•
A Viewpoint on the Regioselectivity of Diels-Alder Reaction Based on the Principle of Conservation of the Orbital Symmetry
YUAN Yao-FengWANG Wen-Feng*
(College of Chemistry, Fuzhou University, Fuzhou 350108, P. R. China)
Abstract:Based on the principle of conservation of orbital symmetry (PCOS), it can be concluded that it is the interaction between the most stable valent orbitals of diene and dienophile that determines the regioselectivity of the Diels-Alder reaction, which produces the more stable σ1 bond of the two formed σ bonds. The regioisomer which possesses more stable σ1 bond in transition state will be the main product of the Diels-Alder reaction, which is called σ1 rule in this paper. The correctness to predict the main product of Diels-Alder reaction by using σ1 rule has been confirmed by quantum-chemical calculation, and the calculation also proves that the σ1 bond forms between the most stable valent orbital of the individual reactants, diene and dienophile.
Key Words:Diels-Alder reaction; Principle of conservation of orbital symmetry; Regioselectivity; Orbital interaction
基金资助:福建省自然科学基金(2013J01361);福建大学高等教育教学改革工程项目
*通讯作者,Email: wangwf@fzu.edu.cn
doi:10.3866/pku.DXHX20160168www.dxhx.pku.edu.cn
中图分类号:O621.1;G64
