尼罗红荧光染色法的优化及应用*
2016-06-01石健张雯婕冯汛胡雨婷瑶池
石健 张雯婕 冯汛 胡雨婷 瑶池
(南通大学 江苏南通 226019)
尼罗红荧光染色法的优化及应用*
石健张雯婕冯汛胡雨婷瑶池
(南通大学江苏南通 226019)
摘要以自主筛选的小球藻为材料对尼罗红荧光染色进行条件优化,并用该方法追踪微藻在污水中的油脂含量变化。实验发现,微藻只有经过超声波破碎,染色才会出现荧光,DMSO的添加会增强荧光反应。最终确定其染色条件为:DMSO与藻液体积比为1∶5,超声波破碎5 min后染色5 min,NR质量浓度1.5 μg/mL。在其应用方面发现,微藻的油脂积累量只有培养基的一半,说明污水不利于微藻油脂的积累;最佳采收时期为平稳期,此时微藻的产量和油脂含量达到最高。
关键词小球藻尼罗红超声波污水油脂
0引言
微藻因其生长快速、产量大、油脂含量高成为生物柴油的热门候选来源[1]。其中,小球藻具有高耐污、高含油特性,可利用污水饲养节约生产成本。因其兼具再生能源与污水处理的特点[2],小球藻在微藻生物柴油的研究中引起了人们的广泛关注。虽然已有大量的研究证明小球藻对污水处理的能力,但其在污水中的油脂积累情况却研究较少。油脂的产量直接决定微藻生物柴油的生产价值,监测污水中小球藻的油脂含量对其工业化生产具有重要意义。
尼罗红(Nile Red,NR)是一种脂溶性的荧光染料,可以准确地将细胞内脂类物质与其他贮藏物区分开[3], 因此经常被用于检测动物以及微生物细胞内油脂情况。尼罗红荧光染色法具有快速、简便、灵敏,样品需求量少且能连续活体检验等优点[4],已在多种生物中证明了尼罗红荧光染色的准确性。HUANG等人[5]就曾用尼罗红对冻干的小球藻藻粉进行油脂定量检测,发现其相关度高达0.99。利用尼罗红荧光染色建立快速简便低能耗的微藻脂质测定方法无论是对优良藻种的筛选,培养条件的优化或是藻采收时期的确定都十分有益。
虽然尼罗红荧光染色法已成功地应用在其他藻类中,但在小球藻这种高含油、高耐污的微藻的研究方面还没有广泛应用,其原因主要在于小球藻较厚的细胞壁阻碍了尼罗红与微藻胞内油脂的结合[6]。本实验中,荧光染色法的条件优化将着重对微壁进行研究,以期找到一种能够应用于所有微藻的技术,可以显著提高尼罗红荧光染色法的染色效果。1试验材料和试剂
藻种:采用从南通郊区筛选得到7号小球藻为实验材料。这是一种高耐污微藻,已用索氏提取法测定其油脂含量在35%左右。污水:本实验所用污水分别取自某污水处理厂和某养猪场(简称污水与养殖),具体参数见表1。采取水样后,若水质较浑浊可用两层纱布过滤去除固体悬浮物,经121 ℃,30 min高压蒸汽灭菌后备用。
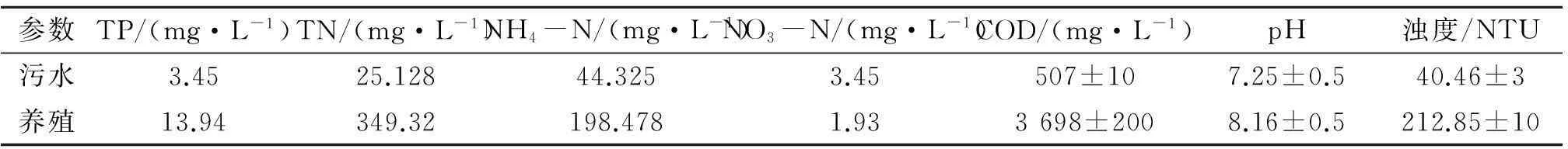
表1 污水参数
试剂有BG-11培养基,PBS缓冲液 (pH=7.2),二甲基亚砜 (DMSO), 质量浓度为100 μg/mL的尼罗红 (丙酮配制)等。仪器有离心机,RF-5301型荧光分光光度计、可见分光光度计、冷冻干燥机、摇床(定制带光照)、超声波清洗仪等。
2实验方法
2.1NR荧光染色
取进入平稳期的藻液,以4 000 r/min的速度离心分离10 min弃去上层培养液,随后用PBS重复清洗3次后悬浮OD750至0.8,NR染色5 min测样,测样时Ex=480 nm,扫描500~650 nm之间荧光,并在550~600 nm之间寻峰,其峰值代表油脂相对含量。
2.2污水中微藻生长曲线的测定
每两天测定藻液OD750,因污水具有浊度,测样时,先以4 000 r/min的速度离心分离10 min,用蒸馏水清洗3次后,再用蒸馏水悬浮至同体积测样。
2.3污水中微藻油脂的测定
取自污水处理厂的工业污水可直接培养微藻(下文简称污水),而养殖污水由于浓度过高,不能直接用于微藻的培养,实验中使用稀释5倍后的养殖污水进行实验(简称养殖),稀释采用蒸馏水稀释。试验每隔4 d取样,利用优化后的NR荧光染色法测定样品油脂的荧光强度。
3结果与讨论
3.1尼罗红(NR)荧光染色法的优化
3.1.1不同添加物对荧光扫描结果的影响
试验分别测定尼罗红(NR),二甲基亚砜(DMSO)及二者同时添加对微藻油脂荧光扫描结果的影响,并用藻液作为对比(CK) ,结果见图1,DMSO和藻液的体积比为1∶5,1 mL藻液中尼罗红的添加量为15 μL。
从图1可知,当激发波长为480 nm时,微藻的油脂峰位于550~600 nm之间,图1中4条曲线没有出现油脂峰,说明没有油脂被检出。本实验使用的7号藻油脂含量在35%左右,无油脂荧光峰说明染色方法有误,微藻油脂未被成功染色。其原因可能与小球藻的细胞结构有关。已有研究表明由于绿藻纲的一些小球藻具有较厚的细胞壁,阻挡NR与胞内油脂结合,因而无荧光产生。还有实验证明DMSO的添加可显著提高染色效果[7],可图中结果表明DMSO的加入也未能使NR成功与胞内油脂结合。为了得到7号藻油脂的荧光峰,需要对微藻的细胞壁进行处理,增加它的通透性。

图1 微藻的荧光扫描图谱
3.1.2细胞壁的处理条件优化
发现DMSO对7号藻无效后,又分别采用不同的有机溶剂处理微藻。甲醇作为一种极性溶剂,可与细胞膜的极性脂结合从而破坏细胞膜的通透性,而石油醚、乙醇也经常被用在微藻的油脂提取中,它们能与细胞壁作用促进油脂的提取,因此在实验中选择这3种试剂进行细胞壁的处理,有机试剂与藻液的体积比为1∶5,1 mL藻液中NR为15 μL,见图2。

图2 加入有机试剂的扫描图谱
从图2可知,所有曲线在550~600 nm之间都无峰值出现,说明这些有机试剂对7号藻全部无效,这可能与7号藻的高耐污能力有关:一个坚固、致密的细胞壁可以阻挡掉大部分有害物质,使其能够在各种污水中保持活性并处理污水,但其坚固的细胞壁对有机试剂也有很强的抵御能力,不会轻易被破坏结构。将有机试剂法排除后,借鉴微藻油脂的提取方法,进行直接破壁的探究。 超声波破壁法是一种适合大多数藻细胞的破壁方法,因此采用超声波破壁法对7号藻进行预处理,1 mL藻液中NR为15 μL,有机试剂与藻液的体积比为1∶5,见图3。

图3 超声波与有机试剂相结合的荧光扫描图谱
在尝试超声波破碎细胞发现在550~600 nm之间出现荧光峰后,与有机试剂相结合进行染色。从图3看出,7号藻经过超声波在550~600 nm之间出现明显的油脂峰,而甲醇和DMSO的加入增强了油脂的荧光反应,经过比较发现超声波破碎与DMSO结合的效果最好,说明DMSO可以增强染色效果。
分析图1和图3的荧光曲线,可知DMSO的主要作用在于促进NR和微藻油脂的结合,增强它们的荧光反应而非促进NR对于微藻细胞的渗透。有研究证明DMSO可增加生物膜的通透性,其原因在于DMSO可与生物膜的脂质作用[8],引起脂质双分子层厚度的减小甚至融合[9],从而促进溶质分子透过细胞膜。由此可见,DMSO对于由纤维素和果胶组成的小球藻细胞壁没有明显作用。DMSO同时具有疏水基和亲水基,可与水和有机溶剂互溶,该特性使其成为高效溶剂。当微藻经超声波破碎,细胞结构被破坏,油脂外露时,DMSO可以增加微藻油脂与NR的接触,进而增强了它们的荧光反应效果。
3.1.3尼罗红的最佳浓度
在确定了微藻的破壁方法后,对NR染色时的浓度进行了探究,具体结果见图4,曲线对应的1 mL藻液中尼罗红质量分别为5,10,15,20,25,30 mg。
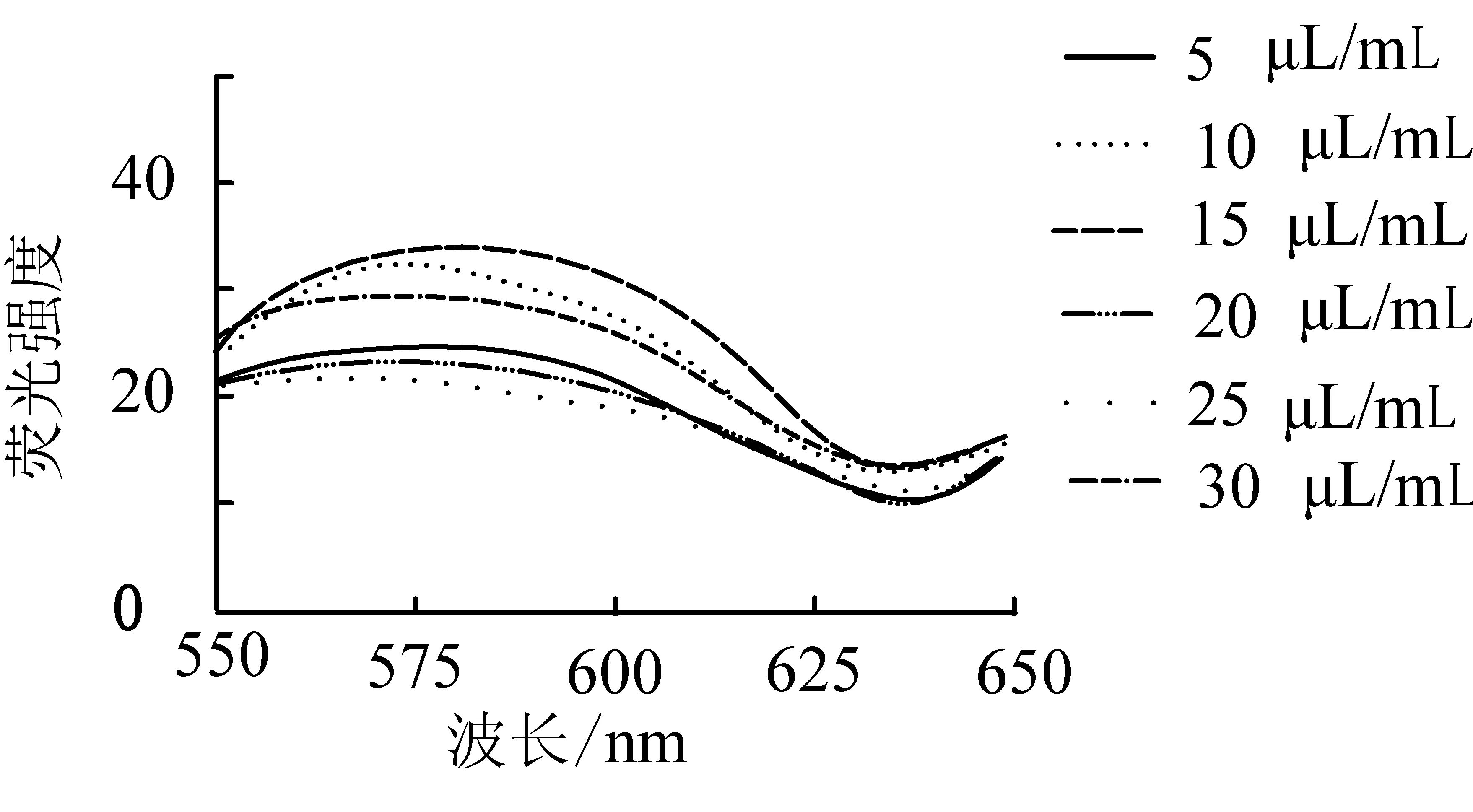
图4 不同尼罗红浓度的荧光扫描图谱
从图4可知,藻液中不同浓度的NR对微藻的荧光强度有一定的影响,比较几条曲线后发现15 μL/mL藻液的染色效果最好,可在OD750为0.8左右的小球藻的染色中使用。
3.2小球藻在污水中的油脂含量变化
在扫描微藻的油脂峰时发现其荧光峰无固定位置,都在550~600 nm之间移动,见图5。这是因为微藻油脂是多种脂肪的混合物,不同的污水,不同的生长阶段都会对微藻油脂的组成产生影响,如图5中同种微藻在同种培养基中其生长天数不同,油脂的荧光峰的位置也发生变化。为了更加准确评价微藻油脂的含量,本实验不固定测定某一波长的荧光值,而是在550~600 nm之间寻找峰值,扣除空白样后以此表征油脂含量。
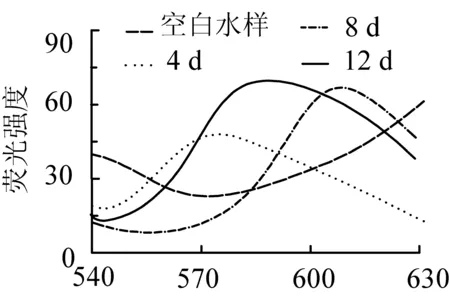
图5 7号藻在不同生长阶段的荧光曲线
将NR荧光染色法优化并确定了测定相对油脂的方法后,利用其对微藻在BG-11、污水、20%养殖废水中的油脂含量的变化进行了测定。油脂变化曲线和微藻生长曲线显示在图6中。
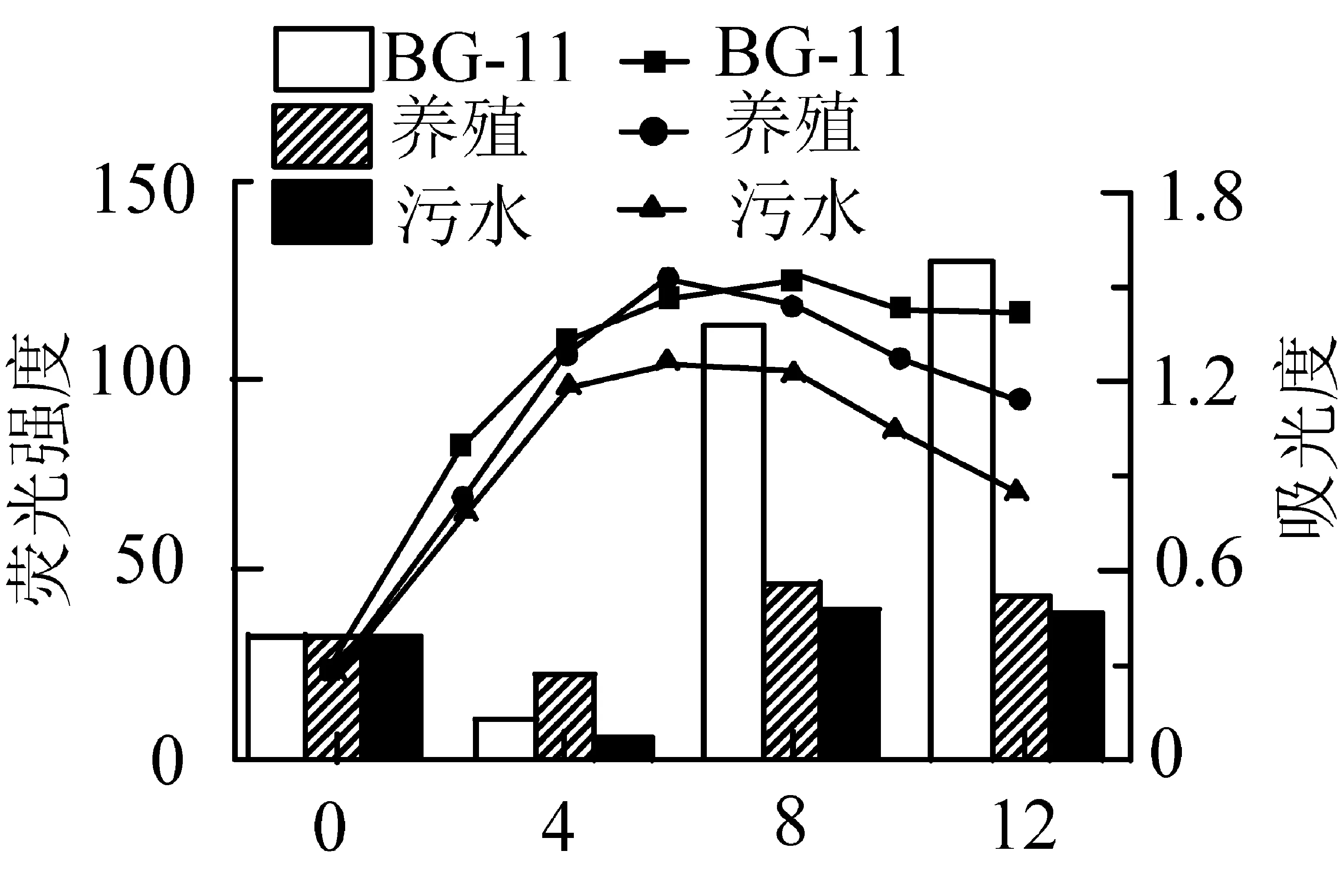
图6 微藻在不同污水中的油脂积累
观察图6中油脂的含量变化,发现微藻在前期和中期的油脂含量变化基本一致,都为前4天下降,4~8天上升。前4天微藻处于对数生长期,在该阶段由于环境适宜、营养充分,微藻大量繁殖,其营养都供给细胞自身的构建,没有转化为油脂贮存,甚至之前积累的油脂也被消耗,因而微藻油脂含量最低;经过一段时间的生长,微藻的生长环境恶化,其生长停止,开始积累油脂,所以在4~8天藻油上升。观察生长曲线,发现在BG-11中的微藻在8天后仍处于平稳期,油脂含量有所上升,而污水和养殖没有明显的平稳期,直接进入衰亡期,此阶段油脂下降。这说明微藻生长中,平稳期的延长有利于油脂的积累。
比较图6中的生长曲线和油脂积累情况,发现在最大产量上养殖与标准培养基不相上下;而在油脂积累上,2种污水明显不如BG-11,这是因为微藻油脂的积累主要发生在平稳期,而污水中的平稳期时间远远小于标准培养基。
4结语
(1)超声波破碎法可有效破除微藻细胞壁的阻碍,增强NR的染色效果,尤其是对于厚壁的小球藻,其与DMSO相结合的染色效果更好。
(2)DMSO在尼罗红荧光染色法中的主要作用是增强染色效果而非增加微藻细胞壁的通透性。
(3)利用NR追踪微藻在培养过程中油脂含量的变化,发现平稳期的延长有利于微藻油脂的积累。
(4)微藻在污水中的油脂含量不到培养基的一半说明污水不适合微藻积累油脂。
参考文献
[1]SCOTT S A, DAVEY M P, DENNIS J S, et al. Biodiesel from algae:challenges and prospects[J]. Current Opinion in Biotechnology,2010,21(3):277-286.
[2]LIM S L, CHU W L, PHANG S M. Use ofChlorellavulgarisfor bioremediation of textile wastewater[J]. Bioresource Technology,2010,101(19):7314-7322.
[3]KRANZ R G, GABBERT K K,MADIDAN M T. Positive selection systems for discovery of novel polyester biosynthesis genes based on fatty acid detoxification[J]. Applied Microbiology,1997,63(8):3010-3013.
[4]石玉新, 穆迪, 武洪庆, 等. 微藻油脂含量的几种快速测定方法[J]. 安徽农业科学,2012, 40(21): 11067-11069.
[5]HUANG G H,CHEN G,CHEN F. Rapid screening method for lipid production in alga based on Nile red fluorescence[J]. Biomass & Bioenergy,2009,33(10):1386-1392.
[6]王海英,符茹, 黄宝祥. 基于尼罗红荧光染色的小球藻脂质快速检测方法研究[J]. 中国油脂,2012,37(3):78-81.
[7]CHEN W, ZHANG C, SONG L, et al. A high throughput Nile red method for quantitative measurement of neutral lipids in microalgae[J]. Journal of Microbiological Methods,2009,77(1):41-47.
[8]方志聪, 戚智. 二甲基亚砜对生物膜的作用机理[J]. 生物物理学报,2012,28(8):638-643.
[9]AHKONG Q F, FISHER D, TAMPION W, et al. Mechanisms of cell fusion[J]. Nature. 1975,253(5488):194-195.
The Optimization and Application of Nile Red Fluorescent Determination
SHI JianZHANG WenjieFENG XunHU YutingYAO Chi
(NantongUniversityNantong,Jiangsu226019)
AbstractThe chlorella is screened as material to optimize Nile red fluorescent measure, and it is used to trance the variation on microalgae oil in sewage. The experiment finds out that the dye won’t work until microalgae is broken by ultrasonic, and the addition of DMSO will enhance fluorescence reaction. The optimization result is determined: VDMSO∶Vsewage=1∶5,5 min broke cell by ultrasonic and dye 5min,NR 1.5 μg/mL. As to the application, microalgae oil accumulation is only half compared to medium, indicating that sewage is not conducive to microalgae oil accumulation, and the best harvesting time is stationary phase, when the yield and oil content reaches the highest of micro algae.
Key WordschlorellaNile redultrasonicsewageoil
(收稿日期:2015-03-13)
作者简介石健,女,1972年生,教授,主要研究方向为水污染控制技术。
*基金项目:国家自然科学基金(21177067),江苏省自然科学基金重点项目(BK2010034),江苏省基础研究基金(BK2011009),南通市社会发展项目(HS2012001),南通市重点实验室项目(CP12011001),江苏省青蓝工程计划项目。
