青枯菌侵染不同抗病烟草品种的防御性酶活性及代谢组分差异分析
2016-06-01周星洋张功营董丽红杨恩兰万树青
周星洋, 张功营, 董丽红, 杨恩兰, 万树青
(华南农业大学 农学院/天然农药与化学生物学教育部重点实验室, 广东 广州 510642)
青枯菌侵染不同抗病烟草品种的防御性酶活性及代谢组分差异分析
周星洋, 张功营, 董丽红, 杨恩兰, 万树青
(华南农业大学 农学院/天然农药与化学生物学教育部重点实验室, 广东 广州 510642)
摘要:【目的】为烟草抗病育种和抗性鉴定提供生化代谢指标。【方法】采用茎部注射法对抗病品种粤烟97和感病品种长脖黄接种青枯雷尔菌Ralstonia solanacearum,并采用比色法和GC-MS法分别进行相关防御性酶活性及代谢物质的测定。【结果】抗病品种粤烟97的PAL、SOD、POD、PPO活性,接菌组与对照组均分别高于感病品种长脖黄的接菌组与对照组;抗病品种粤烟97和感病品种长脖黄分别在接菌后第7天和第5天,PAL活性高于对照组,其余时间酶活性接菌组均低于对照组;抗病品种粤烟97和感病品种长脖黄在受青枯雷尔菌侵染前期,SOD、POD、PPO酶活性均提高,随着时间延长酶活性均低于对照组。POD和PPO同工酶凝胶电泳表明:抗病品种粤烟97同工酶类型多于感病品种长脖黄;接菌后第3天,粤烟97的同工酶谱带宽度与色度增强,而长脖黄无增强现象。说明抗病品种能快速应对外界刺激,加速相关抗病物质的形成。代谢物检测表明:抗病品种粤烟97接菌组中肌肉肌醇、烟碱、苹果酸、L-苏氨酸等物质的相对质量分数高于对照组,而感病品种长脖黄接菌组中这些物质均低于对照组,反映品种间抗青枯病能力的强弱可能与上述物质有关。 【结论】烟草不同抗病品种叶片中PAL、SOD、POD、PPO酶活性的高低,以及上述代谢物质含量的变化,可作为反映烟草抗青枯病的生化指标。
关键词:烟草; 青枯雷尔菌; 防御性酶; 酶活性; 同工酶; 代谢组分
烟草青枯病是一种由青枯雷尔菌Ralstoniasolanacearum引起的系统性侵染病害,现已成为世界各产烟区最主要的病害之一[1]。该病在我国河南、山东、江苏、云南、广西、广东、福建等地普遍发生,烟株一旦染病,往往整株死亡,其危害是毁灭性的,给生产造成重大经济损失[2]。因此,研究青枯菌致病机理和寻找有效的防治青枯病的方法是当前植物病理学研究的重要课题之一,其中抗病育种防治青枯病的生化机制最为重要。国内外学者对大量的相关病害进行研究,发现植物在受病害侵袭过程中表现出一系列复杂的生理生化变化,包括体内代谢的变化、细胞内活性氧的积累与清除、抗病信号的产生与转导、防卫反应的表达与调控等[3-4]。在这一复杂过程中,一些与植物抗病性相关的酶类起着很重要的调控作用[5-6],如苯丙氨酸解氨酶(Phenylalanine ammonium lyase, PAL)、超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)和多酚氧化酶(Polyphenol oxidase,PPO)等。同工酶谱分析作为一种认识基因存在和表达的工具已被大量运用于种质分类与种间遗传差异分析[7-9],其规律性变化可以作为一种早期的鉴别手段,用来研究植物的抗病性问题。因此,笔者选择了2个不同抗性的烟草品种,进行青枯病菌的接种试验,在接菌后不同时段及时采样,测定与病程相关的防御性酶活性以及代谢组分,从而了解烟草抗、感青枯病的变化过程,旨为烟草抗青枯病育种提供生化方面的依据。
1材料与方法
1.1材料
试验所用烟草品种:高度感病品种长脖黄及高度抗病品种粤烟97,均由广东南雄烟草科学研究所提供;烟草青枯雷尔菌由广东省农科院何自福研究员惠赠;病菌的保存与增殖参照匡传富等[10]的方法。
仪器:LRH型生化培养箱(广东省韶关市鑫腾科普有限公司);FC—18R台式高速冷冻离心机(厦门仪达仪器有限公司);DYCZ-24DN型垂直电泳槽(北京六一仪器厂);DYY 11B三恒电泳仪(北京六一仪器厂);10 μL微量进量器(德国Eppendorf AG);UV-8500PC型紫外-可见分光光度计(上海天美科学仪器公司);1702-MP8型电子天平(德国Startorius公司);岛津GC-MS Q2010 Ultra(日本Shimadzu公司)。
1.2试验方法
选取长势一致、3~4叶龄的健康烟草植株供试,将其移栽至装有灭菌土的18 cm×23 cm的塑料盆中,每个处理为5株,设置3个重复,放置于室外环境下。待烟苗生长7 d后,接菌组参照黎定军等[11]茎部注射法,用注射器将1 mL青枯雷尔菌液(5×108cfu·mL-1)从叶腋处注入烟茎基部的维管束里,并在接菌处注意保湿,对照组为清水处理的烟苗。分别在处理1、 3、 5、 7、 9、 11 d后,取同一叶位处的烟叶进行相关生化指标的测定,其中代谢组分差异分析选择接菌后的第3天进行。
1.2.1防御性酶活性测定PAL的提取及活性测定参照薛应龙等[12]方法;SOD的提取与测定参照邹琦[13]163-165的方法;POD的提取与测定参照张志良[14]的方法;PPO的提取与活性测定参照李靖等[15]的方法。PAL以每分钟D290nm变化0.01所需要的酶量定义为1个酶活性单位(U);POD和PPO分别以每分钟D470 nm、D410 nm变化1.00所需要的酶量定义为1个酶活性单位(U);SOD以每分钟D560nm抑制50 % 所需要的酶量定义为1个酶活性单位(U)。
1.2.2POD和PPO同工酶电泳酶液制备: 取 0.1 g 样品,加入 0.1 mol·L-1预冷的 Tris-HCl (pH 6.8) 缓冲液 1.5 mL,冰浴研磨,12 000 r·min-1、4 ℃条件下离心15 min,取上清液,于-70 ℃冰箱保存备用。
电泳:采用不连续的聚丙烯酰胺凝胶垂直板电泳技术[13]131-135,上样缓冲液不加 SDS 和β-巯基乙醇,电极缓冲液为pH 8.3 的 Tris-Gly 缓冲液,样品不经加热处理。同工酶电泳采用聚丙烯酰胺为7.5% 的分离胶、4%的浓缩胶。样品上样量为 10 μL[V(样品缓冲液)∶V(粗酶液)=1∶1],于 4 ℃ 条件下电泳,浓缩胶80 V、电泳30 min,分离胶120 V、电泳1.5 h。以溴酚蓝作指示剂,电泳结束后,取下胶进行染色。
POD同工酶染色: 称取0.1 g联苯胺,加少量无水乙醇溶解,依次加入5 mol·L-1的醋酸溶液10 mL,1.5 mol·L-1的醋酸钠溶液10 mL,水70 mL,最后加入3~5滴质量分数为30%的过氧化氢溶液。 将凝胶电泳胶带放入装有染色液的塑料小盆中,并轻轻晃动,待条带清晰后,立即用相机拍照记录。
PPO同工酶染色:3份质量分数为1%邻苯二酚溶液,1份0.05 mol·L-1磷酸缓冲液(pH6.8),1份质量分数为0.06%对苯二胺溶液,混合均匀后,将胶带放入染色液中3~5 min,即可见到棕红色的多酚氧化酶酶带。
1.2.3代谢组分差异分析烟草样品前处理方法:参考Tikunov等[16]和Roessner等[17]建立的方法。
气相色谱条件:进样口温度250 ℃。升温程序:初始温度50 ℃,保持1 min,以5 ℃·min-1升温速度升到150 ℃保持2 min,最后以10 ℃·min-1升温速度升到250 ℃,保持10 min。以高纯氦气(体积分数大于 99.999%)为载气采用不分流进样方式,进样量1 μL,载气流速1 mL·min-1。
质谱条件:电子轰击源(EI),离子源温度200 ℃,四极杆温度150 ℃,接口温度250 ℃,电子能量70 eV,溶剂延迟时间4 min;调谐方式为标准调谐,质谱扫描方式为全扫描,扫描范围为50~500 aum。使用NIST 2011谱库进行图谱检索。
1.3数据分析
试验数据采用Microsoft Excel 2003和SPSS11.5数据处理软件进行数据统计分析,酶活性数值均为平均值±标准差。应用Duncan’s新复极差法进行差异显著性分析。
2结果与分析
2.1几种防御性酶活性变化
2.1.1PAL活性变化从图1可知,抗病品种粤烟97的PAL活性在整个测定时期,接菌组与对照组均高于感病品种长脖黄。抗病品种粤烟97在接菌后第7 天酶活性显著高于对照组(P<0.05),其余时间酶活性均低于对照组;感病品种长脖黄在接菌后第5 天,PAL活性显著高于对照组(P<0.05),其余时间酶活性均低于对照组。
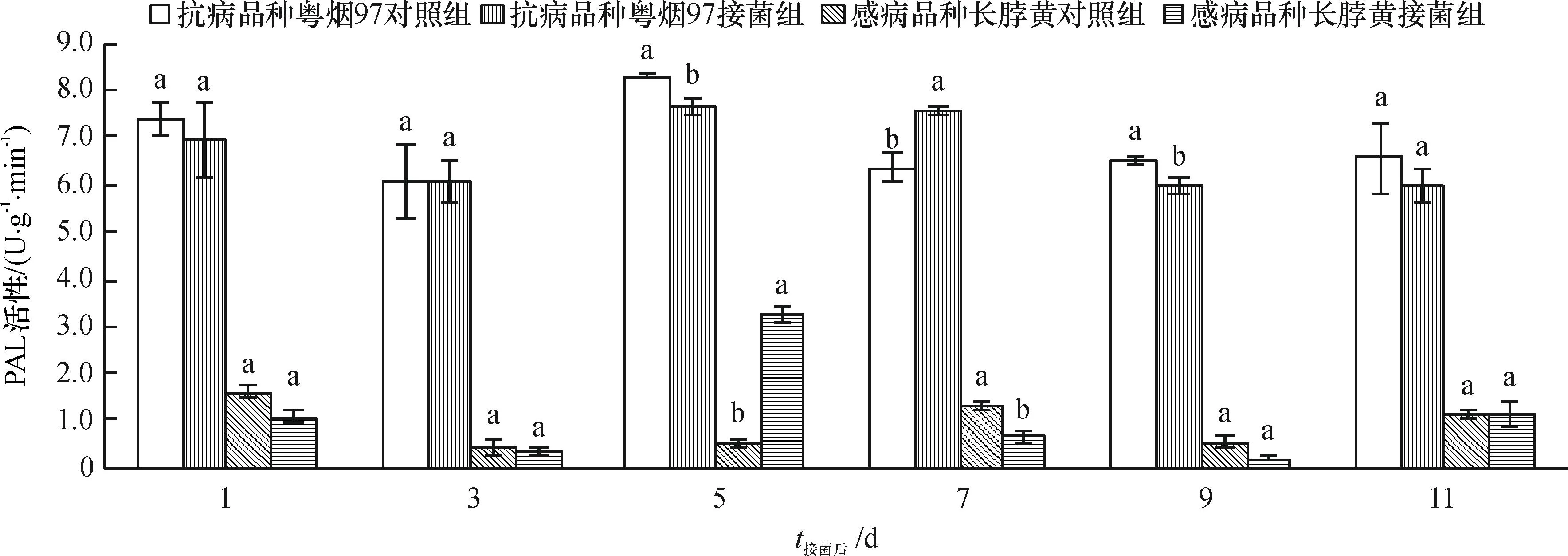
相同时间同一烟草品种不同柱子上方凡是有一个相同小写字母者,表示该品种对照组和接菌组间差异不显著 (P>0.05,Duncan’s法)。
图1不同抗病烟草品种接种青枯雷尔菌后叶片PAL活性(以鲜质量计)的变化
Fig.1Changes of PAL activities (based on fresh mass) in leaves of resistant and susceptible tobacco cultivars after inoculation of Ralstonia solanacearum
2.1.2SOD活性变化从图2可知,抗病品种粤烟97的SOD活性在整个测定时期,接菌组与对照组均高于感病品种长脖黄。抗病品种粤烟97在接菌后第3、 5、 7、 9 天,SOD活性均高于对照组,其中第7 天差异显著(P<0.05);感病品种长脖黄在接菌后第1、 3、 5 天,SOD活性均高于对照组,其中第5天差异显著(P<0.05)。由此得知,抗、感品种在受到青枯菌侵害后,均能使SOD迅速被激活,从而起到清除或阻止病原菌所造成伤害的作用。

相同时间同一烟草品种不同柱子上方凡是有一个相同小写字母者,表示该品种对照组和接菌组间差异不显著 (P>0.05,Duncan’s法)。
图2不同抗病烟草品种接种青枯雷尔菌后SOD活性(以鲜质量计)的变化
Fig.2Changes of SOD activities (based on fresh mass) in leaves of resistant and susceptible tobacco cultivars after inoculation of Ralstonia solanacearum
2.1.3POD活性变化从图3可知,抗病品种粤烟97的POD活性在整个测定时期,接菌组与对照组均高于感病品种长脖黄。抗病品种粤烟97在接菌后第3 天,酶活性显著高于对照组(P<0.05),其余时间酶活性均显著低于对照组(P<0.05);感病品种长脖黄在接菌后第3、 5 天,酶活性高于对照组,其中第5天差异显著(P<0.05),其余时间POD活性均低于对照组。

相同时间同一烟草品种不同柱子上方凡是有一个相同小写字母者,表示该品种对照组和接菌组间差异不显著 (P>0.05,Duncan’s法)。
图3不同抗病烟草品种接种青枯雷尔菌后POD活性(以鲜质量计)的变化
Fig.3Changes of POD activities (based on fresh mass) in leaves of resistant and susceptible tobacco cultivars after inoculation of Ralstonia solanacearum
2.1.4PPO活性变化从图4可知,抗病品种粤烟97对照组、接菌组的PPO活性均高于感病品种长脖黄的。接菌后第3 天,粤烟97和长脖黄的PPO活性略高于各自的对照组,其余时间均低于各自的对照组。
2.2接菌处理对不同品种烟草叶片中 POD 和 PPO 同工酶表达的影响
2.2.1对POD同工酶的影响从图5A可看出,抗病品种粤烟97接菌后,整个测定期间POD同工酶谱带未增加,但凝胶电泳谱带宽度与色度均发生变化。接菌后第3 天,接菌组的同工酶谱带较对照组谱带宽,且颜色较深;接菌后第1、 11 天,接菌组POD同工酶谱带色度比对照组弱;接菌后第5 天,接菌组POD同工酶谱带条数比对照组少,且部分条带颜色较浅;接菌后第7、 9 天,接菌组与对照组POD同工酶谱带无明显差异。从图5B可看出,感病品种长脖黄在接菌后第1、 5、 7、 9天,接菌组POD同工酶谱带颜色均比对照组颜色浅;接菌后第3、 11 天,同工酶谱带宽度和颜色与对照基本无差别。对比图5 A、图5 B可知,抗病品种粤烟97的POD同工酶谱带为6条,感病品种长脖黄的POD同工酶谱带为2条,说明抗病品种粤烟97的POD同工酶类型多于感病品种长脖黄的POD同工酶类型。

相同时间同一烟草品种不同柱子上方凡是有一个相同小写字母者,表示该品种对照组和接菌组间差异不显著(P>0.05,Duncan’s法)。
图4不同抗病烟草品种接种青枯雷尔菌后PPO活性(以鲜质量计)的变化
Fig.4Changes of PPO activities (based on fresh mass) in leaves of resistant and susceptible tobacco cultivars after inoculation of Ralstonia solanacearum

CK:对照组,TR:接菌组; A: 抗病品种粤烟97,B: 感病品种长脖黄。
图5不同抗病烟草品种接种青枯雷尔菌后叶片POD同工酶谱带
Fig.5Electrophoretic isoenzyme patterns of POD in leaves of resistant and susceptible tobacco cultivars after inoculation of Ralstonia solanacearum
2.2.2对PPO同工酶的影响从图6A可以看出,抗病品种粤烟97接菌后第1、 7天,接菌组与对照组的PPO同工酶谱带无明显差异;接菌后第3天,PPO同工酶谱带宽度与色度均高于对照组;接菌后第5天,PPO同工酶谱条带数与色度均低于对照组;接菌后第9、 11天, 部分PPO同工酶谱带色度略低于对照组。从图6B可以看出,感病品种长脖黄接菌后第1、 9、 11天, PPO同工酶谱带条数、色度与对照组无明显差异;接菌后第3天,PPO同工酶谱带色度均低于对照组;接菌后第5和7天,PPO同工酶谱带色度略高于对照组。对比图6 A、图6 B可知,抗病品种粤烟97的PPO同工酶谱带最多为6条,最少为4条,感病品种长脖黄的POD同工酶谱带为2条,说明抗病品种粤烟97的PPO同工酶类型多于感病品种长脖黄的PPO同工酶类型。

CK:对照组,TR:接菌组;A:抗病品种粤烟97, B: 感病品种长脖黄。
图6不同抗病烟草品种接种青枯雷尔菌后叶片PPO同工酶谱带
Fig.6Electrophoretic isoenzyme patterns of PPO in leaves of resistant and susceptible tobacco cultivars after inoculation of Ralstonia solanacearum
2.3代谢组分差异分析
对不同抗病品种接菌处理后叶片提取物进行GC-MS测定,得到总离子流图(图7)。从图7可以直观地看出不同抗病品种间存在明显差异,接菌组与对照组间,峰的数量和强度也都存在差异。
通过岛津质谱工作站对总离子流图的处理解析,峰面积归一化法测量了各组分的百分含量。通过检索和解析初步分离最多确定了70个化合物。鉴定的各组分及相对质量分数见表1。

1:感病品种长脖黄对照组;2:感病品种长脖黄接菌组;3:抗病品种粤烟97对照组;4:抗病品种粤烟97接菌组。
图7不同抗病烟草品种接种青枯雷尔菌后代谢组分的GS-MS总离子流图
Fig.7Total ion chromatograms of metabolites of resistant and susceptible tobacco cultivars after inoculation of Ralstonia solanacearum
表1不同抗病烟草品种接种青枯雷尔菌后品种间代谢物差异比较1)
Tab.1Comparison of metabolites from resistant and susceptible tobacco cultivars after inoculation of Ralstonia solanacearum

序号t保留/min代谢物名称相对质量分数/%长脖黄对照组长脖黄接菌组粤烟97对照组粤烟97接菌组17.362硼酸………0.0629.377乳酸0.580.370.420.61310.108L-缬氨酸…0.65…0.27411.725草酸1.031.270.480.89512.118L-亮氨酸…0.26……612.691L-异亮氨酸…0.41…0.19713.571丙二酸…0.09…0.17813.892L-正缬氨酸…0.08……915.173丝氨酸1.150.680.842.861015.3082-氨基乙醇…0.10……1115.756甘油1.03………1215.772磷酸…0.972.513.661316.196L-苏氨酸1.390.790.732.631416.432甘氨酸…0.120.16…1516.639丁二酸0.170.04…0.071617.330甘油酸0.160.050.711.411717.421烟碱6.935.381.884.071817.775壬酸………0.071919.153L-甲硫氨酸…0.08……2019.645L-天冬氨酸…0.140.190.362121.4552-哌啶羧酸………0.362221.568苹果酸8.614.294.169.792322.288L-吡咯烷酮-5-羧酸1.971.170.704.562422.360赤藓糖醇…0.08…0.122522.5394-氨基丁酸……1.63…2622.833L-苯丙氨酸0.912.01…0.882723.3584-羟基苯乙胺…0.32……2823.504十二烷醇…0.32……2923.992L-苏糖酸1.940.773.1416.67

续表1 Tab.1 continued序号保留时间/min代谢物名称相对质量分数/%长脖黄对照组长脖黄接菌组粤烟97对照组粤烟97接菌组3024.223正十六烷………0.103124.432戊酸……1.911.523225.137L-谷氨酸0.391.090.840.723326.190L-天冬酰胺…0.631.740.243426.567碘十六烷0.10………3526.618D-来苏糖1.940.180.110.133626.918核糖醇0.250.150.100.193727.276D-鼠李糖0.100.07…0.093827.334木糖醇………0.163927.540十四烷醇…0.16…0.104027.608L-阿拉伯糖…0.060.100.144127.669D-赤藓糖0.390.080.350.274227.848核糖酸………0.124328.145D-葡萄糖醇…0.09……4428.567莽草酸0.15…0.070.084528.634酒石酸0.160.06……4628.730柠檬酸0.480.480.160.364728.965N-乙酰-L-赖氨酸…0.06……4829.157腺嘌呤…0.05……4929.578β-D-果糖0.550.361.572.025029.653阿拉伯糖醇0.170.08……5129.714а-D-果糖0.360.191.081.405229.826D-甘露糖……0.170.325329.832鲨肌醇0.260.15……5429.906D-(+)-塔罗糖0.680.581.842.655529.952L-赖氨酸…0.310.21…5630.120阿洛糖0.13…0.270.485730.160L-酪氨酸0.121.120.26…5830.391D-甘露醇0.260.090.620.275930.874D-木糖…0.07…0.426030.978顺式-9-十六碳烯酸………0.046131.204棕榈酸1.891.050.480.736231.229D-葡萄糖酸…0.08……6332.069肌肉肌醇10.110.9911.9022.176432.353D-半乳糖0.11……0.216532.981五羟基己醛0.38…0.12…6633.033色氨酸…0.11……6733.226硬脂酸1.650.720.360.456835.185D-甘露糖酸0.460.08…0.106935.242D-甘油-D-古洛糖-庚酸0.40………7037.256D-纤维二糖0.17………
1) 长脖黄为感病品种,粤烟97为抗病品种;“…”表示未检测到。
从表1可以看出烟株被青枯雷尔菌侵染后代谢物差异较为明显,粤烟97接菌后烟叶样本中代谢物相对质量分数高于其对照组,且长脖黄接菌后相对质量分数低于其对照组的是乳酸、甘油酸、肌肉肌醇、L-苏糖酸、苹果酸、L-吡咯烷酮-5-羧酸、烟碱、丝氨酸、L-苏氨酸、D-来苏糖、核糖醇、β-D-果糖、D-(+)-塔罗糖、棕榈酸、硬脂酸,说明烟草抗青枯病能力的强弱可能与这些物质有关,或者与参与形成上述代谢物的酶活性有关;2个不同抗病品种接菌后共同产生或者相对质量分数比对照增高的物质分别为:L-缬氨酸、草酸、L-异亮氨酸、丙二酸、磷酸、L-天冬氨酸、赤藓糖醇、L-苯丙氨酸、十四烷醇、L-阿拉伯糖、D-木糖,不同抗病品种烟草在受到青枯雷尔菌侵袭时均会刺激体内代谢物含量的改变,其含量的增高说明上述代谢物可能参与抗病相关物质的形成。
3讨论与结论
与植物抗病相关的PAL、SOD、PPO和POD均属于植物防卫系统相关酶,因此可作为植物抗病的生化指标。在植物体内,PAL是苯丙烷类代谢途径的关键酶和限速酶,催化L-苯丙氨酸解氨生成反式肉桂酸(合成各种酚类及木质素的前体物质),因而调控与植物抗病有关的酚类物质和木质素在植物体中的合成和积累[18]。研究表明,PAL活性与植物抗病性呈正相关[15, 19]。本研究中,在整个测定期间,抗病品种粤烟97的PAL活性均高于感病品种长脖黄,说明烟草品种抗病强弱,与体内PAL活性呈正相关。SOD作为植物体内活性氧清除系统重要保护酶之一,能清除超氧化物阴离子自由基,提高植物抗逆性[20]。本研究表明,抗病品种粤烟97在接菌后第3、 5、 7、 9 天,SOD活性均大于对照,感病品种长脖黄在接菌后第1、 3、 5 天,SOD活性均高于对照,抗病品种SOD活性在接菌组与对照组中均高于感病品种,说明在青枯雷尔菌侵染后抗病品种可高效地清除活性氧的伤害,感病品种由于本身SOD活性低,接菌后酶活性增长幅度较小而使其受到伤害。POD是一种应激酶,其活性与植物抗病性有着密切的关系,在活性氧的清除和维持植物体内活性氧的正常水平中起作用;POD 还能催化木质素合成,木质化的细胞壁机械性能加强,不透水气,阻止营养物质、水分、色素等的扩散,使病原菌无法获得营养而死亡[21-22]。研究表明,POD活性与植物的抗病性具有正相关关系[23-26]。PPO是一类广泛分布于植物体内的质体金属酶,能直接以O2为氧化底物将酚氧化成醌,从而抑制病虫害的侵袭。PPO不仅参与酚类物质的氧化,同时也参与木质素的形成[27]。本研究发现抗病品种粤烟97的POD活性高于感病品种长脖黄,且POD同工酶谱分析表明,抗病品种粤烟97的谱带条数均要多于感病品种长脖黄。接菌后抗病品种的POD活性迅速升高,而感病品种则较弱,2品种的POD活性随着时间延长均降低,说明青枯雷尔菌侵染烟草后均能刺激体内POD活性的提高,且抗病品种总体强于感病品种。抗病品种粤烟97和感病品种长脖黄接菌后第3 天,PPO活性略高于对照组,随着时间延长酶活性均降低。抗病品种粤烟97中PPO活性高于感病品种长脖黄,可能与其抗病性强有关。
烟草植株受到病菌侵染时,引起相关酶活性的改变,继而引起植株体内代谢物质的改变,形成的代谢物本身具有抗病作用或者进一步通过转化形成与抗病有关的次级代谢物。例如PAL酶活性高低会影响L-苯丙氨酸含量[28],POD酶活性影响某些糖类、氨基酸类等与木质素合成有关物质的含量[29]。本研究发现,粤烟97与长脖黄在接菌处理3 d时,SOD、POD、PPO活性均比对照高,而PAL活性均低于对照组,因此植株体内相关酶催化形成的物质应该有所提高,或者酶促反应的底物应该有所降低。代谢物检测表明,2个抗病性不同的品种接菌后共同产生或者相对质量分数相比对照增高的物质分别为:L-缬氨酸、草酸、L-异亮氨酸、丙二酸、磷酸、L-天冬氨酸、赤藓糖醇、L-苯丙氨酸、十四烷醇、L-阿拉伯糖、D-木糖,说明此类代谢物含量的变化可能与防御性酶活性有关;粤烟97接菌后烟叶样本中代谢物相对质量分数高于其对照组,但长脖黄接菌后相对质量分数低于其对照组的物质分别为:乳酸、甘油酸、肌肉肌醇、L-苏糖酸、苹果酸、L-吡咯烷酮-5-羧酸、烟碱、丝氨酸、L-苏氨酸 、D-来苏糖、核糖醇、β-D-果糖、D-(+)-塔罗糖、棕榈酸、硬脂酸,说明此类代谢物含量的变化与防御性酶活性变化无关,可能与其他酶活性变化有关。研究表明,肌醇在植物体内通过自身氧化途径可以代谢为与植物细胞壁合成息息相关的多糖,从而提高植物抗病性[30]。烟碱作为一种防御性物质,在烟草受到病虫害侵袭时会刺激体内产生大量烟碱[31],此外,相关研究表明,在细胞质中苹果酸酶催化苹果酸脱羧形成的丙酮酸参与莽草酸途径,进一步形成丙酮酸族氨基酸和一些与防御反应有关的次生代谢物质[32]。L-苏糖酸作为L-抗坏血酸的一种降解产物,广泛存在于植物体内,其含量的增加,说明抗坏血酸积极参与抗氧化作用,保护机体免于自由基的威胁[33]。不同烟草品种抗青枯病的机理,不仅与其体内防御性酶活性有关,可能还与某些代谢物或与其相关的酶活性变化有关。
参考文献:
[1]HAYWARD A C. Biology and epidemiology of bacterial wilt caused byPseudomonassolanacearum[J]. Annu Rev Phytopathol, 1991, 29: 65-87.
[2]刘雅婷,张世光. 烟草青枯病的研究进展[J]. 云南农业大学学报, 2001,16(1): 72-76.
[3]宋瑞芳,丁永乐,宫长荣,等. 烟草抗病性与防御酶活性间的关系研究进展[J]. 中国农学通报, 2007, 23(5): 309-314.
[4]WALTERS D, WALSH D, NEWTON A, et al. Induced resistance for plant disease control: Maximizing the efficacy of resistance elicitors[J]. Phytopathology, 2005, 95(12): 1368-1373.
[5]NANDAKUMAR R, BABU S, VISWANATHAN R, et al. Induction of systemic resistance in rice against sheath blight disease byPseudomonasfluorescens[J]. Soil Biol Biochem, 2001, 33(4/5): 603-612.
[6]JUNG W J, JIN Y L, KIM Y C, et al. Inoculation ofPaenibacillusillinoisensisalleviates root mortality, activates of lignification-related enzymes, and induction of the isozymes in pepper plants infected byPhytophthoracapsici[J]. Biol Control, 2004, 30(3): 645-652.
[7]TORRES A M, SATOVIC Z, CANOVAS J, et al. Genetics and mapping of new isozyme loci inViciafabaL. using trisomics[J]. Theor Appl Genet, 1995, 91(5): 783-789.
[8]WARNKE S E, DOUCHES D S, BRANHAM B E. Isozyme analysis supports allotetrapoloid inheritance in tetraploid creeping bluegrass (AgrostispalustrisHuds.)[J]. Crop Sci, 1998, 38(3): 801-805.
[9]HUANG H, LAYNE D R, PETERSON R N. Using isozyme polymorphisms for identifying and assessing genetic variation in cultivated pawpaw (Asiminatriloba(L.) Dunal)[J]. J Am Soc Hortic Sci, 1997, 122(4): 504-511.
[10]匡传富,罗宽. 烟草品种对青枯病抗病性及抗性机制的研究[J]. 湖南农业大学学报(自然科学版), 2002,28(5): 395-398.
[11]黎定军,周清明. 烟草品种(系)对青枯病菌的抗性鉴定与分析[J]. 湖南农业大学学报, 1996,22(3): 275-277.
[12]薛应龙,欧阳光察,澳绍根. 植物苯丙氨酸解氨酶的研究:Ⅳ:水稻幼苗中PAL活性的动态变化[J]. 植物生理学报, 1983,9(3): 301-306.
[13]邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2003.
[14]张志良. 植物生理学试验指导[M]. 北京: 高等教育出版社, 2003: 268-271.
[15]李靖,利容千,袁文静. 黄瓜感染霜霉病菌叶片中一些酶活性的变化[J]. 植物病理学报, 1991,21(4): 39-45.
[16]TIKUNOV Y, LOMMEN A, DE VOS C R, et al. A novel approach for nontargeted data analysis for metabolomics. Large-scale profiling of tomato fruit volatiles[J]. Plant Physiol, 2005, 139(3): 1125-1137.
[17]ROESSNER U, WAGNER C, KOPKA J, et al. Simultaneous analysis of metabolites in potato tuber by gas chromatography-mass spectrometry[J]. Plant J, 2000, 23(1): 131-142.
[18]ADAMKOVA S, LUHOVA L, PETRIVALSKY M, et al. Characterization of enzyme phenylalanine ammonia-lyase and its role in activation of defensive mechanisms in plants[J]. Chem Listy, 2006, 100(7): 486-494.
[19]寿森炎,冯壮志,殷一平,等. 番茄抗感青枯病品种的生理生化差异[J]. 浙江大学学报(农业与生命科学版), 2005,31(5): 550-554.
[20]刘家忠,龚明. 植物抗氧化系统研究进展[J]. 云南师范大学学报(自然科学版), 1999,19(6): 1-11.
[21]胡青平,徐建国,薄芳芳,等. 烟草感染青枯菌前后POD及同工酶的变化[J]. 中国农学通报, 2007,23(6): 497-500.
[22]宋凤鸣,郑重,葛秀春. 活性氧及膜脂过氧化在植物-病原物互作中的作用[J]. 植物生理学通讯, 1996,32(5): 377-385.
[23]JOSEPH L M, KOON T T, MAN W S. Antifungal effects of hydrogen peroxide and peroxidase on spore germination and mycelial growth ofPseudocercosporaspecies[J]. Can J Bot, 1998, 76(12): 2119-2124.
[24]PATEL S J, SUBRAMANIAN R B, JHA Y S. Biochemical and molecular studies of early blight disease in tomato[J]. Phytoparasitica, 2011, 39(3): 269-283.
[25]YUBEDEE A G. Role of polyphenol oxidase, peroxidase and total phenol content in differential resistance ofDioscoreaspecies toFusariummoniliforme[J]. Indian J Agr Sci, 1998, 68(10): 644-646.
[26]GULSEN O, EICKHOFF T, HENG-MOSS T, et al. Characterization of peroxidase changes in resistant and susceptible warm-season turfgrasses challenged byBlissusocciduus[J]. Arthropod-Plant Inte, 2010, 4(1): 45-55.
[27]张树生,胡蕾,刘忠良,等. 植物体内抗病相关酶与植物抗病性的关系[J]. 安徽农学通报, 2006, 12(13): 48-49.
[28]崔彦玲,张环. 番茄叶霉病抗性与苯丙氨酸解氨酶的相关性[J]. 华北农学报, 2003, 18(1): 79-82.
[29]蒋选利,李振岐,康振生. 过氧化物酶与植物抗病性研究进展[J]. 西北农林科技大学学报(自然科学版), 2001, 29(6): 124-129.
[30]张梦,谢益民,杨海涛,等. 肌醇在植物体内的代谢概述:肌醇作为细胞壁木聚糖和果胶前驱物的代谢途径[J]. 林产化学与工业, 2013,33(5): 106-114.
[31]沈嘉,程新胜. 植物抗虫性物质烟碱的研究进展[J]. 热带亚热带植物学报, 2007,15(5): 459-464.
[32]宋超,张立军,贾永光,等. 植物的苹果酸代谢和转运[J]. 植物生理学通讯, 2009,45(5): 419-428.
[33]DEBOLT S, MELINO V, FORD C M. Ascorbate as a biosynthetic precursor in plants[J]. Ann Bot-London, 2007, 99(1): 3-8.
【责任编辑柴焰,庄延】
Differences of defensive enzyme activities and metabolites between resistant and susceptible tobacco cultivars infected by Ralstonia solanacearum
ZHOU Xingyang, ZHANG Gongying, DONG Lihong, YANG Enlan, WAN Shuqing
(College of Agriculture, South China Agricultural University/Key Laboratory of Natural Pesticide and Chemical Biology,Ministry of Education, Guangzhou 510642, China)
Abstract:【Objective】 In order to provide the biochemical and metabolic basis of tobacco breeding for disease resistance and resistance identification. 【Method】Resistant (Yueyan 97) and susceptible (Changbohuang) tobacco cultivars were inoculated with Ralstonia solanacearum by trunk injection. Defensive enzyme activities and metabolites were measured by using colorimetric method and GC-MS.【Result】The activities of phenylanine ammonia lyase (PAL), superoxide dismutase (SOD), peroxidase (POD) and polyphenol oxidase (PPO) in the resistant cultivar ‘Yueyan 97’ were higher than those in the susceptible cultivar ‘Changbohuang’ with the same inoculation treatment. The PAL activities of Yueyan 97 and Changbohuang were higher than that in control on the seventh and fifth days after inoculation, respectively. The PAL activities of both cultivars were lower compared to control at any other time. For both cultivars, SOD, POD and PPO activities increased compared to control in the earlier days, but were lower compared to control during the later time period. The types of POD and PPO isozymes in the resistant cultivar ‘Yueyan 97’ were higher than those in the susceptible cultivar ‘Changbohuang’. The width and color of isozyme bands of Yueyan 97 were enhanced at 3 d after inoculation, while those of Changbohuang were not enhanced. It suggested that the resistant cultivar could quickly respond to external stimuli and accelerate the formation of defense-related substances. Detection of metabolites showed that the relative contents of some substances in Yueyan 97 such as myo-inositol, nicotine, malic acid, and L-threonine were higher compared to control, but in Changbohuang were lower compared to control, suggesting that cultivar differences in resistance against R. solanacearum might be related to these substances.【Conclusion】 These four defensive enzyme activities and the contents of the above metabolites could be used as biochemical indexes for evaluating tobacco resistance against R. solanacearum.
Key words:tobacco; Ralstonia solanacearum; defensive enzyme; enzyme activity; isozyme;metabolite
中图分类号:S432.42
文献标志码:A
文章编号:1001- 411X(2016)03- 0073- 09
基金项目:广东省烟草专卖局(公司)科技项目(粤烟[2009]17号)
作者简介:周星洋(1989—),男,硕士研究生, E-mail: 569056710@qq.com;通信作者:万树青(1953—),男,教授,博士,E-mail: wanshuqing@scau.edu.cn
收稿日期:2015- 09- 24优先出版时间:2016-04-15
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20160415.1555.026.html
周星洋, 张功营, 董丽红,等.青枯菌侵染不同抗病烟草品种的防御性酶活性及代谢组分差异分析[J].华南农业大学学报,2016,37(3):73- 81.
