黄芩苷对肝脏缺血再灌注损伤大鼠诱生型一氧化氮合酶、核转录因子和Caspase—3表达的影响
2016-05-30章宝燕林拥华林志强张国伟陈婷婷
章宝燕 林拥华 林志强 张国伟 陈婷婷


摘要:目的 观察黄芩苷对肝脏缺血再灌注损伤大鼠肝组织形态、肝细胞凋亡、诱生型一氧化氮合酶(iNOS)和核因子(NF)-κB mRNA表达及Caspase-3蛋白表达的影响,探讨其作用机制。方法 采用Pringle's法建立大鼠肝脏缺血再灌注模型。实验大鼠随机分为假手术组、模型组、黄芩苷组,假手术组、模型组给予生理盐水灌胃,黄芩苷组给予黄芩苷灌胃。观察大鼠肝脏组织病理形态,TUNEL法检测肝细胞凋亡指数,RT-PCR检测肝组织iNOS、NF-κB mRNA表达,Western blot检测Caspase-3蛋白表达。结果 与假手术组比较,模型组iNOS和NF-κB mRNA表达、Caspase-3蛋白表达水平及肝细胞凋亡指数升高(P<0.05,P<0.01);与模型组比较,黄芩苷组iNOS和NF-κB mRNA表达、Caspase-3蛋白表达水平及肝细胞凋亡指数下降(P<0.05),肝损害明显改善。结论 黄芩苷通过下调肝组织iNOS和NF-κB的表达、抑制Caspase-3介导的细胞凋亡,对缺血再灌注损伤大鼠肝脏发挥保护作用。
关键词:黄芩苷;保肝作用;缺血再灌注损伤;诱生型一氧化氮合酶;核因子-κB;Caspase-3蛋白;大鼠
DOI:10.3969/j.issn.1005-5304.2016.06.016
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)06-0060-04
Abstract: Objective To observe the effects of baicalin on forms of hepatic tissue, liver apoptosis, mRNA expressions of iNOS, NF-κB and protein expression of Caspase-3 in rats with ischemia reperfusion injury; To discuss its mechanism of action. Methods The rat models of liver ischemia reperfusion were performed according to the Pringle's method. Rats were randomly divided into sham-operation group, model group and baicalin group. Sham-operation group and model group were given normal saline for gavage, while baicalin group was given baicalin for gavage. Morphological characteristic was observed by HE staining. Hepatocyte apoptosis was determined by TUNEL. The mRNA expressions of iNOS and NF-κB were determined by RT-PCR. The protein expression of Caspase-3 was determined by Western blot. Results Compared with the sham-operation group, mRNA expressions of iNOS and NF-κB and the protein expression of Caspase-3 in the model group increased, as well as liver apoptosis rate (P<0.05, P<0.01); compared with the model group, mRNA expressions of iNOS and NF-κB and the protein expression of Caspase-3 in the baicalin group decreased, as well as liver apoptosis rate (P<0.05), and the hepatic lesion significantly improved in the baicalin group. Conclusion Baicalin can restrain Caspase-3 induced apoptosis by reducing the expressions of iNOS and NF-κB, with a purpose to realize the hepatoprotective effect for liver of rats with ischemia reperfusion injury.
Key words: baicalin; hepatoprotective effect; ischemia reperfusion injury; iNOS; NF-κB; Caspase-3 protein; rats
肝脏缺血再灌注损伤(ischemia-reperfusion injury,IRI)临床常见,可引起严重的肝脏和临近器官衰竭。IRI后体内活性氧(ROS)增加,刺激肝脏枯否细胞合成核因子(NF)-κB,激发促炎因子“级联反应”,引起肝细胞损伤。凋亡也是IRI引起细胞损伤的重要原因之一,其主要机制与Caspase-3介导的线粒体信号转导途径的抑制有关。研究表明,一氧化氮(NO)在IRI过程具有重要作用,其合成受酶的影响,由诱生型一氧化氮合酶(iNOS)催化产生的NO在IRI过程中发挥细胞损伤作用[1]。黄芩的主要有效成分黄芩苷具有抗炎、抗菌作用。本实验建立大鼠肝脏IRI模型,观察黄芩苷对肝脏IRI大鼠肝组织形态、肝细胞凋亡、iNOS及NF-κB mRNA表达、Caspase-3蛋白表达的影响,探讨其作用机制。
1 实验材料
1.1 动物
清洁级雄性SD大鼠60只,体质量200~250 g,中国科学院上海实验动物中心,合格证号SCXK(沪)2012-0001。饲养于明暗交替12 h/12 h清洁环境,自由饮食饮水。
1.2 药物
黄芩苷,Sigma公司,纯度>95%,批号21967-41-9。
1.3 主要试剂与仪器
总RNA抽提试剂盒、反转录试剂盒(Invitrogen,美国),dNTPs、Taq DNA聚合酶和一步法TUNEL试剂盒(美国Promega公司),兔抗大鼠Caspase-3多克隆抗体、辣根过氧化物酶标志羊抗兔多克隆抗体、GAPDH(Santa Cruz公司),总蛋白抽提试剂盒(南京凯基生物技术公司)。光学显微镜(日本OLYMPUS公司),石蜡切片机(美国Beckman),基因扩增仪(BIO-RAD Myeyeler),台式低温高速离心机(Heraeus instrnnlents,德国),稳压稳流定时电泳仪、水平电泳槽、紫外分光光度计(BIO-RAD,美国),蛋白核酸分析仪(Beckman,德国)。
2 实验方法
2.1 造模
采用Pringle's法建立肝脏缺血再灌注模型[2]。大鼠禁食12 h,自由饮水,并预先经大鼠尾静脉注射0.5%肝素生理盐水(2 mg/kg)行肝素化,术前用10%水合氯醛(300 mg/kg)麻醉,常规消毒术野,上腹部剑突下切口切开进腹,游离肝脏,分离门静脉、肝动脉和胆总管,使用无损伤血管夹阻断肝左、中叶的血流,直至肝叶变白,阻断30 min,恢复血流为再灌注;假手术组打开腹腔、游离肝脏后即关腹。
2.2 分组及给药
实验大鼠随机分为假手术组、模型组、黄芩苷组,各组均于术前30 min经大鼠尾静脉给药。假手术组、模型组给予生理盐水2 mL灌胃,黄芩苷组给予黄芩苷溶液200 mg/kg灌胃。各组均于再灌注后6 h留取肝组织标本。麻醉状态下打开大鼠腹腔,留取大小约1 cm×1 cm×1 cm肝中叶组织2块,一块快速置于10%中性甲醛中固定24 h保存备用;另一块修剪成大小约0.5 cm×0.5 cm×0.5 cm肝组织3块,标记后迅速放入液氮罐中,置于-80 ℃冰箱保存备用。
2.3 肝组织病理观察
取出中性甲醛固定肝组织块,石蜡包埋,切片,HE染色,镜下观察肝组织形态。
2.4 肝细胞凋亡检测
TUNEL法检测肝脏凋亡细胞,按照试剂盒说明进行操作。镜下观察凋亡细胞,细胞核呈棕黄色为阳性细胞。每张切片随机选取5个高倍镜视野观察,计算细胞凋亡指数(AI)。AI(%)=凋亡细胞数÷总细胞数×100%。
2.5 RT-PCR检测肝组织一氧化氮合酶、核因子-κB mRNA表达
采取Trizol一步法,按照试剂盒说明制备总RNA,经琼脂糖凝胶电泳、紫外分光光度仪鉴定后,将总RNA依据反转录试剂盒说明反转录成cDNA。引物序列见表1。iNOS反应条件:94 ℃变性15 s、60 ℃退火30 s、72 ℃延伸40 s,共35个循环;NF-κB反应条件:94 ℃变性15 s、60℃退火35 s、72 ℃延伸40 s,共35个循环。分别取8 ?L Marker、产物于2%琼脂糖凝胶膜上电泳30 min,置于凝胶成像分析仪中,于254 nm处紫外灯下照相,分析电泳图中条带灰度得出数据,计算每个标本iNOS、NF-κB、β-actin的灰度比值,对其mRNA表达水平进行半定量分析。
2.6 Western-bolt检测肝组织Caspase-3蛋白表达
按照试剂盒说明书提取各组总蛋白,BCA试剂盒测定各组蛋白浓度。根据浓度上样进行SDS-PAGE电泳后,转膜到PVDF膜上,含5%脱脂奶粉TBST液常温封闭1 h后,分别加一抗(Caspase-3,1∶1000)4 ℃孵育过夜,次日TBST漂洗后,加二抗(1∶2000)常温孵育1 h,再TBST漂洗,ECL化学发光液孵育后曝光。应用Quantity One软件进行灰度扫描分析,结果以Caspase-3/GAPDH比值表示。
3 统计学方法
采用SPSS11.0统计软件进行分析。实验数据以—x±s表示,组间比较采用方差分析,方差不齐者用秩和检验,组间两两比较采用Bonferroni检验。P<0.05表示差异有统计学意义。
4 结果
4.1 肝组织病理观察结果
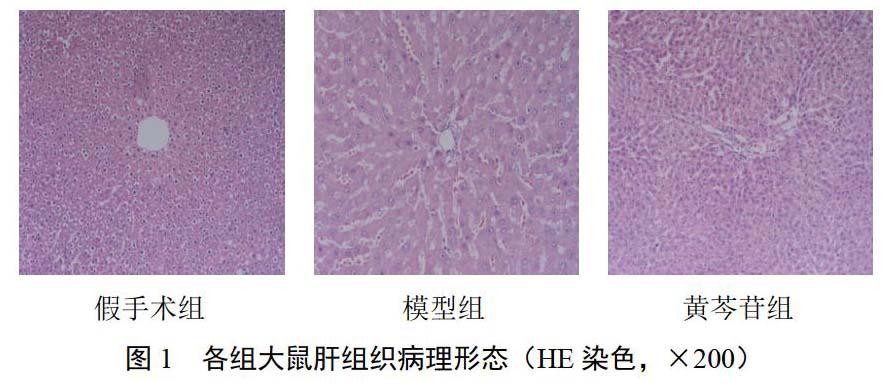
假手术组肝小叶结构完整,界板排列整齐,汇管区无增宽、破坏,未见肝细胞变性及炎细胞浸润;模型组肝小叶结构紊乱,肝血窦瘀血明显,肝窦狭窄,肝索排列严重不规则,中央静脉周围肝细胞肿胀及空泡样变性、有明显点状坏死,肝窦内大量炎性细胞聚集、浸润;黄芩苷组肝小叶结构破坏和肝血窦瘀血程度较模型组轻,肝小叶结构基本正常,细胞变性不明显,炎性细胞浸润较少,肝细胞轻度肿胀,未见明显肝细胞坏死。结果见图1。
4.2 黄芩苷对模型大鼠肝细胞凋亡的影响
假手术组肝实质几乎未见凋亡肝细胞;模型组肝实质内凋亡细胞明显增多,主要集中于中央静脉周围,汇管区亦可见凋亡细胞;黄芩苷组肝实质凋亡细胞数量明显减少,见图2。模型组和黄芩苷组肝细胞AI均较假手术组明显升高(P<0.01),见表1。
4.3 黄芩苷对模型大鼠肝组织一氧化氮合酶、核因子-κB mRNA表达的影响
与假手术组比较,模型组iNOS、NF-κB mRNA水平明显升高(P<0.05);与模型组比较,黄芩苷组iNOS、NF-κB mRNA表达水平明显降低(P<0.05)。结果见图3。
4.4 黄芩苷对模型大鼠Caspase-3蛋白表达的影响
与假手术组比较,模型组Caspase-3蛋白表达水平明显升高(P<0.05);与模型组比较,黄芩苷组Caspase-3蛋白表达水平明显降低(P<0.05)。结果见图4。
5 讨论
研究表明,黄芩及其有效成分对心肌、脑组织及肝脏IRI具有保护作用[3-5],其有效成分包括3种黄酮类化合物即汉黄芩素、黄芩素元和黄芩苷[6]。黄芩苷预处理的时机及浓度文献报道不一。根据文献报道及其药代动力学资料,我们选择造模前30 min进行预处理[7]。结果显示,黄芩苷干预后大鼠受损肝脏病理学表现明显改善。
肝脏IRI发生发展过程中伴随着显著的炎症反应,缺血后局部产生大量细胞因子、黏附分子、代谢产物、补体等。研究显示,下调iNOS的表达可减少其产物NO的生产,在肝脏IRI过程中发挥保护作用。NOS是NO的合成限速酶,是调节NO合成的重要因素,由iNOS催化产生的NO在IRI过程中发挥细胞损伤作用。研究显示,黄芩苷可在iNOS激活的后期阶段发挥抑制作用,抑制NO的过量生产[10],提示黄芩苷可能是iNOS合成的潜在抑制因子。本实验结果显示,黄芩苷干预后,大鼠IRI肝脏组织中性细胞浸润减少,iNOS、NF-κB基因表达水平降低。有研究表明,NF-κB是许多编码促炎症介质的炎症相关基因转录过程中的关键调节因子,黄芩苷可抑制NF-κB的激活[8]。
缺血性细胞死亡主要有2个途径——细胞坏死和细胞凋亡,其中凋亡被认为在IRI的发展结局中具有重要的作用。本研究应用TUNEL法检测发现,大鼠IRI 6 h后,肝细胞凋亡达到高峰期,凋亡肝细胞主要集中于肝小叶中央区,表现为核染色质和细胞质凝固、细胞核和细胞膜扭曲。黄芩苷干预后,末端标记阳性肝细胞数量明显减少,提示黄芩苷可能通过抑制细胞凋亡限制肝细胞的延迟性死亡。Caspase-3是Caspase依赖细胞凋亡信号通路诱导细胞凋亡过程中的最终效应器。而且,有研究表明,Caspase-3在大鼠冷IRI的肝脏中表达、激活和降解[10]。本研究结果显示,黄芩苷可显著抑制Caspase-3在IRI 6 h后大鼠肝脏中的表达水平。
总之,黄芩苷在大鼠肝脏经历IRI后发挥保护作用,其抗炎和抗凋亡作用可能与下调受损肝脏组织iNOS、NF-κB、Caspase-3的表达有关。
参考文献:
[1] TROCHA M, MERWID-LAD A, SZUBA A, et al. Effect of simvastatin on nitric oxide synthases (eNOS, iNOS) and arginine and its derivatives (ADMA, SDMA) in ischemia/reperfusion injury in rat liver[J]. Pharmacol Rep,2010,62(2):343-351.
[2] MATSUMATA T, KANEMATSU T, SHIRABE K, et al. Modified technique of Pringle's maneuver in resection of the liver[J]. Surg Gynecol Obstet,1991,172(3):245-246.
[3] KIM S J, MOON Y J, LEE S M. Protective effects of baicalin against ischemia/reperfusion injury in rat liver[J]. J NAT PROD,2010, 73(12):2003-2008.
[4] ZHANG Y, WANG X, XU Z, et al. Protective effect of flavonoids from Scutellaria baicalensis Georgi on cerebral ischemia injury[J]. J Ethnopharmacol,2006,108(3):355-360.
[5] CHAN E, LIU X X, GUO D J, et al. Extract of scutellaria baicalensis georgi root exerts protection against myocardial ischemia-reperfusion injury in rats[J]. Am J Chin Med,2011,39(4):693-704.
[6] GAO Z, HUANG K, YANG X, et al. Free radical scavenging and antioxidant activities of flavonoids extracted from the radix of Scutellaria baicalensis Georgi[J]. Biochim Biophys Acta,1999, 1472(3):643-650.
[7] WOZNIAK D, DRYS A, MATKOWSKI A. Antiradical and antioxidant activity of flavones from Scutellariae baicalensis radix[J]. Nat Prod Res,2014,29(16):1-4.
[8] CHOU T C, CHANG L P, LI C Y, et al. The antiinflammatory and analgesic effects of baicalin in carrageenan-evoked thermal hyperalgesia[J]. Anesth Analg,2003,97(6):1724-1729.
[9] KIM D H, KIM H K, PARK S, et al. Short-term feeding of baicalin inhibits age-associated NF-kappaB activation[J]. Mech Ageing Dev,2006,127(9):719-725.
[10] RENTSCH M, BEHAM A, IESALNIEKS I, et al. Impact of prolonged cold ischemia and reperfusion on apoptosis, activation of caspase 3, and expression of bax after liver transplantation in the rat[J]. Transplant Proc,2001,33(1/2):850-851.
(收稿日期:2015-08-03)
(修回日期:2015-09-08;编辑:华强)
