柑橘脚腐病菌的鉴定及柑橘种质的抗性测定
2016-05-30闫化学姜波钟云
闫化学 姜波 钟云

摘 要 从具有典型柑橘脚腐病症的组织中分离出疫霉菌和镰刀菌菌株。致病性测定结果显示,接种疫霉菌1周后,离体柑橘叶片出现变褐腐烂症状,一年生实生苗的接菌部位出现茎腐、流胶等脚腐病症状,确证了该菌株的致病性。通过对菌的形态特征,培养形状和内转录间隔区ITS及延长因子TEF-1α序列进行分析,确认该菌为烟草疫霉菌(Phytophthora nicotianae)。依据枝条接菌结果,枳和枳橙对烟草疫霉菌有高的耐性。
关键词 柑橘脚腐病 ;病原鉴定 ;烟草疫霉菌 ;抗性测定
分类号 S666 ;S436.66 Doi:10.12008/j.issn.1009-2196.2016.01.007
Abstract Citrus foot rot or root rot, caused by Phytopathora spp., is known as a destructive disease worldwide, resulting in seedling death and loss of fruit production. Phytophthora spp. and Fusarium spp. strains were isolated from citrus trunks with typical symptom of foot rot. The suspected pathogens were identified based on their morphological, cultural and molecular profiles. The partial sequences of internal transcribed spacer (ITS) and translation elongation factor 1 alpha gene (TEF-1α) of the pathogens were amplified by PCR and aligned in GenBank. The analysis result showed the isolated pathogen was Phytophthora nicotianae. The pathogenicity of the pathogen was confirmed by inoculating the representative isolate YMJ-03 on Citrus in vitro leaves and seedlings, which showed the symptom of leaves rot, stem rot and gummosis within a week after inoculation. P. trifoliate and Carrizo citrange (C. sinensis×P. trifoliata) showed high tolerance to P. nicotianae according to response of branches to inoculation with pathogens.
Keywords citrus foot rot ; pathogen identification ; Phytophthora nicotianae ; resistance evaluation
由疫霉菌(Phytophthora spp.)引发的柑橘脚(根)腐病在世界各柑橘产区广泛发生,能够在不同时期感染柑橘大部分器官[1]。柑橘幼苗受害时,发生立枯病,症状是根茎部及根系腐烂,该病能在苗圃中快速传染,并在短期内造成幼苗成片死亡;大树受害时,主干基部皮层和须根腐烂,发生根腐病、脚腐病以及主干枝条的流胶病等,轻则减产,重则引起树体枯萎和死亡[2];果实感染后,发生褐腐病引发落果,潜伏感染的果实在采后贮藏中易发生腐烂[3]。据统计,全球10%~30%的柑橘产量损失与疫霉菌直接相关[4]。疫霉菌在全球广泛分布,中国、美国、巴西、西班牙和印度等柑橘产区深受其害[1,5-9]。据报道,全球约有12种疫霉菌为害柑橘,其中柑橘褐腐疫霉菌(Phytophthora citrophthora (R.E. Sm. & E.H. Sm.) Leonian)和烟草疫霉菌(Phytophthora nicotianae Breda de Haan; P. parasitica Dastur)分布最广[10]。不同疫霉菌在不同柑橘产区的分布和密度与温度紧密相关[3,11],柑橘褐腐疫霉菌主要分布在地中海式气候区域,烟草疫霉菌则主要分布在亚热带气候区域。
在广东,特别是高温高湿的夏季,柑橘生产园和苗圃常遭受该病为害,引起幼苗发病,表现为茎腐、流胶、叶斑、枝梢枯及根腐等,苗圃的株发病率一般在15%~30%,个别高达50%~70%,甚至90%以上[5]。筛选或选育抗耐柑橘脚腐病品种和砧木是防治柑橘脚腐病的最佳手段[2,12-13]。已有研究表明,枳具有脚腐病抗性,采用其作砧木能够在一定程度上控制柑橘流胶和脚腐等症状[3,14-15]。而在实际生产中,枳砧也存在立枯病和脚腐病发生的问题。本研究采用常规组织分离法,成功分离出在热带亚热带地区为害严重的烟草疫霉菌(P. nicotianae),通过对培养性状和子实体形态、rDNA-ITS及延长因子TEF序列分析及致病性检测等几个方面对病原菌进行详细鉴定。
1 材料与方法
1.1 材料
1.1.1 样本采集
样本采集地为广东省农业科学院果树研究所资源圃和白云基地果园,用经2.5%次氯酸钠溶液浸泡过的刀片从病健结合处刮取具有典型脚腐病症状的皮层和木质部组织,置于干净的收集袋中,带回实验室进行分离培养。
1.1.2 疫霉菌的分离和培养
采集的样本立即进行组织分离。将样品用自来水冲洗,再用70%的乙醇浸泡5~10 s,在滤纸上晾干。把晾干后的样品切成2 mm × 2 mm大小的小块,置于改良的PARBPH筛选培养基(改良PARBPH培养基:在玉米培养基基础上添加10 μg/mL 匹马菌素,200 μg/mL 氨苄青霉素,10 μg/mL 利福平,25 μg/mL 五氯硝基苯,10 μg/mL 苯菌灵,50 μg/mL 恶霉灵) [16]。24℃暗培养2~3 d,并检查菌的生长情况,切取纯培养菌落的菌丝块,转移到马铃薯葡萄糖琼脂培养基(PDA)上保存,用于形态学鉴定。
1.2 方法
1.2.1 致病性测定
离体叶片接种参照周长河等[15]的方法。摘取成熟叶片,自来水清洗后,用75%的乙醇清洗其表面,最后用灭菌蒸馏水清洗除去酒精,用接种针在叶脉中间偏右位置刺一个伤口,切取带有新长出菌丝的培养基,大小为4 mm×4 mm,放置在伤口处,置于培养盒中观察叶片发病情况。培养盒中加适量灭菌蒸馏水,保持滤纸湿润,每隔12 h喷洒灭菌水1次,保持叶面湿润。
田间枝条接种参照Boava等[18]的方法。先用75%酒精擦洗接种部位,用无菌手术刀轻轻削开皮层,形成大小为2 mm×2 mm的切面,取培养1周的疫霉菌,菌丝面朝向伤口表面,用Parafilm薄膜缠绕固定,喷雾套袋保湿,一月后观察并记录接菌枝条发病情况。
1.2.2 疫霉菌的培养性状和子实体形态
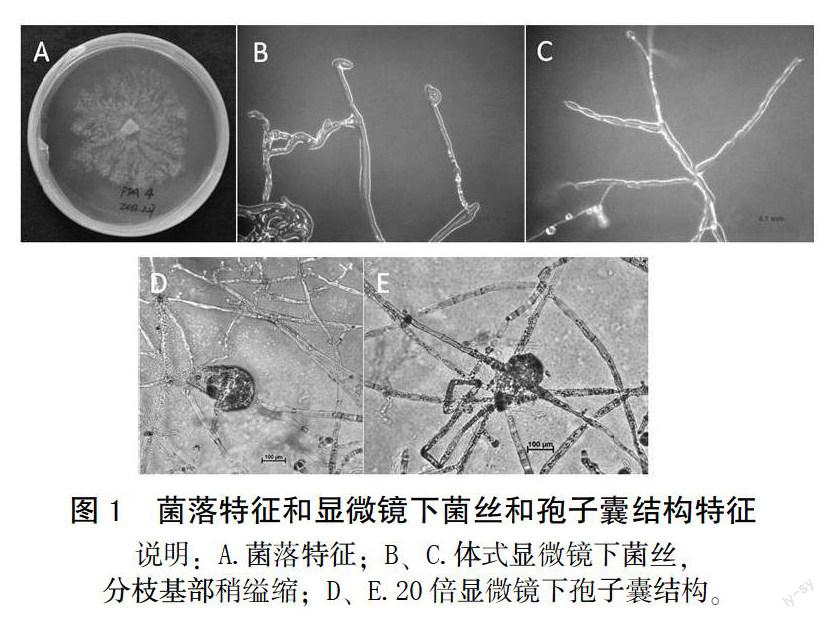
在培养1周的菌落边缘切取大小为4 mm × 4 mm的含菌丝培养基,移至新的固体PDA培养基平板中央,24℃暗培养4 d后开始观察记录菌落的形态。期间每24 h测量菌落直径1次,计算菌落的生长速度。在显微镜下观察培养基内菌丝和气生菌丝的形态,拍摄病菌的孢囊梗和孢子囊形态特征。根据观察及测量的数据与疫霉菌的菌落形态、孢囊梗和孢子囊形态特征进行比对,对分离得到的病原菌进行初步鉴定。
1.2.3 rDNA-ITS及延长因子TEF序列分析
利用Biospin真菌基因组DNA提取试剂盒提取疫霉菌基因组总DNA,用真菌核糖体rDNA 通用引物ITS4和ITS6,扩增18S rDNA和28S rDNA基因之间的2个转录间隔区以及其中的5.8S基因序列,引物序列为ITS4:5′-TCCTCCGCTTATTGATATGC-3′,ITS6:5′-GAAGGTGAAGTCGTAACAAGG-3′[17]。根据NCBI GenBank登陆号为EU080539.1的柑橘褐腐疫霉菌(Phytophthora citrophthora)EF序列翻译延长因子(Translation elongation factor 1 alpha gene, EF1α)序列设计引物,PcEF1F(5′-CGGGTACCTCGCAGGCCGAT-3′)和PcEF1R(5′-CAATCAAGCACCGGCGAGTA-3′),PCR扩增目标菌落EF1α基因片段,回收PCR产物并送到上海生工公司测序,使用contig软件拼接序列,并用Bioedit和clustalx1.83软件进行序列比对,分析扩增的序列与EU080539.1序列的同源性,并在NCBI上比对分析。
1.2.4 柑橘种质抗性测定
种质抗性评价的接菌方法参照1.3致病性测定。
离体叶片法的种质材料为枳(P. trifoliate)、卡里佐枳橙(Carrizo citrange, C. sinensis×P. trifoliata)、聂都野橘(C. reticulata ‘Niedu)、四川红橘(C. reticulata ‘Sichuan)、酸柚(C. grandis ‘Suanyou)和资阳香橙(C. junos ‘Ziyangxiangcheng)等,每次试验摘取叶片10~15片。
田间枝条接种的种质材料为枳(P. trifoliate)、卡里佐枳橙(Carrizo citrange, C. sinensis×P. trifoliata)、四川红橘(C. reticulata ‘Sichuan)、广西土柚(C. grandis ‘Guangxituyou)、瑶山柠檬(C. limon ‘Yaoshan)等。
2 结果与分析
从广东省农科院果树研究所资源圃和白云基地果园共取10个样本用于分离病原菌,均分离获得菌落特征一致的培养物,菌丝白色无隔膜,结构相似,生长速率一致,以下对具有代表性的YMJ-03菌株进行描述。
2.1 致病性测定结果
离体叶片接种YMJ-03后,24~28℃气温下,叶片3 d后发病,呈水渍状,变褐,1周后叶片开始呈黑褐色。接种1月后枝条表现出全部疫霉病症,部分枝条出现流胶现象,揭开接菌部位皮层,木质部出现褐色,且伴有明显的水渍状,说明分离的YMJ-03具有较强的致病力。
2.2 疫霉菌的形态学特征
YMJ-03在28℃暗培养7 d,平均生长速率为6.3 mm/d,菌落呈花瓣放射状,白色,不整齐,紧贴培养基生长,培养基内菌丝生长较致密(图1A),菌丝直径平均为7.92 μm,气生菌丝稀疏,直径小于培养基内菌丝,平均为4.97 μm。在蔡司体式显微镜下观察菌丝无隔膜,粗细较均匀,菌丝顶端膨大,分枝基部稍缢缩(图1B,1C)。孢囊梗分化不明显,分枝不规则。在显微镜下观察到典型的疫霉菌孢子囊结构(图1D,1E)。这些形态学特征与烟草疫霉菌(P. nicitianae)特征一致。
2.3 序列分析
对引物ITS4/ITS6和PcEF1F/ PcEF1R PCR扩增产物进行测序并分析,分别获得约780和640 bp的序列,条带单一清晰,满足回收测序要求(图2)。测序获得的序列在GenBank数据库中进行BLAST搜索比对,结果显示,扩增的序列ITS和EF1α基因序列与NCBI网站的烟草疫霉菌的ITS和TEF1α基因序列一致,可以鉴定YMJ-03菌株是烟草疫霉菌(Phytophthora nicotianae)。
2.4 柑橘种质抗性测定
2.4.1 离体叶片接种
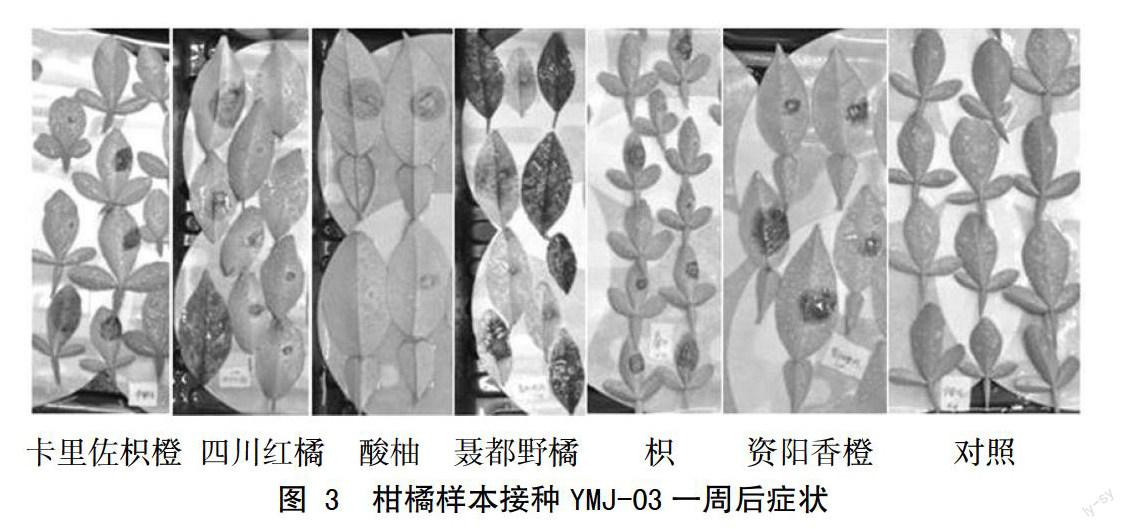
以枳、卡里佐枳橙、聂都野橘、四川红橘、重庆酸柚和资阳香橙为研究对象,分别摘取10~15片成熟叶片,接种1周后统计叶片发病率。在接种3 d后,部分叶片的接菌部位开始出现水渍状坏死斑,接着转变为褐色,叶片开始腐烂,1周后叶片的发病率都达到了100%,只接PDA培养基的卡里佐叶片不出现病症(图3),根据发病顺序和病斑面积分析,枳对疫霉菌有较高的耐性。
2.4.2 田间枝条接种
从图4可知,卡里佐枳橙、四川红橘、广西土柚、枳、瑶山柠檬在接种YMJ-03菌株1月后,接菌枝条出现典型的柑橘脚腐病症,接菌部位木质部出现褐色,且伴有明显水渍状,广西土柚的部分枝条出现流胶现象。同离体叶片接菌结果一致,枳对烟草疫霉菌表现出较高的耐性。
3 结论与讨论
在广东,柑橘生产园、资源圃和苗圃中都存在不同程度的发病现象,特别是每年的4~10月,苗圃发病严重,疫霉菌诱发的立枯病致使幼苗成片死亡,这可能与广东高温高湿的气候适于疫霉菌繁殖和传播有关。本研究收集的10份具有典型脚腐病症状的柑橘皮层和木质部中,只分离出了烟草疫霉菌,说明烟草疫霉菌是采样果园柑橘脚腐病的主要病原菌。且有文献报道烟草疫霉菌在广东非常流行[5]。烟草疫霉菌和柑橘褐腐疫霉菌是柑橘脚(根)腐病最主要的病原菌,而烟草疫霉菌的适宜生长温度(9~36℃)和最适温度(31℃)要高于柑橘褐腐疫霉菌的适宜生长温度(7~31℃)和最适温度(26℃)[19]。随着气温升高,柑橘苗圃中烟草疫霉菌的数量和分布明显高于柑橘褐腐疫霉菌[7]。
另外,本试验在6份样品中分离出了镰刀菌(Fusarium spp.),这同朱丽等[20]鉴定金橘脚腐病病原菌的结果相似,部分发生脚腐病的金橘中也能够分离出镰刀菌。本接种试验显示,单独接种镰刀菌(Fusarium spp.)不会导致柑橘发生叶片腐烂、枝条变褐的现象。
筛选或选育抗耐病柑橘品种和砧木是防治柑橘脚腐病的最佳手段[2,12-13],还可以避免因过量使用农药而引起的农药残留和环境污染等问题。本研究从具有典型脚腐病症的柑橘皮层和木质部分离得到烟草疫霉菌,回接柑橘离体叶片和枝条,离体叶片在1周之内变褐腐烂,引起枝条流胶、变褐,确证该菌株的致病性,并进一步分析了不同柑橘种质对烟草疫霉菌的抗性。枳作为疫霉菌病害的耐病资源,已经在生产中广泛应用,但是枳砧仍然普遍发生脚腐病和幼苗立枯病等。我国柑橘资源丰富,拥有大量的野生和半野生资源,其中就可能存在抗脚腐病的资源,可为抗病育种工作提供抗性基因,为研发出抗/耐脚腐病品种提供可能。
参考文献
[1] Meitz-Hopkins J C, Pretorius M C, Spies C F J, et al. Phytophthora species distribution in South African citrus production regions[J]. Eur. J. Plant Pathol. 2014, 138(4): 733-749.
[2] Duarte. Soilborne diseases of tropical crops.[J]. Plant Pathology, 1997, 48(5): 677-677.
[3] Timmer L W, Duncan L W. Citrus health management[J]. Citrus Health Management, 1999.
[4] Pathology P. American Phytopathological Society[J]. Nature, 1958, 181(3):112.
[5] 成家壮,韦小燕,范怀忠. 广东柑橘疫霉研究[J]. 华南农业大学学报(自然科学版),2004,25(2):31-33.
[6] Alvarez L A, León M, Abad-Campos P, et al. Genetic variation and host specificity of Phytophthora citrophthora isolates causing branch cankers in Clementine trees in Spain[J]. European Journal of Plant Pathology, 2011, 129(1): 103-117.
[7] Ahmed Y, D'Onghia A M, Ippolito A, et al. Phytophthora nicotianae is the predominant Phytophthora species in citrus nurseries in Egypt[J]. Phytopathologia Mediterranea, 2013, 51(3): 519-527.
[8] Das A K., Bawage S S, Nerkar S G, and Kumar A. Detection of Phytophthora nicotianae in water used for irrigating citrus trees by Ypt1 gene based nested PCR[J]. Indian Phytopath. 2013, 66 (2): 132-134.
[9] Graham J H, Timmer L W, Dewdney M M. 2015 Florida citrus pest management guide: Phytophthora foot rot and root rot.http://www.crec.ifas.ufl.edu/extension/pest/PDF/2015/Phytoph -thora.pdf.
[10] Erwin D C, Ribeiro O K. Phytophthora Diseases Worldwide[M]. APS Press, St. Paul, MN, USA.1996.
[11] Alvarez L A, Gramaje D, Abad-Campos P, et al. Seasonal susceptibility of citrus scions to Phytophthora citrophthora and P. nicotianae and the influence of environmental and host-linked factors on infection development[J]. European journal of plant pathology, 2009, 124(4): 621-635.
[12] Furr J R, Carpenter J B. Program for breeding citrus rootstocks tolerant to Phytophthora root rot[J]. In Proceedings of Florida Station Horticultural Society. 1961, 18: 18-23.
[13] Alvarez L A, Vicent A, De la Roca E, et al. Branch cankers on citrus trees in Spain caused by Phytophthora citrophthora[J]. Plant Pathol. 2008, 57(1): 84-91.
[14] 朱伟生,兰晓瑜,陈 荟,等. 柑橘脚腐病研究[J]. 植物病理学报,1993,23(2):151-155.
[15] 周长河,邓秀新,柑橘体细胞杂种对柑橘脚腐病的抗病性研究[J]. 植物病理学报,1997,27(4):361-364.
[16] Jeffers S N, Martin S B, Comparison of two media selective for Phytophthora and Pythium species[J]. Plant Disease, 1986, 70(11): 1 038–1 043.
[17] Cooke D E L, Duncan J M. Phylogenetic analysis of Phytophthora species based on ITS1 and ITS2 sequences of the ribosomal RNA gene repeat[J]. Mycol Res. 1997, 101(2): 667-677.
[18] Boava L P, Cristofani-Yaly M, Mafra V S, et al. Global gene expression of Poncirus trifoliata, Citrus sunki and their hybrids under infection of Phytophthora parasitica[J]. BMC genomics. 2011, 12(1): 39.
[19] Fawcett H S. Citrus Diseases and their Control[M]. McGraw-Hill book company, New York. NY, USA.1936.
[20] 朱 丽,赵小龙,吴礽超,等. 金橘脚腐病病原菌鉴定[J]. 植物病理学报,2011,41(6):631-634.
