氧化还原原理在电化学中的应用
2016-05-30王章宁
王章宁
摘要:电化学基础在高中阶段是一个知识难点,利用氧化还原原理来进行电化学的教学,有利于学生对该部分知识的理解,反过来又巩固和提高了氧化还原反应知识,更主要是训练了学生的思维,掌握了学习方法。通过研究和实践探索,取得了较好的效果。证明采用氧化还原原理的分析方法是可行的、策略是有效的、措施是可控的、效果是显著的。
关键词:氧化还原;电化学基础;电化学应用
氧化还原原理不仅仅是一个独立的知识点,更是一种工具,是贯穿整个高中化学知识体系的基本原理。体现在众多的知识和题目解释中,例如元素化合物的性质、化学工业流程、化学实验探究、电化学应用等,都会用到氧化还原原理。氧化还原的本质就是电子的转移,原电池的形成原理就是自发的氧化还原反应,在教学过程中,将两者有效的结合起来,能让学生更好的理解电化学,更好的应用电化学的知识和电化学在生活中的应用,并能巩固和提高氧化还原反应知识。
一、问题研究的背景
氧化还原反应在高一(人教版高中必修①)的课本中就已经进行过学习,电化学的基础在高一(人教版高中必修②)的课本开始学习。高一必修②只是简单介绍了电化学,详细的介绍是在高二(人教版高中必修④第四章)学习。很多老师在电化学的教学过程中,简单的提及原电池和电解池与氧化还原反应相关,然后就进行原电池和电解池的教学,导致学生没有从根本上理解电化学的来源和意义。从高一必修②中的Zn-Cu(H2SO4溶液)原电池、锌锰干电池、铅蓄充电电池、燃料电池,到高二选修④中的双液电池、化学电源、电解池,有很多不同的电池需要了解和掌握。如果分散的进行知识学习,让学生机械的记忆各种电池和其中的反应,会给学生造成很大的负担,也不利于学生对知识的掌握。尤其是选修④的教学中和高三的电化学复习过程中,必须要注意知识的联系和衔接②。独立的知识学习不利于学生对知识网络的建立,以致电化学成为学生望而生畏的一个知识点。
无论是原电池还是电解池,均与氧化还原反应直接相关,如果能将氧化反应原理贯穿于电化学的教学过程和复习过程中,就能形成一个完整的知识体系,同时很大程度的减轻学生需要记忆的压力。
二、问题研究的基本理论
1、美国当代著名教育心理学家布鲁纳在他的《教育过程》中明确提出了学科结构论的教学论思想,指出:“不论我们选教什么学科,务必使学生理解该学科的基本结构”,“学习结构就是学习事物间怎样相互联系的”。按照“认知结构组织起来的材料就是最有希望在记忆中‘自由出入的材料” ①。
2、新课程的“三维目标”,包括“知识与技能”、“过程与方法”、“情感态度与价值观”三方面。要求培养学生“获取、收集、处理、运用信息的能力、创新精神和实践能力”。
三、问题研究的方法
1、在几个情况和基础差不多的班级(高三),采用两种不同的教学方法进行电化学复习,观察其效果。其中一种是独立的复习各种原电池、电解池,另一种是利用氧化还原原理复习原电池和电解池。
2、在几个情况和基础差不多的班级(高二),采用两种不同的教学方法进行电化学教学,观察其效果。其中一种是独立的进行各种原电池、电解池教学,另一种是利用氧化还原原理进行原电池和电解池教学。
3、广泛交流,与同事讨论电化学部分教学的方法、心得,分享教学过程中遇见的各种问题。
四、问题研究的案例
1、原电池的原理来源于氧化还原原理。氧化还原反应的本质是有电子的转移,而判断一个反应是否属于氧化还原反应的方法则是看是否有化合价的变化。学生在高一的学习过程中已经掌握了这个知识,同时也明白了氧化还原反应的内涵。较早学习的氧化还原反应是置换反应,如锌与稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑,其对应的离子方程式为Zn + 2H+ = Zn2+ +H2↑。从氧化还原反应的角度分析:
因为Zn直接与稀硫酸中的H+进行了进行了电子转移,电能没有得到应用。而原电池的思维正是利用了氧化还原过程中发生的电子转移,所以也要求原电池的形成原理就是自发的氧化还原反应。将氧化反应与还原反应分开来,并将电子的“得”和“失”通过导线进行连接,形成了电流,其装置就是原电池。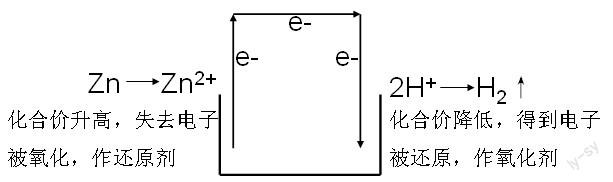
結合物理的知识,失去电子的是负极,得到电子的是正极。负极反应物为锌,直接参与反应并溶解。正极反应物为H+,正极材料不需要直接反应,只需要是比Zn不活泼的导体就行了。如果正极用铜,就是必修②课本上都介绍到的Zn-Cu(H2SO4溶液)原电池。为此还可以引导学生去分析:如果另一个电极是比Zn更加活泼的金属会有什么结果?其结论只不过是另一个氧化还原反应而已。
为了使氧化反应与还原反应更加彻底的分开,于是就形成了双液电池。我们将以上的反应进行设计成双液电池,如下图:
因此,理论上只要有自发的氧化还原反应,就可以设计成原电池。在这过程中,始终强调的是氧化还原反应原理,即将氧化反应与还原反应分开,分别作为电池的负极和正极,从而实现了化学能向电能的转化。
2、电极的判断与电子的转移、电解质离子的移动。根据原电池的原理与氧化还原原理的关系,原电池和化学电源对应的各种问题就迎刃而解了。首先进行氧化还原分析,再根据氧化还原方法进行电池分析。
例1:已知碱性锌锰电池:Zn+2MnO2+2H2O = 2MnOOH+Zn(OH)2,根据氧化还原分析:

由此可知,Zn是负极,MnO2是正极,电子由Zn极经过导线流向MnO2极。
例2:甲烷燃料电池(酸性环境):CH4+2O2→CO2+2H2O,根据氧化还原分析:
例3:钢铁吸氧腐蚀:2Fe+O2+2H2O=2Fe(OH)2,根据氧化还原分析:
由此可知,Fe是負极,O2是正极,电子由Fe电极经过导线流向O2所在电极碳。
例4:铅蓄电池:Pb+PbO2+2H2SO4 = 2PbSO4+2H2O,根据氧化还原分析:
由此可知,Pb是负极,PbO2是正极,电子由Pb电极经过导线流向PbO2电极。
归纳以上例子,只要依据氧化还原反应,就能很简单的判断出电池的电极和电子的流动方向及电流方向。
电子的移动只存在导线中,根据物理的知识,电流的形成需要有一个回路,因此在电解质或电解质溶液中,由离子导电。根据回路的方向特点,阴离子带负电,应该与电子同一个方向,即同一个回路。而阳离子带正电,则与电流属于同一个回路方向。具体理解如下图所示:
这个方法不仅适用于一般的原电池,同样可以分析双液电池和电解池中的离子移动方向,如下图所示: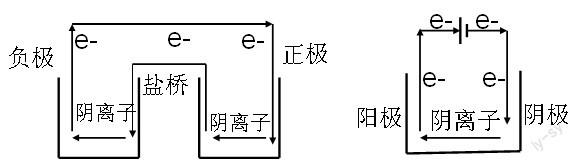
因此,在分析离子移动方向的时候,不再是死记口诀,而是结合电子转移来进行理解,使得氧化还原的分析得到进一步延伸和应用。
3、原电池电极方程式书写与氧化还原原理。原电池电极方程式的书写是电化学中最难的一个部分,为此也出现了很多不同的方法。如果能够结合氧化还原方程式的书写方法,便能更好的理解电极方程式的来源。氧化还原方程式的书写及其离子方程式书写一般有三个步骤,其中包括:判断反应物和生成物,电子得失守恒,电荷守恒和元素守恒。因为原电池是将氧化反应拆开了,因此步骤类似,但有所不同。应该包括:判断反应物和生成物,电子得或失,电荷守恒和元素守恒。无论是书写电极方程式,还是判断电极方程式的正确与错误,都应该遵守以上三个步骤。
例5:碱性锌锰电池:Zn+2MnO2+2H2O= 2MnOOH+Zn(OH)2,负极电极方程式的书写过程包括:
正极电极方程式的书写过程包括:
例6:碱性甲醇燃料电池:2CH3OH+3O2+4KOH = 2K2CO3+6H2O,负极电极方程式的书写过程包括: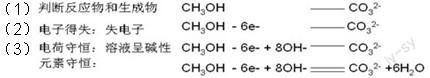
因此,遵循氧化还原反应方程式书写的过程,把氧化反应与还原反应分开来分析,便可以得到原电池的电极方程式。不再需要其它的方法和进行各种各样的记忆,可以减轻学生的知识负担,同时也让知识之间能融会贯通。
4、电解池与氧化还原原理。电解池是借助外电流发生的反应,由外界输入能量推动,因此电解池不属于自发的氧化还原反应③。电子从外电源负极经过导线流向电解池阴极,从电解池阳极经过导线流向外电源正极。因为同样存在电子的得失,所以同样是存在氧化反应和还原反应,只不过氧化反应和还原反应之间没有了联系,同时也不再将反应物称为氧化剂、还原剂。图示如下:
在阳极,容易失去电子的物质发生反应,可以是电极本身反应,也可以是电解质或电解质溶液中的离子(常见为阴离子)。于是根据还原性强弱,出现了离子放电顺序。在阴极,容易得到电子的物质发生氧化反应,同样可以是电极本身,也可以是电解质或电解质溶液中的离子(常见为阳离子)。根据离子氧化性的强弱来判断哪种离子先发生还原反应。
五、效果与反思
两种不同教学方法和教学过程取得了不同的效果,利用氧化还原原理进行电化学教学的方法所取得的效果明显要优越,其对比体现在以下三个方面:
1、学生评价。采用该方法使学生的思维能力、创新能力、实践能力都得到了较大的提高。很多高三的学生在复习都说:“一直以来感觉电化学是一个知识难点,看到题目就晕,学习运用氧化还原方法后,电化学题目就特别容易了”。“原来化学知识都是相互关联的,用一个知识解释另一个知识,我要尝试在其它的问题上也这样去探索”。很多高二学生也说:“原来电化学的知识可以如此简单的理解,原来电流的产生是这么简单的原理,太神奇了。”
2、教师评价。站在整个高中化学知识体系的高度上去理解和研究化学教学,让学生从“学会”转变为“会学”,掌握了知识的相互联系,培养了学生知识运用能力。体现了我校“博喻求真”的办学理念和“因材施教、自主发展”的教学理念。
3、高考成绩和竞赛成绩。在各种的测试中,学生能得到更高的分数,体现出对了对知识更好的掌握情况。采用该方法的班级高考成绩明显要好一些,因为学生学会的不仅仅是一个知识点,更是训练了一种分析问题的思维,提高了一种知识运用的能力。在高二年级参加的化学竞赛中,多名同学获得了省、市、区的一等奖。总体来看,利用氧化还原原理进行电化学教学的方法是切实可行的,效果是显著的。
但是,因为原理的分析上有些抽象,学生的分析问题速度开始会相对慢一些,从学会到灵活运用需要一个熟悉过程。经过仔细分析和探讨,笔者认为应该让学生自己学会画图,或者在已知的图像上进行标注,从而加强对陌生电池的认识和理解。因为只要结合氧化还原原理,电化学的问题都会迎刃而解。
参考文献
[1] 邵守灿.高中化学整体结构教学的构建百度文库,2012.3.
[2] 王磊.理解与实践高中化学新课程:与高中化学教师的对话[J].高等教育出版社,2007.7.
[3] 宋心琦.普通高中课程标准实验教科书 化学4选修[J].人民教育出版社,2008.6.
