利用SSR荧光标记毛细管电泳法检测蝴蝶兰组培突变体
2016-05-30肖文芳李佐陈和明吕复兵
肖文芳 李佐 陈和明 吕复兵


摘 要 以8份蝴蝶兰种质资源为材料,使用SSR标记进行蝴蝶兰种质资源和突变体的鉴定。从25对SSR荧光标记引物中筛选出10对扩增效果理想的SSR荧光标记引物,鉴定4个不同品种的蝴蝶兰及其相应的突变体。10对SSR引物中有9对引物在这8个种质中能扩增出多态性条带,共扩增出38个等位基因,利用其中3对引物SSR3+SSR8+SSR9的组合即可将4个品种及其突变体全部区分开,说明SSR荧光标记毛细管电泳法检测蝴蝶兰突变体高效可行。
关键词 蝴蝶兰;组培突变体;SSR
中图分类号 S682.31 文献标识码 A
Abstract In this research, four Phalaenopsis germplasms and their somaclonal mutants were used to identity mutants by fluorescent labeled simple sequence repeat(SSR)markers. Ten of 25 SSR primer pairs with good repeatability were selected,and then were labeled with fluorescent for amplification and capillary electrophoresis. Nine of 10 SSR primer pairs with high polymorphisms totally amplified 38 polymorphic alleles. SSR3, SSR8 and SSR9 could distinguish all of the samples. The present results provide valuable tools for the cultivar classification and somaclonal variation detection of Phalaenopsis.
Key Words Phalaenopsis; Somaclonal variation; SSR
doi 10.3969/j.issn.1000-2561.2016.10.015
微卫星(Microsatellite),也称为短串联重复序列(short tandem repeats, STRs)或简单重复序列(simple sequence repeats, SSRs),是指以几个核苷酸(2~5个)为重复单位组成的长达几十个核苷酸的重复序列。微卫星广泛分布于真核生物整个基因组的不同位置上,由于重复次数的不同及重复程度的不完全造成了每个位点的多态性。SSR具有信息含量高、呈共显性遗传,检测时DNA用量少、操作简便、多态性高、重复性好等特点,是分析种质资源遗传多样性,进行基因组作图的重要手段。传统的SSR检测方法采用聚丙烯酰胺凝胶电泳加放射显影或银染的方法,费时费力低效。目前广泛采用的毛细管电泳技术,其原理是利用ABI遗传分析仪对荧光标记的DNA片段进行检测,结合分子量内标进行DNA片段长度计算,使SSR分型变得高效快捷,重复性好,结果也更加精确。
SSR在兰科植物上的应用不多,主要集中在种质遗传多样性和亲缘关系的分析上[1-5]。
目前,国际植物新品种权保护联盟(UPOV)的BMT分子测试指南中将SSR和SNP确定为构建DNA指纹数据库的标准标记方法,由于SSR标记技术比较成熟,成为当前各个作物建库的首选标记(UPOV,2007),已成功用于构建水稻、油菜、棉花、甘蔗、花生、枣、梨、百合等经济作物的指纹图谱,其中大部分均采用毛细管电泳检测法[6-14]。而在突变体检测方面,目前主要使用的分子鉴定方法为RAPD[15-16]、AFLP[17]和SSR,其中利用SSR对水稻空间诱变系[18-19]、棉花的组培突变体[20]和大豆的突变体库[21]进行检测,都得到了较好的检测结果,但仍局限于传统的凝胶电泳检测法,未见结合更高效精确的毛细管电泳检测手段。蝴蝶兰作为重要的观赏作物,经济价值非常高,但相对其生产成本也高,生长周期较长,从组培苗到开花售卖约18个月。由于激素使用等原因,蝴蝶兰种苗在组培生产过程中存在一定的变异几率,而突变体并不符合商品生产的要求,会加大生产成本,不利于大规模商品化生产。所以高效的蝴蝶兰突变体检测技术非常必要。
本实验利用SSR荧光标记毛细管电泳法对已在形态学上观测到突变的蝴蝶兰突变体进行检测,探索SSR荧光标记毛细管电泳法在蝴蝶兰突变体检测上的可行性。
1 材料与方法
1.1 材料
1.1.1 蝴蝶兰植株 实验采用4组相对变异的蝴蝶兰突变体及其野生型,第1组为市场流行品种‘满天红及其具白色流彩状镶边的花色突变体;第2组为市场流行品种‘光芒四射及其无白色流彩状镶边的花色突变体;第3组为市场流行品种‘V31及其具白色流彩状镶边的花色突变体;第4组为本单位自主选育和审定的蝴蝶兰红花品种‘红珍珠(粤审花2007004)及其晚花突变体(见图1)。突变体均为本单位在组培及栽培过程中发现的自有突变体,经多年观察及繁殖发现突变体的性状均能稳定遗传。所有实验材料均种植于广东省农业现代化科技示范区广东省农业科学院环境园艺研究所温室大棚内,棚内有专职人员种植养护。
1.1.2 试剂 化学试剂均购自广州化学试剂厂;基因组DNA提取试剂盒为天根生物科技(北京)有限公司的新型植物基因组DNA提取试剂盒;扩增试剂:2.5×Multiplex Buffer及Fast Taq DNA Polymerase来自北京阅微基因公司;ROX-500和ROX-800分子量内标来自北京阅微基因公司。
1.1.3 仪器 (1)Nanodrop 2000C核酸蛋白检测系统(Thermo);(2)BC-subMIDI电泳仪(北京六一仪器厂),电泳槽(北京君意东方电泳设备有限公司);(3)BioSens SC 810B凝胶成像仪(上海山富科学仪器有限公司);(4)Centrifuge 5415D离心机(德国eppendorf公司);(5)GeneAmp 9600 PCR仪(ABI公司);(6)3730XL DNA analyzer(ABI公司)。
1.2 方法
1.2.1 总DNA提取 蝴蝶兰基因组DNA提取材料采用根尖0.2 g,按照天根生物科技(北京)有限公司的新型植物基因组DNA提取试剂盒操作步骤进行,提取的DNA溶解在80 μL 1×TE溶液中。提取的DNA分别采用分光光度计检测和琼脂糖凝胶电泳检测。
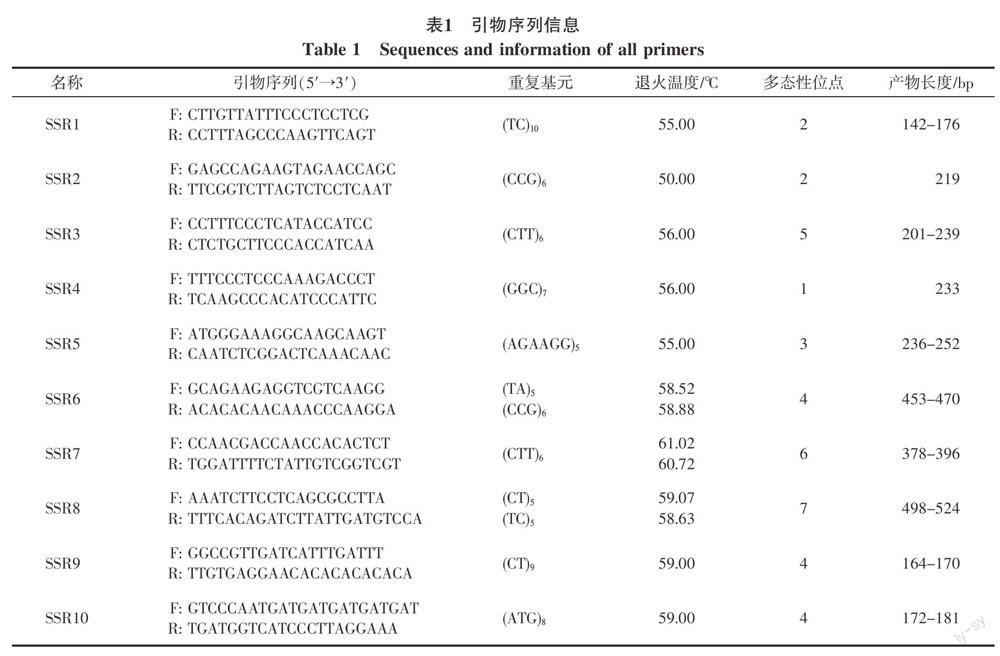
1.2.2 引物合成 引物分别采用3种不同颜色的荧光标记:FAM、HEX和TMR。根据前人研究结果,挑选了25条在蝴蝶兰中扩增效果较好的引物进行扩增[5,22-24],扩增产物大小介于150~750 bp之间,预测多集中于250~550 bp之间。经过筛选,其中10条引物(见表1)在本实验中扩增结果较好,无杂峰,能扩增出稳定的DNA条带。
1.2.3 PCR反应 进行单重PCR扩增,反应体系总体积为15 μL,其中含1.0 μL(50 ng/μL)DNA模板,6.0 μL 2.5×Buffer V缓冲液,0.1 μL(5 U/μL)Taq酶,上下游引物共1.0 μL(5 μmol/L),去离子水6.9 μL。SSR反应程序:95 ℃ 5 min,1个循环;94 ℃ 30 s,58 ℃ 35 s,35个循环;72 ℃ 35 s,60 ℃ 30 min,1个循环,最后降至15 ℃。
1.2.4 测序仪检测及分析 96孔板中每孔加入分子量内标和甲酰胺混合液(0.5 ∶ 8.5)9 μL,PCR产物1.0 μL,95 ℃变性3 min后,上机进行多重混检。1 kV电压进样10 s,电泳15 kV,30 min。将Data Colletion软件收集的原始数据文件导入GeneMapper v4.0软件进行分析,系统将各峰值的位置与其泳道中的ROX-500或ROX-800分子量内标予以比较,直接给出目标DNA片段的准确大小。各荧光标记座位上独立进行3次重复的毛细管电泳检测,取3次重复的平均值并四舍五入取整,作为实验材料在该座位上的数据。
2 结果与分析
统计分析发现,基于8个实验材料,10个SSR荧光标记共检测到38个等位基因(见表2,图2)。10个SSR荧光标记中只有SSR4没有多态性,其余引物均能在一定程度上将各个品种或者正常株与突变体之间区分开。其中,SSR1和SSR6能够将‘满天红及其变异株与其他的品种区分开,但是‘满天红及其变异株之间未能区分。SSR2不能区分‘红珍珠及其变异株,但能将二者与其他的品种区分开。SSR3在‘满天红上表现出特异性缺失,而在‘满天红变异中则扩增出1条234 bp的条带;在‘V31及其变异间检测不到多态性,但是与其他3个品种有所区分;能够将‘光芒四射和‘红珍珠这2个品种、‘光芒四射及其变异区分开,但是不能将‘红珍珠及其变异区分开。SSR5的结果将8个品种分为3组,满天红及其变异株条带一样,‘V31及其变异株条带一样,而剩下的4个品种条带一样。SSR7则能将4个品种都分开,但是每个品种与其变异株之间都不能检测出差异。SSR8即能把‘满天红、‘V31和‘光芒四射3个品种区分开,又能把3个品种与他们的突变体区分开。SSR9能够将4个品种区分开,但在突变体区分中只能将‘红珍珠及其突变体区分开。SSR10可以将‘满天红及其突变体和‘V31及其突变体区分开,而‘满天红、‘V31和‘光芒四射3个品种的扩增条带各不相同,‘红珍珠的扩增条带则与‘V31一样。
SSR3扩增‘满天红时和SSR9扩增‘光芒四射变异时都出现了特异性缺失,不能扩增出条带,可能的原因有2种:(1)该SSR位点由于插入或者缺失而导致该位点缺失;(2)可能是该SSR位点的引物结合区发生点突变,导致引物不能结合。
从扩增结果可以发现,10个SSR引物中,SSR3+SSR8+SSR9的组合就能够完全将4个品种及其突变体全部区分开,说明SSR荧光标记毛细管电泳法检测蝴蝶兰突变体高效可行。
3 讨论与结论
突变体的产生主要来源于物理化学因素、组织培养和太空诱发[25-26]。蝴蝶兰这类采用组培繁殖种苗的观赏作物,其突变体除人为进行外,主要来源于组织培养。突变体鉴定方法共4种:(1)表型鉴定;(2)细胞学鉴定;(3)生物化学鉴定;(4)分子生物学鉴定。各种方法都有自己的优点和适用性。在蝴蝶兰的突变体鉴定上,我们主要采用表型鉴定结合分子生物学鉴定,通过表型鉴定发现突变体,然后利用RAPD[27]或SSR等分子标记手段进行分子生物学鉴定,即首先通过表型鉴定筛选出相对于野生型有显著差异外观性状的突变体,然后通过分子鉴定确定其从基因组水平上发生了变异,最终确定突变体为不受环境因素影响的可遗传突变体。
本研究通过对4个蝴蝶兰品种及其组培突变体的SSR分析,发现不同品种间及正常株与突变体间在一些SSR位点的基因型差异明显,说明SSR标记可用于蝴蝶兰组培突变体鉴别及品种鉴定。通过扩增结果可以发现,虽然‘满天红及其突变体与V31及其突变体、‘光芒四射及其突变体的表型变异类似,均表现为红色的增多或者减少,但是扩增出的多态性条带却完全不同,说明3个突变体的变异可能是由不同的基因突变引起的。Su等[28]从蝴蝶兰中克隆到F3′5′H基因的cDNA全长,利用基因枪法在蝴蝶兰的花瓣中瞬时表达,花瓣在48 h内从粉红色变成品红色,说明F3′5′H基因的上调可能引起红色素的增加;Han等[29]将pchs-1全长基因转化到烟草中发现花的颜色变红从而进一步证明了Pchs基因可能参与花朵的红色素合成;是形成稳定花色素苷所必需的。Chen等[30]研究发现,在红花蝴蝶兰中类黄酮3-O-糖基转移酶(flavonoid 3-O-glucosyltransferase,UFGT)基因大量表达,表达量显著高于白花,而PeUFGT3-RNAi植株则表现出不同程度的褪色,且花青素含量明显降低,说明UFGT基因与红色花的形成高度相关。这些结构基因的表达变化都有可能引起花部色素含量的变化,进而导致花色的改变,另外调控花青素苷生物合成途径中结构基因时空表达的3种转录因子R2R3-Myb、Myc基因家族的bHLH(basic helix-loop-helix)和WD40型转录因子[31]的变化也会引起花色的改变,所以三个突变体的表型虽然类似,成因却各不相同。而‘红珍珠晚花突变体的成因则可能与FT、SOC1和LFY等成花基因[32]的突变相关,Xiang等[33]从春兰中克隆的FT同源基因CgFT在烟草中超量表达会出现早花表型,Huang等[34]从春兰克隆的FT同源基因CgFT在拟南芥中超量表达会也导致转基因拟南芥提早开花,说明FT基因会抑制成花,其突变体可能就会是晚花突变体。
从本实验结果来看,在实际应用方面,前期的蝴蝶兰高效检测突变体技术非常必要。(1)从种质资源的收集利用来讲,需要通过高效分子标记检测表型相同或者不同的各类突变体来筛选出不同基因型的突变体,丰富种质资源的收集保存,减小重复保存,扩大相同表型的不同基因型种质资源,为蝴蝶兰的分子生物学研究和生理生化研究奠定坚实的资源基础;(2)从实际生产上来讲,蝴蝶兰由于生产规模大、成本高,在前期进行抽样检测,保证种苗的品种纯正非常必要。从本实验的数据可以发现,大部分的SSR特异性片段间大小的差异较小,有的小到只差2 bp,传统的SSR检测方法根本不能检测到如此小的差异,毛细管电泳技术则能够检测小到1 bp的差异,使SSR分型变得高效快捷,实用性也更强,更适用于蝴蝶兰的品种及突变体检测鉴定。
当然,用分子标记对种质进行鉴定目前还处于研究阶段,还存在不少问题,特别对于蝴蝶兰这种原生种众多、高度杂合的物种,基因组参考性较差,设计的引物并不一定和重要的形态性状连锁,并不能完全包含一个品种的所有信息。本实验发现,针对大规模的生产检测,SSR荧光标记毛细管电泳法检测行之有效且高效低投入。但是如果是针对生物学实验材料的鉴定检测,还应与染色体水平、细胞学水平和形态水平等鉴定相结合,才能更加准确地描述一个品种的全部种质信息。
参考文献
[1] 张君毅, 陈瑞凤. 蝴蝶兰EST-SSRs分析[J]. 植物生理学通讯, 2010, 46(6): 559-563.
[2] Huang Y, Li F, Chen K S. Analysis of Diversity and relationships among Chinese orchid cultivars[J]. Biochemical Systematics and Ecology, 2010, 38: 93-102.
[3] 张君毅. 蝴蝶兰叶绿体DNA微卫星分析与标记开发[J]. 江西农业学报, 2011, 23(12): 31-33.
[4] 徐晓薇, 江 南, 杨俊波, 等. 寒兰株系间遗传多样性和亲缘关系的SSR分子标记分析[J]. 核农学报, 2011, 25(6): 1 135-1 141.
[5] 张水明, 陈 程, 龚凌燕, 等. 蝴蝶兰EST资源SSR标记分析与开发[J]. 园艺学报, 2012, 23 (12): 31-33.
[6] 程本义, 夏俊辉, 龚俊义, 等. SSR荧光标记毛细管电泳检测法在水稻DNA指纹鉴定中的应用[J]. 中国水稻科学, 2011, 25(6): 672-676.
[7] 许 鲲, 李 锋, 吴金锋, 等. SSR荧光标记毛细管电泳法与国家冬油菜区试指纹鉴定平台的构建[J]. 中国油料作物学报, 2014, 36(2): 150-159.
[8] 聂新辉, 尤春源, 李晓方, 等. 新陆早棉花品种DNA指纹图谱的构建及遗传多样性分析[J]. 作物学报, 2014, 40(12): 2 104-2 117.
[9] 匡 猛, 杨伟华, 许红霞, 等. 中国棉花主栽品种DNA 指纹图谱构建及SSR标记遗传多样性分析[J]. 中国农业科学, 2011, 44(1): 20-27.
[10] 梁 俊, PAN Yong-Bao, 李杨瑞, 等. 甘蔗属不同种及优良甘蔗栽培品种的SSR标记遗传多样性分析[J]. 广西植物, 2010, 30(5): 594-600.
[11] 闫彩霞, 张 浩, 张廷婷, 等. 抗感黄曲霉花生种质遗传多样性评价与指纹图谱构建[J]. 山东农业科学, 2016, 48(1): 1-6.
[12] 麻丽颖, 孔德仓, 刘华波, 等. 36 份枣品种SSR 指纹图谱的构建[J]. 园艺学报, 2012, 39(4): 647-654.
[13] 高 源, 田路明, 刘凤之, 等. 利用SSR荧光标记构建92个梨品种指纹图谱[J]. 园艺学报, 2012, 39(8): 1 437-1 446.
[14] 徐雷锋, 葛 亮, 袁素霞, 等. 利用荧光标记SSR构建百合种质资源分子身份证[J]. 园艺学报, 2014, 41(10): 2 055-2 064.
[15] 殷冬梅, 杨秋云, 杨海棠, 等. 花生突变体的EMS诱变及分子检测[J]. 中国农学通报, 2009, 25(5): 53-56.
[16] 乔 勇. 60Co-γ射线辐照后不同唐菖蒲品种M2代生物学特性的变化及突变体检测研究[D]. 陕西: 西北农林科技大学, 2008.
[17] 苏玉环. 太空诱变西瓜突变体检测及相关片段的克隆[D]. 保定: 河北农业大学, 2008.
[18] 王 丰, 李永辉, 柳武革, 等. 水稻不育系培矮生645的空间诱变效应及后代的SSR分析[J]. 核农学报, 2006, 20(6): 449-453.
[19] 杨存义, 陈芳远, 王应祥, 等. 粳稻品种秋光空间诱变突变体的微卫星分析[J]. 西北植物学报, 2003, 23(9): 1 550-1 555.
[20] Shuangxia Jin, Ramesh Mushke, Huaguo Zhu, et al. Detection of somaclonal variation of cotton(Gossypium hirsutum) using cytogenetics, Flow Cytometry and Molecular Markers[J]. Plant Cell Rep, 2008, 27: 1 303-1 316.
[21] 黄益安, 邓小娟, 万海波, 等. 大豆华夏3 号突变体库构建及SSR分子标记[J]. 中国油料作物学报, 2016, 38(2): 159-166.
[22] 李冬梅, 吕复兵, 朱根发, 等. 蝴蝶兰EST资源的SSR信息分析[J]. 广东农业科学, 2011, 3: 117-120.
[23] Fattmah, Sukma D. Development of sequence-based microsatellite marker for Phalaenopsis, orchid[J]. Hayati Journal of Biosciences, 2011, 18(2): 71-76.
[24] Rodrigues K F, Kumar S V. Isolation and characterization of microsatellite loci in Phalaenopsis gigantea[J]. Conserv Genet, 2009, 10: 559-562.
[25] 穆丽霞, 何晓明, 王小菁.植物抗性突变体离体筛选和鉴定研究进展[J]. 广东农业科学, 2006(1): 30-33.
[26] 王浩波, 高秀武, 谷运红, 等. 离子束诱变西瓜体细胞抗镰刀菌酸突变体研究[J]. 核技术, 2003, 26: 609-612.
[27] 肖文芳, 李 佐, 尤 毅, 等. 几种常见蝴蝶兰组培突变体的RAPD检测[J]. 热带作物学报, 2013, 34(6): 1 110-1 114.
[28] Su V, Hsu B D. Cloning and expression of a putative cytochrome P450 gene that influences the color of Phalaenopsis flowers[J]. Biotechnol Lett, 2003, 25(22): 1 933-1 939.
[29] Han Y Y, Ming F, Wang J W, et al. A novel chalcone synthase gene from Phalaenopsis orchid that alters floral morphology in transgenic tobacco plants[J]. Plant Molecular Biology Reporter, 2005, 23: 193-193.
[30] Chen W H, Hsu C Y, Cheng H Y, et al. Downregulation of putative UDP-glucose: flavonoid 3-O-glucosyltransferase gene alters flower coloring in Phalaenopsis[J]. Plant Cell Reports, 2011, 30(6): 1 007-1 017.
[31] Tanaka Y, Sasaki N, Ohmiya A. Biosynthesis of plant pigments: anthocyanins, betalains and carotenoids[J]. The Plant Journal,2008, 54(4): 733-749.
[32] Moon J, Lee H, Kim M, et al. Analysis of flowering pathway integrators in Arabidopsis[J]. Plant & Cell Physiology, 2005, 46(2): 292-299.
[33] Xiang L, Li X, Qin D, et al. Functional analysis of FLOWERING LOCUS T orthologs from spring orchid(Cymbidium goeringii Rchb. f.)that regulates the vegetative to reproductive transition[J]. Plant Physiology and Biochemistry, 2012, 58: 98-105.
[34] Huang W, Fang Z, Zeng S, et al. Molecular cloning and functional analysis of three FLOWERING LOCUS T(FT)homologous genes from Chinese Cymbidium[J]. International Journal of Molecular Sciences, 2012, 13(9): 11 385-11 398.
