巴西橡胶树冷应答基因HbCOR47的鉴定与表达分析
2016-05-30程汉陈相黄华孙
程汉 陈相 黄华孙


摘 要 前期研究表明,在橡胶树中存在着1个CBF信号途径,然而该信号通路的下游COR家族功能基因却一直未能被发掘。本研究通过检索橡胶树低温诱导转录组数据,从中发现了1个COR47基因。通过对该基因的克隆、测序和生物信息学分析,表明HbCOR47可能是橡胶树中唯一的COR家族成员。对该基因的低温诱导表达特性进行研究,发现HbCOR47受到低温诱导表达,但反应时间较拟南芥等温带植物的COR基因晚。针对HbCOR47基因的特性及其表达特征,结合橡胶树CBF信号途径的特征进行了进一步讨论。
关键词 橡胶树;低温应答;CBF信号途径;HbCOR47
中图分类号 Q78;S794.1 文献标识码 A
Abstract A CBF pathway was found existed in rubber trees in our previous study, while its downstream functional COR family genes were not identified yet until now. In this study, a COR47 homolog gene was identified by searching the rubber tree cold induced transcriptome data. Then the HbCOR47 gene was cloned, sequenced and bioinformatically analyzed, which was revealed to be the only one COR family member in H. brasiliensis. The expression of HbCOR47 exhibited a cold induced expression profile, while the responding pattern was relatively slow when compared with those in Arabidopsis. Finally, the characterization of HbCOR47 gene and CBF pathway of rubber tree were discussed in the context of non-cold acclimation plants.
Key words Hevea brasiliensis; Cold responding; CBF pathway; HbCOR47
doi 10.3969/j.issn.1000-2561.2016.10.013
巴西橡胶树(Hevea brasiliensis)是天然橡胶的主要来源。20世纪我国在北纬18°大规模成功种植巴西橡胶树,建立了海南、云南和广东三大植胶区,基本保障了我国对天然橡胶的需求[1]。然而由于巴西橡胶树起源于热带,对低温极其敏感,加上我国植胶区处于热带北缘,时常受到冬春寒潮的影响。低温寒害是限制我国天然橡胶种植的主要环境限制因子之一。建国后平均每隔10年就会遇到一次大的寒潮,造成橡胶树大范围死亡,给广大胶农和农场带来巨大的经济损失,也威胁到我国天然橡胶产业的发展[2-3]。因此,抗寒育种始终是我国橡胶树育种的一个主要研究方向。
开展橡胶树抗寒生理机制研究,一方面能弄清橡胶树遭受寒害后的生理学变化,为橡胶树抗寒栽培提供理论支持;另一方面可以摸清橡胶树低温应答信号通路,克隆橡胶树中与抗寒相关的功能基因。CBF信号通路是近年来在植物中发现的最重要的低温信号途径之一。CBF信号途径作为非ABA依赖的低温应答途径,在温带植物应对低温寒害过程中发挥了重要的作用。巴西橡胶树起源于热带,对低温极其敏感。之前程汉等[4]在橡胶树中克隆了CBF信号途径中最关键的转录因子HbCBF1基因,也对该基因的表达特征和生物学功能进行了系统的研究,并推测橡胶树中也存在着一个基于HbCBF1转录因子的CBF信号通路[4-6]。但通过常规分子生物学方法,笔者一直未能在橡胶树中克隆到CBF信号通路的下游COR家族功能基因。利用拟南芥COR6.6、COR47、COR15a和RD29a 4个COR家族蛋白序列对橡胶树低温诱导转录组数据进行比对搜索,仅得到1条与AtCOR47同源的序列。本研究旨在对该序列所代表的基因进行初步研究,试图弥补橡胶树中CBF信号通路的下游缺口。
1 材料与方法
1.1 材料
本实验Solexa测序的材料来自巴西橡胶树抗寒品种93-114,当年嫁接苗保存于中国热带农业科学院橡胶研究所苗圃内,待第一蓬叶稳定后,搬回实验室中,放置于人工气候箱中培养。培养条件:25 ℃,16 h光照/8 h黑暗。经过一周适应性培养后,转移至设置为4℃的低温培养室进行低温处理。分别在0,2,8和24 h取样,提取总RNA,送交北京百迈客生物公司进行转录组测序分析。
菌种E. coli. JM109为国家橡胶树育种中心实验室保存菌种,Taq酶、pUCm-T载体和DNA凝胶回收试剂盒、AMV逆转录酶、T4 DNA连接酶等分子生物学试剂购自大连宝生物公司。所有引物及测序均由广州英骏生物公司合成完成。其他生化试剂为国产分析纯试剂。
1.2 方法
1.2.1 HbCOR47基因的鉴定和序列分析 由于COR家族基因不根据序列、而根据其功能和低温应答特征进行分类。各个COR成员之间没有序列同源性。为了全面鉴定橡胶树中的COR家族成员,本实验使用拟南芥COR6.6、RD29a、COR15a和COR47四个基因的编码蛋白质序列,分别对橡胶树低温诱导转录组数据进行TBLASTN搜索(e-value<0.01),得到候选COR基因HbCOR47。
HbCOR47基因的ORF预测通过NCBI的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)程序进行,其氨基酸序列理化特性分析通过ExPASy的在线软件Compute PI/MW(http://au.expasy. org/tools/pi_tool.html)、Protparam tool(http://us.expasy.org/tools/protparam.html)、http://www.ch.embnet.org/和NCBI的核酸、蛋白质结构特征在线分析工具进行。氨基酸功能保守区通过NCBI的CD-Search service工具(http://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)进行预测。信号肽预测采用SignalP 3.0程序(http://www.cbs.dtu.dk/services/SignalP)进行。疏水性图谱使用ExPASy的ProtScale(http://www.expasy.org/cgi-bin/protscale.pl)进行。蛋白质跨膜区预测使用TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM/)进行。亚细胞定位使用Psort程序(http://psort.nibb.ac.jp)进行分析。
1.2.2 HbCOR47全长cDNA的克隆 根据转录组数据中搜索得到的结果,设计引物:5′-CTTACGG
TGATCTAGAACAGCAT-3′,5′-CTACAAGCCACAC
ACTTATCATCAT-3′,以扩增HbCOR47基因全长序列。分别从cDNA和基因组DNA上扩增目的片段,回收后克隆至T载体,送交广州英骏公司测序。将测序结果与转录组中的序列进行比对,证实扩增到的序列来自HbCOR47基因。
1.2.3 基因结构与进化分析 利用在线软件GSDS2.0(http://gsds.cbi.pku.edu.cn/)对HbCOR47外显子/内含子组织结构进行分析。利用MEGA软件对橡胶树和其他植物的HbCOR47蛋白的氨基酸序列构建系统发育树[7],采用Neighbor-Joining方法,进行1 000次bootstrap统计学检验。
1.2.4 基因的表达模式分析 基因表达采用qPCR方法进行。橡胶树抗寒品种93-114幼苗经过0,0.5,2,8和24 h的低温处理,提取叶片总RNA,经过DnaseI消化、反转录后,进行qPCR分析,以橡胶树18S rRNA基因为内参,采用ΔΔct法进行定量分析。HbCOR47的qPCR引物为5′-TCGTGGGTTGTTTGGTTTCTTGGG-3′,5′-CTCT
TTGTGCTCAGGTTCAGATACG-3′。每个样品经过3个生物学重复和3个实验学重复,确保实验数据的一致性。表达数据经过student t-test进行显著性差异分析。
2 结果与分析
2.1 HbCOR47基因的鉴定和序列特征分析
通过同源性搜索,在橡胶树低温诱导转录组数据中查询到唯一一个与拟南芥COR47蛋白具有相似性的序列。经过进一步电子延伸,得到1条1 112 bp的cDNA序列,经过编码区查找,发现其中有1个编码224 Aa的蛋白质编码区。HbCOR47的cDNA序列和推导的编码区氨基酸序列如图1所示。经过初步分析,发现在HbCOR47基因推导的多肽序列上,有1个明显的脱水蛋白结构域(dehydrin domain),该结构域是COR47蛋白的典型特征[8],因此推测该多肽与COR47具有同源性,故将该序列所对应的基因初步命名为HbCOR47。
根据HbCOR47电子延伸序列,从橡胶树cDNA中扩增目标序列,结果得到1个1.2 kb左右的DNA片段(图2),将该片段从琼脂糖凝胶中回收、克隆,送交测序。结果表明该DNA片段的序列与电子延伸的HbCOR47序列完全一致,表明从橡胶树低温诱导转录组数据中得到的HbCOR47基因是存在的,且序列正确。
2.2 HbCOR47基因结构分析
利用HbCOR47的全长cDNA序列,搜索橡胶树参考基因组序列,得到该基因的上游调控序列元件和基因结构信息。如图3所示,HbCOR47基因包含2个外显子和1个104 bp的内含子,该内含子存在于编码区内部。检索该基因的上游调控序列,还发现分别在-1 500 bp,-670 bp和-500 bp的位置存在着CRT/DRE转录调控元件(图3)。由于CRT/DRE元件可与CBF蛋白AP2 domain特异性地结合, 启动耐寒基因COR的表达[9],推测HbCOR47基因可能是CBF信号途径下游基因,受到CBF转录因子的调控。
2.3 HbCOR47编码多肽序列特征分析
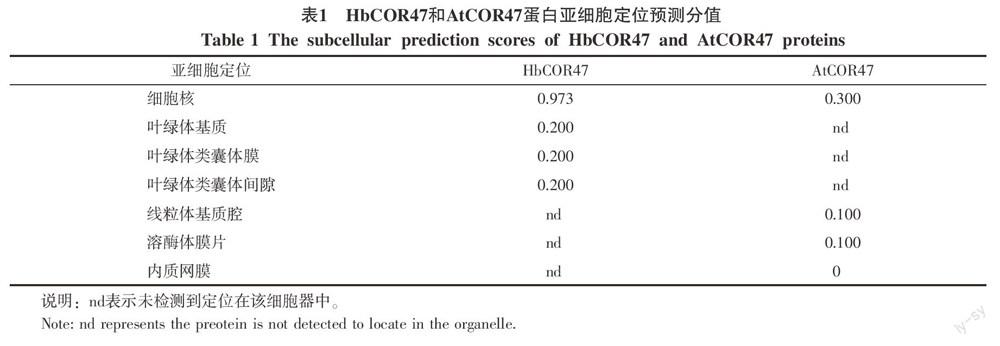
利用EMBOSS的PEPSTATS 工具对推导的HbCOR47蛋白进行初步分析,发现该推导多肽分子量为25.4 ku,等电点为5.275 6。富含赖氨酸残基,达到44个,占总氨基酸残基数目的19.64%。通过SignalP 3.0程序和ProtScale(http://www.expasy.org/cgi-bin/protscale.pl)对HbCOR47进行信号肽和疏水区搜索,发现该蛋白的N端不存在明显的信号肽,也没有明显的跨膜区域。用Psort程序(http://psort.hgc.jp)分析HbCOR47蛋白的亚细胞定位,结果显示在第94个氨基酸残基位置有一个KKKKKE
KKGLKEKIKEK的Robbins & Dingwall核定位序列[10],表明该蛋白有较高可能性(0.973)定位在细胞核中。同时,该蛋白还有可能定位到叶绿体,主要存在于基质、类囊体膜和间隙中(表1)。
笔者也利用拟南芥的COR47蛋白进行了亚细胞定位分析。结果表明,AtCOR47蛋白的亚细胞定位不同于橡胶树,而是定位在细胞核、线粒体和溶酶体中。通过对比橡胶树和拟南芥的COR47定位结果,发现橡胶树COR47有更大的可能性定位到细胞核中,这个分值甚至比拟南芥COR47的定位分值还要高很多(表1)。
2.4 HbCOR47蛋白的进化分析
将橡胶树HbCOR47基因编码多肽序列与来自拟南芥(P31168.2)、杨树(XP_006383759.1)、蓖麻(XP_
002510636.1)、木薯(AGC51777.1)、可可(XP_007017965.1)、大豆(NP_001240106.1)、樟树(XP_006829002.1)等其他植物的COR47基因编码蛋白序列进行比对,发现橡胶树HbCOR47蛋白与其他植物的COR47蛋白具有较高的相似性(图4)。在比对中也发现,COR47家族蛋白中存在着数个高度保守的结构域,其中包括核定位特征序列(128~150)和脱水蛋白家族结构域(240~273)。
对橡胶树和其他7种植物的COR47蛋白质氨基酸序列一起构建系统进化树,结果表明橡胶树的COR47蛋白与同样来自大戟科的蓖麻和木薯亲缘关系较近,而与拟南芥和樟树则关系较远(图5)。
2.5 HbCOR47基因表达特征分析
COR47基因是CBF信号通路下游的功能基因之一,其启动子区域含有CRT/DRE结合元件,受到CBF转录因子的调控[11-14],因而受低温诱导表达。为了检测橡胶树HbCOR47基因是否具有低温应答特征,利用qPCR技术对橡胶树HbCOR47基因的表达模式进行了研究。结果如图6所示。可见,HbCOR47基因在常温下表达水平极低,在低温处理前4 h内,几乎看不出表达量的上升。到第8小时,HbCOR47基因表达量几乎上升了1倍,达到极显著差异水平。随着低温处理时间的延长,HbCOR47的表达量还在进一步上升。HbCOR47基因表现出了典型的低温诱导表达特征,表明该基因作为CBF信号通路下游功能基因的同源基因,参与了橡胶树低温应答途径。
3 讨论
CBF信号通路包括CBF转录因子家族成员和下游的COR家族功能基因,构成一个完整的低温应答反应机制。然而在非低温驯化植物中,虽然发现了CBF家族基因,但对其下游的COR家族成员研究较少。笔者也曾经在橡胶树中克隆了CBF家族基因,但一直未能发现其下游功能基因。在本研究中,笔者通过深度转录组测序技术,从橡胶树中发现并克隆、分析了可能唯一的COR家族成员,并研究其特性及其低温应答特征。该研究对于进一步阐述橡胶树的低温应答机制、特别是其CBF信号通路的功能具有重要意义。
经过研究,发现HbCOR47蛋白与拟南芥、杨树等其他植物中的COR47蛋白同源,也含有一个脱水蛋白结构域和一个细胞核定位特征序列。需要指出的是,通过生物信息学方法分析HbCOR47蛋白的亚细胞定位,却发现该蛋白非常有可能定位到细胞核中。这是之前的研究中没有发现过的。COR47蛋白含有脱水蛋白(dehydrin)结构域,属于脱水蛋白家族。脱水蛋白作为干旱和低温应答蛋白,在植物细胞受到非生物胁迫时,起到保护细胞的膜系统的作用。由于COR47蛋白不是转录因子,也没有转录结合调控结构域,因此推测HbCOR47蛋白定位到细胞核与保护橡胶树细胞核的膜系统有关。但由于对COR47蛋白生物学功能的研究较少,需要更多的分子生物学和结构生物学的证据才能支持该推论。
笔者之前的研究中证明了橡胶树HbCBF1蛋白具有体外结合CRT/DRE结合元件的功能[4-5],表明在橡胶树中也存在CBF信号途径,然而由于未能发现下游的COR家族基因,因而推测橡胶树的CBF信号途径是不完善的。本研究中通过搜索RNA-seq数据,找到一个COR47同源基因,同时也证明该基因是低温应答基因。表明橡胶树中也存在CBF下游基因。然而,与拟南芥等温带植物不同的是,在拟南芥中至少存在8个COR家族蛋白[14],在橡胶树却只找到一个COR47蛋白,在数量上比拟南芥少了很多。此外,在之前的研究中,笔者克隆了橡胶树的HbCBF1基因,也证明了该基因具有调控CRT/DRE转录调控元件的作用。COR47作为CBF的下游功能基因,它对低温应答往往要比CBF基因慢。在拟南芥中,CBF1基因受低温诱导15 min后即可表达,而COR47则要等到2 h之后[15-17]。在橡胶树中,笔者发现HbCBF1基因在低温处理4 h后才开始诱导表达,而HbCOR47则在低温处理8 h后才开始进行低温响应。橡胶树的CBF1和COR47蛋白的低温应答时间明显比拟南芥晚很多,表明橡胶树CBF信号途径对低温反应相对迟钝。这两个因素可能决定了橡胶树中的CBF信号途径在橡胶树的低温应答方面功能较弱,这也许也是橡胶树对低温敏感的原因之一。
当然,本研究仅仅对橡胶树COR47基因进行了初步研究,目前也只能推测HbCOR47是HbCBF1的下游基因。这些推论还需要进一步的实验证明。未来研究将着重从COR47的生理功能和HbCBF1对HbCOR47的调控作用方面开展,努力揭示橡胶树CBF信号途径的应答状态和生理功能。
参考文献
[1] 何 康, 黄宗道. 热带北缘橡胶树栽培[M]. 广州: 广东科技出版社, 1987.
[2] 王立丰, 吴绍华, 田维敏. 巴西橡胶树抗寒机制研究进展[J]. 热带作物学报, 2012, 33(7): 1 320-1 325.
[3] 阚丽艳, 谢贵水, 陶忠良, 等. 海南省2007/2008年冬橡胶树寒害情况浅析[J]. 中国农学通报, 2009(10): 251-257.
[4] Cheng H, Cai H, Fu H, et al. Functional characterization of Hevea brasiliensis CRT/DRE binding factor 1 gene revealed regulation potential in the CBF pathway of tropical perennial tree[J]. PLoS ONE, 2015, 10(9): e0137634.
[5] 程 汉, 高 静, 张燕燕, 等. 橡胶树HbCBF1蛋白的原核表达及其CRT结合活性分析(简报)[J]. 分子细胞生物学报, 2008, 41(5): 423-428.
[6] 程 汉, 安泽伟, 黄华孙. 巴西橡胶树CBF1基因的克隆和序列分析[J]. 热带作物学报, 2005, 26(3): 50-55.
[7] Tamura K, Stecher G, Peterson D, et al. MEGA6: Molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12): 2 725-2 729.
[8] Lin C, Thomashow M F. DNA sequence analysis of a complementary DNA for cold-regulated Arabidopsis Gene cor15 and characterization of the COR 15 polypeptide[J]. Plant Physiol, 1992, 99(2): 519-525.
[9] Yamaguchi-Shinozaki K, Shinozaki K. A novel cis-acting element in an Arabidopsis gene is involved in responsiveness to drought, low-temperature, or high-salt stress[J]. Plant Cell, 1994, 6(2): 251-264.
[10] Dingwall C, Robbins J, Dilworth S M, et al. The nucleoplasmin nuclear location sequence is larger and more complex than that of SV40 large T antigen[J]. J Cell Biol, 1988, 107(3): 841-849.
[11] Thomashow M F. Role of cold-responsive genes in plant freezing tolerance[J]. Plant Physiology, 1998, 118(1): 1-8.
[12] Jaglo-Ottosen K R, Gilmour S J, Zarka D G, et al. Arabidopsis CBF1 overexpression induces COR genes and enhances freezing tolerance[J]. Science, 1998, 280(5360): 104-106.
[13] Nordin K, Heino P, Palva E T. Separate signal pathways regulate the expression of a low-temperature-induced gene in Arabidopsis thaliana(L.)Heynh.[J]. Plant Molecular Biology, 1991, 16(6): 1 061-1 071.
[14] Thomashow M F. Plant cold acclimation: freezing tolerance genes and regulatory mechanisms[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50(1): 571-599.
[15] Zarka D G, Vogel J T, Cook D, et al. Cold induction of Arabidopsis CBF genes involves multiple ICE (Inducer of CBF Expression) promoter elements and a cold-regulatory circuit that is desensitized by low temperature[J]. Plant Physiol, 2003, 133(2): 910-918.
[16] Gilmour S J, Zarka D G, Stockinger E J, et al. Low temperature regulation of the Arabidopsis CBF family of AP2 transcriptional activators as an early step in cold-induced COR gene expression[J]. The Plant Journal, 1998, 16(4): 433-442.
[17] Liu Q, Kasuga M, Sakuma Y, et al. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought- and low-temperature-responsive gene expression, respectively, in Arabidopsis[J]. Plant Cell, 1998, 10(8): 1 391-1 406.
