巴西橡胶树镁离子转运蛋白基因HbMGT10的克隆及表达分析
2016-05-30阳江华秦云霞方永军唐朝荣
阳江华 秦云霞 方永军 唐朝荣
摘 要 Mg2+是植物细胞中含量最高的二价阳离子,是多种酶活性调控的辅因子,在植物的生长发育过程中发挥重要作用;同时,作为叶绿素分子的中心原子,在植物光合作用中起着至关重要的作用,但目前有关高大乔木叶片中Mg2+跨膜运输的研究还很少。MGT/MRS2类型的镁离子转运蛋白在植物鎂离子的跨膜运输过程中起着重要的作用,本文克隆研究了一个巴西橡胶树MGT基因,HbMGT10。亚细胞定位显示,HbMGT10定位于叶绿体膜上;酵母互补实验表明,HbMGT10具有镁离子转运功能;qRT-PCR分析结果显示,HbMGT10主要在橡胶树叶片中表达,且是叶片中表达丰度最高的HbMGT基因;HbMGT10在叶片中的表达存在明显的发育调控,随叶片发育进程表达量明显增加,在淡绿期和稳定期表达量最大;HbMGT10在成熟叶片中的表达呈现明显的日变化,在光强度最大的12 : 00~16 : 00的表达量最大。由此推测,HbMGT10在橡胶树叶片叶绿体膜的镁离子跨膜转运过程中起着重要的作用,参与了橡胶树叶片叶绿体的发育,以及叶绿体中镁离子浓度的调控,以适应橡胶树叶片的光合作用。
关键词 巴西橡胶树;镁离子转运蛋白;镁离子;HbMGT10;叶绿体
中图分类号 S794.1 文献标识码 A
Mg2+是植物细胞质中仅次于钾离子、含量第二的阳离子,参与多种生理生化过程[1]。Mg2+位于叶绿素中央,是植物光合作用的关键阳离子,当镁离子缺乏时,叶绿素浓度降低、光合效率下降,叶片发黄,产生萎黄病[2]。
高等植物中,镁离子转运蛋白的研究主要集中在MGT(Magnesium Transporter)/MRS2(Mitochondrial RNA Splicing2)镁离子转运蛋白[3-4]和一种质子依赖性转运蛋白Mg2+/H+交换体[5-6]。其它转运蛋白和离子通道也具有一定的镁离子转运功能,比如大豆的SV通道[7],水稻的OsHKT2;4[8],拟南芥的AtCNGC10[9]。MGT/MSR2类型的镁离子转运蛋白是基因数量最多的,目前研究最广泛的镁离子转运蛋白基因家族,位于植物细胞的细胞膜和液泡膜、叶绿体膜、线粒体膜等亚细胞器膜上,在维持细胞质和亚细胞器Mg2+浓度动态平衡起着重要作用[3-4,10-11]。通过研究拟南芥突变体,发现AtMGT有着多种不同的功能。在蛇纹岩土中培养时,atmgt2和atmgt3突变体叶肉细胞中的Mg2+浓度明显低于野生型植株[12]。AtMGT5定位于线粒体上,在雄配子的细胞质和线粒体间的Mg2+运输过程中起着关键作用,atmgt5突变体的雄配子发育存在缺陷,不能获得AtMGT5突变体的纯合子[13]。当Mg2+浓度低至50 μmol/L时,mrs2-7(atmgt7)突变体的生长受到明显抑制,而在突变体中过表达atmrs2-7(AtMGT7)后植株的生长速度恢复到野生型的水平[14]。AtMGT9主要在成熟花药和维管组织中表达,在雄配子发育和雄性育性上起着关键的作用;AtMGT9基因T-DNA插入杂合体突变体拟南芥+/mgt9中,有一半的突变体植株花粉败育,且突变体自交不能产生同样的杂合体+/mgt9子代[15]。在拟南芥中过表达AtMRS2-11(AtMGT10)基因,虽然会增加AtMRS2-11的蛋白表达水平,但未产生可观察到的表型变化[17]。
目前,MGT/CoA镁离子转运蛋白的研究主要集中在模式植物拟南芥,以及粮食作物水稻和玉米等草本植物中[3-4,10,16],在高大乔木中的研究报道很少。巴西橡胶树是一种来源于巴西热带雨林的高大乔木,其叶片中镁离子的运输可能有其自身独特的特点。前期研究中,已从橡胶树转录组和基因组数据中获得了11个镁离子转运蛋白基因(HbMGTs)(未发表文献)。本研究成功克隆了主要在叶片中表达的HbMGT10基因的全长cDNA序列,并进行了相关功能研究。
1 材料与方法
1.1 材料
1.1.1 实验材料 实验用树为巴西橡胶树,品系为热研7-33-97,采自中国热带农业科学院试验场3队。
1.1.2 实验试剂和菌种 克隆载体pMD-18T载体为大连宝生物公司产品,DNA Polymerase High Fidelity和荧光定量试剂为北京全式金生物技术有限公司产品,DNA限制性内切酶、反转录试剂盒和T4 DNA连接酶为美国Thermo Fisher公司产品。DNA凝胶回收试剂盒和质粒提取试剂盒为美国Omega公司产品。通用植物总RNA提取试剂盒为北京百泰克生物技术有限公司产品。大肠杆菌菌种DH5α,酿酒酵母菌种SEY6210(MATα leu2-3,112 ura3-52 hisΔ200 trp-Δ901 lys2-801 suc2-Δ9),酵母表达载体pDR196和pGBKT7,亚细胞定位载体HBT95-sGFPS65T-NOS,均为本实验室保存。引物合成和DNA测序均由上海英俊生物技术公司完成。
1.2 方法
1.2.1 材料处理 不同组织和器官的实验材料采自10年生、开割3 a的未进行乙烯利刺激割胶的橡胶树。同一天不同时间点的叶片,以及不同发育时期的叶片,采自定植4 a的幼龄树。3株橡胶树为1个实验重复,共3个实验重复。
1.2.2 总RNA的提取及cDNA第一链的合成 巴西橡胶树胶乳总RNA的提取参照Tang等[18]的办法。除胶乳外其它材料的总RNA提取使用百泰克公司的通用植物总RNA提取试剂盒,使用方法参照试剂盒说明书。cDNA第一链的合成使用Thermo Fisher公司的cDNA第一链合成试剂盒,操作步骤按照说明书进行。
1.2.3 HbMGT10基因的克隆 以拟南芥的AtMRS2-11(AtMGT10)[17]的氨基酸序列为搜索序列,通过搜索巴西橡胶树的转录组数据库,拼接得到HbMGT10的cDNA序列。以叶片cDNA为模板,使用引物HbMGT10-F和HbMGT10-R 进行PCR扩增,产物经琼脂糖凝胶回收后,连接到pMD-18T载体中,阳性克隆送上海英俊生物技术公司测序。最终得到HbMGT10的全长cDNA序列。所用引物序列见表1。
1.2.4 实时荧光定量表达分析 使用实时荧光定量PCR技术,分析HbMGT10基因在不同组织、叶片不同发育时期、叶片一天内不同时间的表达变化。不同组织和叶片不同发育分析时使用的内参基因是RH2b,叶片一天不同时间点分析时使用的内参基因为UBC2a,内参基因的引物序列和实时荧光定量PCR方法参照Li等的论文[19]。
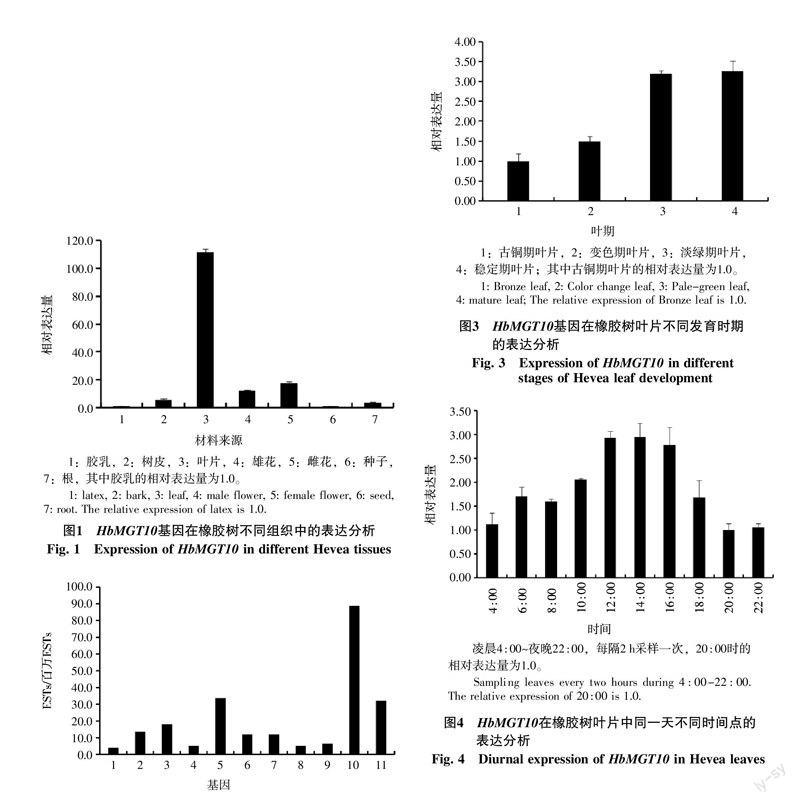
1.2.5 酵母互補实验分析 酵母菌种SEY6210为野生菌种,线粒体膜上有ScMRS2基因,能够有效利用甘油等非发酵碳源,维持正常生长。以pGBKT7质粒为模板,两端分别带有ScMRS2基因同源臂的引物mrs2-Trp-F和mrs2-Trp-R,扩增TRP1基因,通过同源重组的方法[20],以TRP1基因替换掉ScMRS2基因,这样SEY6210能够在Trp缺陷型酵母培养基上生长。成功敲除了ScMRS2基因,获得的突变体酵母SEY-mrs2不能在只添加非发酵碳源的YPdG培养基上正常生长,但在添加发酵碳源的YPD培养基上能正常生长。YPdG培养基配方为:1% Yeast Extract,2% Peptone,3%甘油,0.05%葡萄糖,2%琼脂粉。YPD培养基配方:1% Yeast Extract,2% Peptone,2%葡萄糖,2%琼脂粉。
为了使得HbMGT10能够准确定位到酵母的线粒体内膜上,以互补ScMRS2的功能。用引物对ScMRS2-pro和ScMsr2+95AA扩增酵母ScMRS2的启动子和前95个氨基酸,连接到pDR196载体。使用引物对HbMGT10-143aa和HbMGT10-Pst扩增除去了前5'端143个氨基酸的HbMGT10,再连接到ScMRS2的第95个氨基酸后,组成了一个ScMRS2和HbMGT10的融合蛋白。构建完成的HbMGT10酵母表达载体196-HbMGT10转化突变体酵母SEY-mrs2,分别在YPdG和YPD培养基上生长。使用同样的方法,构建了去除5′端107个氨基酸的HbMGT6的酵母表达载体196-HbMGT6。
1.2.6 亚细胞定位分析 使用引物对HbMGT10-SF和HbMGT10-SR扩增HbMGT10基因的去除了终止密码子TAA的编码区。然后连接到HBT95-sGFPS65T-NOS载体的绿色荧光蛋白基因GFP的前面,构建HbMGT10的亚细胞定位分析载体HBT-HbMGT10。HbMGT10的亚细胞定位分析使用水稻原生质体,方法参照Chen等[21],略有改动。其中GFP绿色荧光使用的激发光波长为480 nm,发射光波长为510 nm,叶绿体自发红光的激发光波长为560 nm,发射光波长为650 nm。
2 结果与分析
2.1 HbMGT10基因全长cDNA序列的获得
通过RT-PCR获得了HbMGT10的全长cDNA序列,全长1 757 bp,其中编码区长1 329 bp,5′非编码区长99 bp,3′非编码区长329 bp,编码442个氨基酸序列。与拟南芥定位于叶片叶绿体的镁离子转运蛋白AtMRS2-11[17]的氨基酸序列同源性为71.3%。ChloroP 1.1预测HbMGT10定位于叶绿体,信号肽长53个氨基酸。
2.2 HbMGT10基因的表达分析
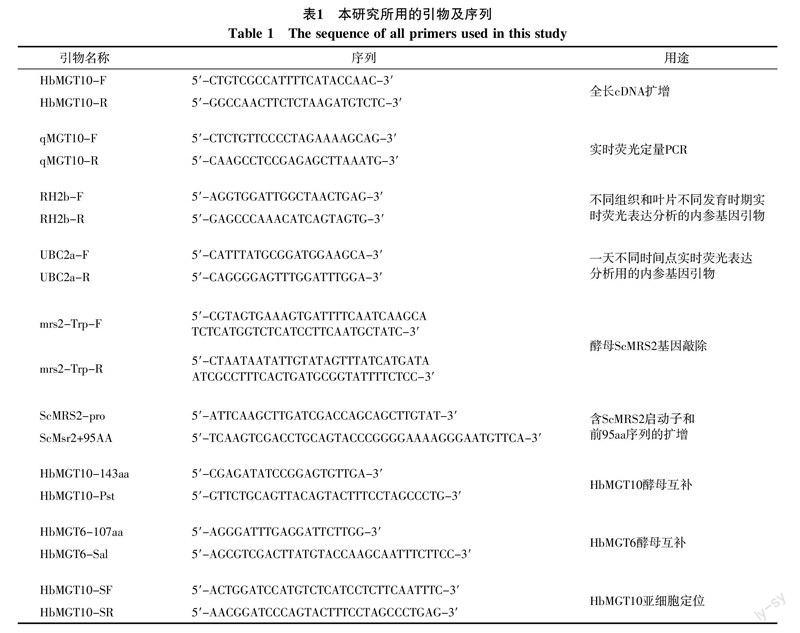
实时荧光定量PCR分析结果显示,HbMGT10基因主要在巴西橡胶树的叶片中表达,花中次之,胶乳和种子的表达量极低,尚不足叶片表达量的百分之一(图1)。利用巴西橡胶树的Solexa高通量转录组数据分析橡胶树HbMGT家族全部11个基因在叶片中的相对表达水平,结果表明,HbMGT10在叶片中的表达丰度显著高于其它10个家族基因,是橡胶树叶片中表达丰度最高的HbMGT基因(图2)。分析巴西橡胶树不同发育时期叶片中HbMGT10的表达水平,结果表明该基因随叶片发育进程表达量不断增加,在淡绿和稳定期叶片中表达量最高(图3)。在同一天不同时间点叶片中的表达分析表明,HbMGT10在光强度大的12 : 00~16 : 00期间的表达量最大(图4)。
2.3 HbMGT10酵母互补实验
ScMRS2是酵母线粒体中II类内含子自我剪接缺陷的抑制基因,定位于线粒体内膜上,也参与了线粒体镁离子的跨膜运输,ScMRS2的缺失会造成酵母不能在非发酵碳源的培养基上正常生长[22-23]。本研究成功获得了敲除ScMRS2基因的酵母突变体SEY-mrs2,该突变体不能在添加非发酵碳源的YPdG培养基上正常生长(图5),表达了HbMGT10的SEY-mrs2的生长明显好于SEY-mrs2,但仍比野生型酵母差,表明HbMGT10能够部分互补ScMRS2的功能,而HbMGT6则完全不能互补ScMRS2的功能。
2.4 HbMGT10的亚细胞定位分析
HbMGT10-GFP表达载体转化水稻原生质体后暗培养24~48 h,使用激光共聚焦显微镜Olympus FV1000观察转化效果。结果表明,HbMGT10-GFP融合蛋白在水稻原生质体中激发的绿色荧光和原生质体叶绿体的自发红光大部分能够重叠在一起,产生黄色荧光,说明HbMGT10定位于叶绿体上(图6)。
3 讨论与结论
Mg2+是叶绿素的中心原子,Mg2+的缺乏,会造成叶片中淀粉和蔗糖的过度积累,产生萎黄病[11]。同时,地上部分比根更容易受到镁缺乏的影响,拟南芥的28Mg同位素示踪实验显示,镁离子主要集中在地上部分较低的位置,难以到达地上部分的顶端[11,24-25]。镁离子转运蛋白可能在植物叶片Mg2+的跨膜运输和维持叶片Mg2+浓度的动态平衡过程中发挥了重要作用。
MGT/MSR2基因家族编码有功能的镁离子转运蛋白,在拟南芥中有10个基因[3-4],水稻中有9个[10],玉米中有12个[16]。前期研究发现巴西橡胶树中有11个MGT/MRS2基因(未发表文献)。本结果显示这些HbMGT基因都在橡胶树叶片中有表达,其中HbMGT10是叶片主要表达的HbMGT基因。酵母突变体互补实验显示HbMGT10是一个有功能的镁离子转运蛋白,它能够部分互补敲除了ScMRS2基因的酵母突变体SEY-mrs2;亚细胞定位显示,HbMGT10定于叶绿体上,可能参与了橡胶树叶绿体中镁离子的跨膜运输。表达分析结果表明,HbMGT10主要在橡胶树成熟期的叶片中表达,而且在一天中光照最强的12 : 00~16 : 00的表达量最强,是晚上和凌晨表达量的3倍,而拟南芥光照4和8 h后,AtMRS2-11基因的表达量是夜晚表达量的2倍[17],HbMGT10基因和拟南芥AtMRS2-11基因一样,其表达受到光的调控。用PlantCARE数据库[26]分析HbMGT10基因的启动子,发现其含有多个光调控的顺式作用元件。研究说明HbMGT10在巴西橡胶树叶片中叶绿体的Mg2+跨膜运输起着重要作用,还可能参与了叶绿体的发育,以及叶绿体不同光照强度下Mg2+浓度的调控,以适应叶片不同的光合作用强度。
本研究首次從巴西橡胶树中克隆了在叶片中主要表达的镁离子转运蛋白基因HbMGT10,通过酵母互补和亚细胞定位分析明确其编码一个有功能的镁离子转运蛋白,并从组织特异性、叶片发育阶段和日变化等方面研究了该基因的表达特性,为深入揭示其生理功能奠定了良好基础。
参考文献
[1] Fox C, Ramsoomair D, Carter C. Magnesium: its proven and potential clinical significance[J]. Southern Medical Journal, 2001, 94(12): 1 195-1 201.
[2] Hermans C, Verbruggen N. Physiological characterization of Mg deficiency in Arabidopsis thaliana[J]. Journal of Experimental Botany, 2005, 56(418): 2 153-2 161.
[3] Li L, Tutone A F, Drummond R S, et al. A novel family of magnesium transport genes in Arabidopsis[J]. The Plant Cell, 2001, 13(12): 2 761-2 775.
[4] Schock I, Gregan J, Steinhauser S, et al. A member of a novel Arabidopsis thaliana gene family of candidate Mg2+ ion transporters complements a yeast mitochondrial group II intron-splicing mutant[J]. The Plant Journal, 2000, 24(4): 489-501.
[5] Gaash R, Elazar M, Mizrahi K, et al. Phylogeny and a structural model of plant MHX transporters[J]. BMC Plant Biology, 2013, 13: 75.
[6] Shaul O, Hilgemann D W, DE-ALMEIDA-ENGLER J, et al. Cloning and characterization of a novel Mg(2+)/H(+) exchanger[J]. The EMBO Journal, 1999, 18(14): 3 973-3 980.
[7] Pottonsin I I, Tikhonova L I, Hedrich R, et al. Slowly activating vacuolar channels can not mediate Ca2+-induced Ca2+ release[J]. The Plant Journal, 1997, 12(6): 1 387-1 398.
[8] Horie T, Brodsky D E, Costa A, et al. K+ transport by the OsHKT2;4 transporter from rice with atypical Na+ transport properties and competition in permeation of K+ over Mg2+ and Ca2+ ions[J]. Plant Physiology, 2011, 156(3): 1 493-1 507.
[9] Guo K M, Babourina O, Christopher D A, et al. The cyclic nucleotide-gated channel AtCNGC10 transports Ca2+ and Mg2+ in Arabidopsis[J]. Physiologia Plantarum, 2010, 139(3): 303-312.
[10] Saito T, Kobayashi N I, Tanoi K, et al. Expression and functional analysis of the CorA-MRS2-ALR-type magnesium transporter family in rice[J]. Plant & Cell Physiology, 2013, 54(10): 1 673-1 683.
[11] Kobayashi N I, Tanoi K. Critical Issues in the Study of Magnesium Transport Systems and Magnesium Deficiency Symptoms in Plants[J]. International Journal of Molecular Sciences, 2015, 16(9): 23 076-23 093.
[12] Conn S J, Conn V, Terman S D, et al. Magnesium transporters, MGT2/MRS2-1 and MGT3/MRS2-5, are important for magnesium partitioning within Arabidopsis thaliana mesophyll vacuoles[J]. The New Phytologist, 2011, 190(3): 583-594.
[13] Li L G, Sokolov L N, Yang Y H, et al. A mitochondrial magnesium transporter functions in Arabidopsis pollen development[J]. Molecular Plant, 2008, 1(4): 675-685.
[14] Gebert M, Meschenmoser K, Svidova S, et al. A root-expressed magnesium transporter of the MRS2/MGT gene family in Arabidopsis thaliana allows for growth in low-Mg2+ environments[J]. The Plant Cell, 2009, 21(12): 4 018-4 030.
[15] Chen J, LI L G, Liu Z H, et al. Magnesium transporter AtMGT9 is essential for pollen development in Arabidopsis[J]. Cell Research, 2009, 19(7): 887-898.
[16] Li H, Du H, Huang K, et al. Identification, and Functional and Expression Analyses of the CorA/MRS2/MGT-Type Magnesium Transporter Family in Maize[J]. Plant & Cell Physiology, 2016, 57(6): 1 153-1 168.
[17] Drummond R S M, Tutone A, Li Y C, et al. A putative magnesium transporter AtMRS2-11 is localized to the plant chloroplast envelope membrane system[J]. Plant Science, 2006, 170(1): 78-89.
[18] Tang C, Qi J, Li H, et al. A convenient and efficient protocol for isolating high-quality RNA from latex of Hevea brasiliensis (para rubber tree)[J]. Journal of Biochemical and Biophysical Methods, 2007, 70(5): 749-54.
[19] Li H, Qin Y, Xiao X, et al. Screening of valid reference genes for real-time RT-PCR data normalization in Hevea brasiliensis and expression validation of a sucrose transporter gene HbSUT3[J]. Plant Science: an International Journal of Experimental Plant Biology, 2011, 181(2): 132-1399.
[20] Ma H, Kunes S, Schatz P J, et al. Plasmid construction by homologous recombination in yeast[J]. Gene, 1987, 58(2-3): 201-216.
[21] Chen S, Tao L, Zeng L, et al. A highly efficient transient protoplast system for analyzing defence gene expression and protein-protein interactions in rice[J]. Mol Plant Pathol, 2006, 7: 417-427.
[22] Wiesenberger G, Waldherr M, Schweyen R J. The nuclear gene MRS2 is essential for the excision of group II introns from yeast mitochondrial transcripts in vivo[J]. The Journal of Biological Chemistry, 1992, 267(10): 6 963-6 969.
[23] Bui D M, Gregan J, Jarosch E, et al. The bacterial magnesium transporter CorA can functionally substitute for its putative homologue Mrs2p in the yeast inner mitochondrial membrane[J]. The Journal of Biological Chemistry, 1999, 274(29): 20 438-20 443.
[24] Tanoi K, Kobayashi N I, Saito T, et al. Effects of magnesium deficiency on magnesium uptake activity of rice root, evaluated using 28Mg as a tracer[J]. Plant and Soil, 2014, 384(1): 69-77.
[25] Sugita R, Kobayashi N I, Saito T, et al. Quantitative Analysis of 28Mg in Arabidopsis using Real-time Radioisotope Imaging System(RRIS)[J]. RADIOISOTOPES, 2014, 63(5): 227-237.
[26] Lescot M, Dehais P, Thijs G, et al. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research, 2002, 30(1): 325-327.
